Formulación química inorgánica: valencia y nomenclatura
Oir Lecc.
Como ya vimos anteriormente definiremos compuesto binario como aquel compuesto químico formado por dos elementos químicos.
Por ejemplo: H2O
De la misma manera, un compuesto ternario es aquel que se encuentra formado por tres elementos químicos.
Por ejemplo: H2SO4
2. Valencia y número de oxidación
La valencia de un elemento químico se entiende como el número de electrones que pone en juego dicho elemento al combinarse con otro elemento químico. Es siempre un número positivo.
El número de oxidación es un número entero que representa el número de electrones que un átomo gana o pierde cuando forma un compuesto determinado.
Metales:
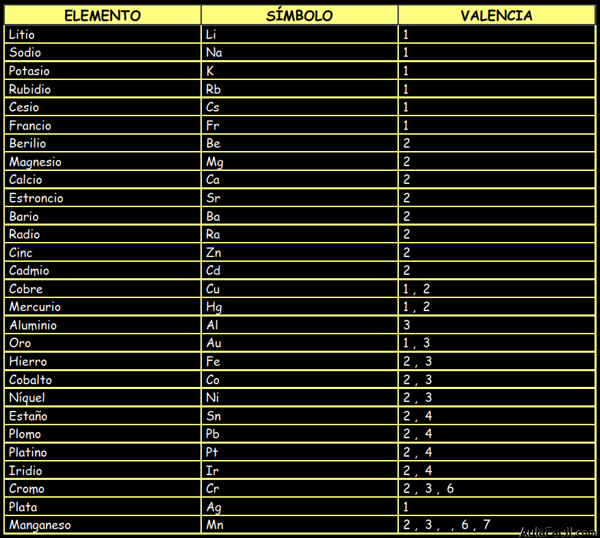
No Metales:
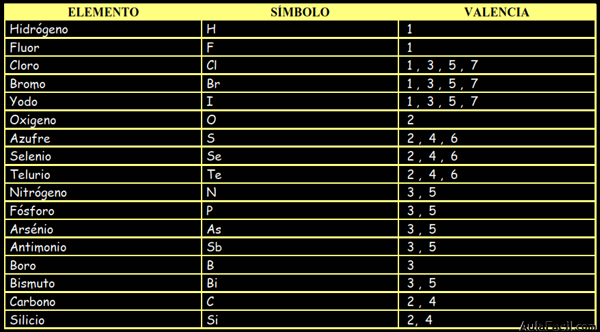
3. Nomenclatura de la química orgánica
En este tema estudiaremos las normas de la IUPAQ (Unión Internacional de Química Pura y Aplicada) que nos permiten nombrar y formular estos compuestos.
Usaremos tres tipos de nomenclatura: tradicional, stock y sistemática.
- Nomenclatura sistemática
Se utilizan prefijos numerales griegos hasta doce, y de trece en adelante números árabes: mono, di, tri, tetra, penta, hexa, hepta, octa, enea, deca, endeca, dodeca, 13, 14, etc. Ejemplos: FeCl3, CaBr2, Cl2O5, Pb(OH)4, Br2O7: tricloruro de hierro, dibromuro de calcio, pentaóxido de dicloro, tetrahidróxido de plomo, heptaóxido de dibromo.
- Nomenclatura en stock
Se coloca la valencia o número de oxidación en números romanos, entre paréntesis, a continuación del nombre del elemento. Cuando sea necesario se utiliza el número árabe cero. Si la valencia es constante no es necesario indicarla. Ejemplos: FeCl3, SnH2, Cu2O, Hg(OH)2: cloruro de hierro (III), hidruro de estaño (II), óxido de cobre (I), hidróxido de mercurio (II).
- Nomenclatura tradicional.Es el sistema más antiguo y consiste en designar el estado de mayor valencia por la terminación "ico" y el de menor valencia mediante la terminación "oso"; cuando existe un solo número de valencia puede emplearse la terminación "ico". Ejemplos: FeCl3, CuO, Pb(OH)2, HgH2, SnSO4: cloruro férrico, óxido cúprico, hidróxido plumboso, hidruro mercúrico, sulfato estannoso.
http://www.aulafacil.com
Nomenclaturas de compuestos inorgánicos
Se aceptan tres tipos de nomenclaturas para nombrar compuestos químicos inorgánicos:
Nomenclatura sistemática o IUPAC, con prefijos / Atomicidad
También llamada racional o estequiométrica. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia.2 En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula.
La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico
(Véase en la sección otras reglas nombre genérico y específico).
Los prefijos son palabras que se anteponen al prefijo nombre del compuesto y representan el número de átomos que hay en la molécula del elemento. Existen diferentes prefijos los cuales provienen del griego y a continuación se presenta el número de átomos al que hace referencia el prefijo.2
(Generalmente solo se utiliza hasta el prefijo hepta-)
| Prefijos griegos | Número de átomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| non-, nona-, eneá- | 9 |
| deca- | 10 |
- El prefijo mono- normalmente se elude salvo que haya posibilidad de confusión.
- Por ejemplo, CrBr3: tribromuro de cromo; CO: monóxido de carbono
- En casos en los que en vez de átomos se trate de grupos de átomos como compuestos tales como sales dobles y triples, oxisales y similares, se pueden emplear los prefijos bis-, tris-, tetraquis, pentaquis, hexaquis, etc.
- Por ejemplo la fluorapatita Ca5F (PO4)3 : fluoruro tris(fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería:
- Ca5F (P3O10)3
Nomenclatura sistemática o IUPAC, con números romanos / Numeral de Stock
También llamada antiguamente nomenclatura de Stock. Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos el estado de oxidación del elemento con “nombre específico”. Si solamente tiene un estado de oxidación, éste no se escribe.
La valencia (o más bien el estado de oxidación) es la que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + "de" + nombre del elemento específico + el estado de oxidación.
Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.
- Ejemplo: Fe2S3, Fe2+3S3-2, sulfuro de hierro (III)
- Ejemplo: SO3, S2+6O6-2, óxido de azufre (VI)
Nomenclatura tradicional, clásica o antigua / Estequiométrica
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento con el sufijo –ico.
-
- K2O, óxido de potasio u óxido potásico
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
-
- …O-2, hierro con la valencia 2, (estado de oxidación +2), óxido ferroso
- … -ico cuando el elemento usa la valencia mayor: Fe2O3, Fe2+3O3-2, hierro con valencia 3, (estado de oxidación +3), óxido férrico3
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
-
- hipo- … -oso (para la menor valencia): P2O, P2+1O-2, fósforo con la valencia 1, (estado de oxidación +1), óxido hipofosforoso
- … -oso (para la valencia intermedia): P2O3, P2+3O3-2, fósforo con valencia 3, (estado de oxidación +3), óxido fosforoso
- … -ico (para la mayor valencia): P2O5, P2+5O5-2, fósforo con valencia 5, (estado de oxidación +5), óxido fosfórico
- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos
-
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia pequeña)
- … -ico (para la valencia grande)
- per- … -ico (para la valencia más grande)
Hoy esta nomenclatura está en desuso. Sin embargo aún se usa mucho en el comercio y la industria.
Otras reglas y conceptos generales
Los compuestos (binarios y ternarios) en su nomenclatura están compuestos por dos nombres: el genérico y el específico. El nombre genérico o general es el que indica a qué grupo de compuestos pertenece la molécula o su función química, por ejemplo si es un óxido metálico/básico, un óxido no metálico/ácido, un peróxido, un hidruro, un hidrácido, un oxácido, una sal haloidea, etc. Y el nombre específico es el que diferencia a las moléculas dentro de un mismo grupo de compuestos. Por lo general en los tres sistemas de nomenclatura se escribe primero el nombre genérico seguido del específico. Por ejemplo: óxido ferroso y óxido férrico, estos dos compuestos pertenecen al grupo de los óxidos y por eso su nombre genérico es óxido y a la vez los nombres específicos ferroso y férrico hacen referencia a dos compuestos diferentes FeO y Fe2 O3, respectivamente.
En general, en una fórmula molecular de un compuesto se coloca a la izquierda el elemento con estado de oxidación positivo (elemento más electropositivo) y a la derecha el que tenga el estado de oxidación negativo (elemento más electronegativo). Y por el contrario, en nomenclatura se coloca primero el nombre genérico, que es el que designa al elemento de la derecha (el más electronegativo), y el nombre específico en segundo lugar, que es el que designa al elemento de la izquierda (el más electropositivo).
Por ejemplo en el óxido de sodio, Na2O, Na+12O-2, el nombre genérico óxido hace referencia al segundo elemento de la fórmula que es el “oxígeno”, el más electronegativo, y el nombre específico “sodio” hace referencia al primer elemento de la fórmula que es el sodio y el menos electronegativo o más electropositivo.
¿Cómo se trabajan los estados de oxidación para poder nombrar correctamente un compuesto inorgánico? Se puede trabajar con más de un estado de oxidación, hasta el estado de oxidación +7 en los elementos representativos (Nota: recordar que aquí estamos mostrando el estado de oxidación como superíndice de cada elemento en la fórmula del compuesto). Con las mismas fórmulas moleculares se puede determinar con qué estado de oxidación actúan los átomos de la sustancia aunque en su fórmula no se observen. Esto se logra con el hecho que en la fórmula de una sustancia la suma de los estados de oxidación de todos los átomos de la sustancia debe ser igual a cero, lo que significa que la molécula será neutra, sin carga.
En el caso de los iones, es decir cuando en la fórmula se indique una carga positiva o negativa para el conjunto, la suma de los estados de oxidación de todos los átomos de la sustancia debe ser igual a la carga del ion.
Véase como ejemplo la imagen del "ácido nítrico" al final de la sección oxácidos, del lado derecho de la imagen se encuentran el ion nitrato y el ion hidrógeno con cargas -1 y +1, respectivamente).
Como ejemplo para trabajar con valencias: FeO, este compuesto es un óxido y el oxígeno en los óxidos actúa con un estado de oxidación -2, así que para que la molécula sea neutra el hierro debe sumar el número de estados de oxidación suficientes para que la suma de los estados de oxidación sea cero. Los estado de oxidación con los que puede trabajar el hierro son +2 y +3, así que, en esta molécula el hierro va a utilizar el estado de oxidación +2. Como solo hay un átomo de hierro y la valencia es +2, el átomo de hierro en esa molécula tiene estado de oxidación +2 y de igual manera como solo hay un átomo de oxígeno y trabaja con el estado de oxidación -2, la suma de todos los estados de oxidación del oxígeno es -2. Y ahora la suma de todos los estados de oxidación de los átomos es igual a cero, pues la molécula es neutra, no tiene carga (+2) + (-2) = 0. La fórmula con estados de oxidación para este compuesto sería Fe2O-2.
En otro ejemplo, en el compuesto Fe2O3 se busca también un cero en la suma de los estado de oxidación de todos los átomos, para que la molécula sea neutra, así que como hay 3 átomos de oxígeno y este trabaja con el estado de oxidación -2, la suma de los estados de oxidación para los oxígenos en la molécula “son el número de átomos del elemento multiplicado por el estado de oxidación con el que este trabaja”, que en total sería -6. De esta manera los átomos de hierro deben de sumar estados de oxidación para que la suma total dé cero, pues la molécula es neutra. Como hay 2 átomos de hierro, este va a trabajar con el estado de oxidación +3 para hacer un total de +6, que sumados con los -6 de los oxígenos sería igual a cero, que significa una carga cero para la molécula. Los números de átomos y estado de oxidación en la molécula son:
- Número de átomos de hierro = (2)
- Estados de oxidación para cada uno de los átomos de hierro = (+3)
- Número de átomos de oxígeno = (3)
- Estados de oxidación para cada uno de los átomos de oxígeno = (-2)
La operatoria completa se vería así: [2(+3)] + [3(-2)] = 0. La fórmula con estados de oxidación sería Fe23O3-2. Como ya se había explicado anteriormente el estado de oxidación indica los electrones que intervienen en un enlace, y en este último compuesto, Fe23O3-2, cada uno de los dos átomos de hierro está cediendo 3 electrones a los átomos de oxígeno y a la vez cada uno de los tres átomos de oxígeno está ganando 2 electrones; dos de los tres átomos de oxígeno reciben 2 electrones de los dos átomos de hierro, y el tercer de oxígeno recibe 2 electrones, 1 electrón sobrante de cada uno de los dos átomos de hierro.
Tabla de números de valencia
- En la siguiente tabla se presentan los elementos que generalmente se usan para formar compuestos. Los estados de oxidación están en valor absoluto, es decir, son valencias.
| Elemento | Símbolo | Estado de oxidación | Elemento | Símbolo | Estado de oxidación | |
|---|---|---|---|---|---|---|
| Aluminio | Al | 3 | Antimonio | Sb | 3 y 5 | |
| Arsénico | As | 3 y 5 | Ástato | At | 1, 3, 5 y 7 | |
| Azufre | S | 2, 4 y 6 | Bario | Ba | 2 | |
| Berilio | Be | 2 | Bismuto | Bi | 3 y 5 | |
| Boro | B | 3 | Bromo | Br | 1 y 5 | |
| Cadmio | Cd | 2 | Calcio | Ca | 2 | |
| Carbono | C | 2 y 4 | Cesio | Cs | 1 | |
| Cinc | Zn | 2 | Circonio | Zr | 4 | |
| Cloro | Cl | 1, 3, 5 y 7 | Cobalto | Co | 2 y 3 | |
| Cobre | Cu | 2 y 1 | Cromo | Cr | 2, 3, 4, 5 y 6 | |
| Escandio | Sc | 3 | Estaño | Sn | 2 y 4 | |
| Estroncio | Sr | 2 | Flúor | F | 1 | |
| Fósforo | P | 1,3 y 5 | Galio | Ga | 3 | |
| Germanio | Ge | 2,4 y -4 | Hafnio | Hf | 4 | |
| Hidrógeno | H | 1 y -1 | Hierro | Fe | 2 y 3 | |
| Iridio | Ir | 2, 3, 4 y 6 | Itrio | Y | 3 | |
| Lantano | La | 3 | Litio | Li | 1 | |
| Magnesio | Mg | 2 | Manganeso | Mn | 2, 3, 4, 6, 7 | |
| Mercurio | Hg | 1 y 2 | Molibdeno | Mo | 2, 3, 4, 5 y 6 | |
| Niobio | Nb | 3 | Níquel | Ni | 2 y 3 | |
| Nitrógeno | N | 2, 3, 4 y 5 | Oro | Au | 1 y 3 | |
| Osmio | Os | 2, 3, 4 y 6 | Oxígeno | O | -2 | |
| Plata | Ag | 1 | Platino | Pt | 2 y 4 | |
| Plomo | Pb | 2 y 4 | Potasio | K | 1 | |
| Renio | Re | 1, 2, 4, 6 y 7 | Rodio | Rh | 2, 3 y 4 | |
| Rubidio | Rb | 1 | Rutenio | Ru | 2, 3, 4, 6 y 8 | |
| Selenio | Se | 2, 4 y 6 | Silicio | Si | 4 | |
| Sodio | Na | 1 | Talio | Tl | 1 y 3 | |
| Tántalo | Ta | 5 | Tecnecio | Tc | 7 | |
| Telurio | Te | 2, 4 y 6 | Titanio | Ti | 3 y 4 | |
| Vanadio | V | 2, 3, 4 y 5 | Yodo | I | +/-1,3, 5 y 7 |
Véase también: Estructura de Lewis
Óxidos (compuestos binarios con oxígeno)
Los óxidos son compuestos químicos inorgánicos binarios formados por la unión del oxígeno con otro elemento diferente. Según si este elemento es metal o no metal serán óxidos básicos u óxidos ácidos. El oxígeno en los óxidos siempre tiene estado de oxidación -2, salvo excepciones que se ven más adelante.
Los óxidos se pueden nombrar en cualquiera de los tres sistemas de nomenclatura; si se utiliza la nomenclatura sistemática estequiométrica con números romanos (antigua de Stock), el número romano es igual a la valencia del elemento diferente del oxígeno; si se utiliza el sistema tradicional los sufijos y prefijos se asignan de acuerdo a las valencias de cada elemento y si se utiliza la nomenclatura sistemática con prefijos no se tienen en cuenta las valencias, sino que se escriben los prefijos en cada elemento de acuerdo a sus atomicidades en la fórmula molecular. Hay excepciones que se ven más adelante.
Tipos de óxidos
Según la estequiometria del compuesto:
- Óxidos binarios, formados por oxígeno y otro elemento.
- Óxidos mixtos, formados por dos elementos distintos y oxígeno como son las espinelas.
Atendiendo al comportamiento químico hay tres tipos de óxidos: óxidos básicos, ácidos y óxidos anfóteros, aunque no muy comunes en la naturaleza.
Óxidos básicos (metálicos)
Son aquellos óxidos que se producen entre el oxígeno y un metal cuando el oxígeno actúa con un estado de oxidación -2. Su fórmula general es: metal más oxígeno. En la nomenclatura estequiométrica con números romanos (antigua de Stock) los compuestos se nombran con las reglas generales anteponiendo como nombre genérico la palabra óxido seguido por el nombre del metal y su estado de oxidación en números romanos y sin signo. En la nomenclatura tradicional se nombran con los sufijos -oso e -ico dependiendo de la menor o mayor valencia del metal que acompaña al oxígeno. Y en la nomenclatura sistemática con prefijos se utilizan las reglas generales con la palabra óxido como nombre genérico y los prefijos correspondientes a cada elemento según el número de átomos de este en la fórmula.. En la nomenclatura antigua o tradicional, ya en desuso, se les llaman también anhídridos o anhidridos básicos; ya que al agregar agua, pueden formar hidróxidos básicos. En la nomenclatura tradicional para los óxidos que se enlazan con metales que tienen más de dos estados de oxidación se utilizan las siguientes reglas: metales con estados de oxidación hasta el +3 se nombran con las reglas de los óxidos y los metales con estados de oxidación mayores o iguales a 4 se nombran con las reglas de los anhídridos. Ejemplos: V2+3O3-2 se nombra como óxido vanadoso; V2+5 O5-2 se nombra como óxido vanádico.
| Compuesto | Nomenclatura sistemática con prefijos | Nomenclatura sistemática con números romanos | Nomenclatura tradicional |
|---|---|---|---|
| K2O | óxido de dipotasio4 o monóxido de dipotasio | óxido de potasio4 | óxido potásico u óxido de potasio |
| Fe2O3 | trióxido de dihierro | óxido de hierro(III) | óxido férrico |
| FeO | monóxido de hierro | óxido de hierro(II) | óxido ferroso |
| SnO2 | dióxido de estaño | óxido de estaño(IV) | óxido estánico |
Cuando el nitrógeno, que es un no metal, actúa con los estados de oxidación +4 y +2, al enlazarse con el oxígeno, forma óxidos básicos similares a los de los metales (ver la sección de anhídridos, penúltimo párrafo).
Para nombrar a los óxidos básicos, se deben observar los estados de oxidación, o valencias, de cada elemento. Hay tres tipos de nomenclatura: tradicional, sistemática con prefijos y sistemática con números romanos (antigua de Stock).
1. Cuando un elemento tiene un solo número de oxidación, por ejemplo el galio), estado de oxidación +3, el óxido Ga2O3 se nombra así:
- Tradicional: óxido de galio.
- Sistemática con prefijos: Se nombra según la cantidad de átomos que tenga cada elemento en la molécula. En este caso, es trióxido de digalio (ya que la molécula del óxido queda Ga2O3).
- Sistemática con números romanos: Es igual a la nomenclatura tradicional, pero añadiendo el estado de oxidación en números romanos entre paréntesis. Recordemos que si el elemento sólo tiene un estado de oxidación, éste no se escribe: óxido de galio.
2. Cuando un elemento tiene dos números de oxidación, por ejemplo el Plomo), +2 y +4, los óxidos PbO y PbO2 se nombran así:
- Tradicional: PbO óxido plumboso (cuando el estado de oxidación utilizado es el menor), y PbO2 óxido plúmbico (cuando es el mayor).
- Ejemplos:
- Óxido cuproso: Cu2 O
- Óxido cúprico: CuO
- Óxido ferroso: FeO
- Óxido férrico: Fe2O3
- Sistemática con prefijos:
Este tipo de nomenclatura necesita de los siguientes prefijos:
| Prefijo | Número de átomos |
|---|---|
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| nona- | 9 |
| deca- | 10 |
Cuando el prefijo termina con las letras a u o, se eliminan antes de la palabra: Ej.: mono: Mon-oxido. Quedaría de tal manera: Monóxido. Estaría mal escrito; Monoóxido Hepta: Hept-óxido. Quedaría de tal manera heptóxido. Estaría mal escrito heptaóxido. Ej.: la escritura va de derecha a izquierda
- P2O3
- trióxido de difósforo
- Numeral de Stock: en esta nomenclatura solo se necesita saber el número de valencia del metal, para escribirlo al final de la fórmula en números romanos entre paréntesis.
Ej.: P2O3 óxido de fósforo(III)
3. Cuando un elemento tiene más de dos números de oxidación (puede llegar a tener hasta cuatro) se los denomina de la siguiente manera.
- Tradicional:
- cuando el elemento tiene una sola valencia se añade la terminación -ico, o simplemente se escribe la palabra óxido seguido de la preposición "de" y enseguida el nombre del elemento.
- cuando el elemento tiene dos valencias se añade la terminación -oso a la más pequeña y la terminación -ico a la más grande
- cuando el elemento tiene tres valencias se añade a la más pequeña hipo-oso con el elemento entre medias, a la intermedia se le añade la terminación -oso y a la más grande la terminación -ico
- cuando el elemento tiene cuatro valencias se añade a la más pequeña hipo-oso, a la siguiente -oso, a la siguiente -ico y por último a la más grande per-ico
- Atomicidad: es igual que en los casos anteriores. Por ejemplo, si la molécula es de uranio y queda formada como U2O3, su nomenclatura es "Trióxido de diuranio".
- Numeral de Stock: Exactamente igual que en los casos anteriores, se escribe el óxido normalmente y se le agrega el número de oxidación entre paréntesis.
Óxidos ácidos o anhídridos (no metálicos)
Son aquellos formados por la combinación del oxígeno con un no metal. Su fórmula general es no metal + O. En este caso, la nomenclatura tradicional emplea la palabra anhídrido en lugar de óxido, a excepción de algunos óxidos de nitrógeno y fósforo. La nomenclatura sistemática y la Stock nombran a los compuestos con las mismas reglas que en los óxidos metálicos. En la nomenclatura tradicional se nombran con los siguientes sufijos y prefijos.
| # de Valencia | Prefijo | Raíz - Elemento | Sufijo | |
|---|---|---|---|---|
| 1 | única | ..... | elemento | ico |
| 2 | mayor | ..... | elemento | ico |
| 2 | menor | ..... | elemento | oso |
| 3 | mayor | ..... | elemento | ico |
| 3 | intermedia | ..... | elemento | oso |
| 3 | menor | hipo | elemento | oso |
| 4 | máxima | per | elemento | ico |
| 4 | mayor | ..... | elemento | ico |
| 4 | menor | ..... | elemento | oso |
| 4 | mínima | hipo | elemento | oso |
| Compuesto | Nomenc. sistem. | Nomenc. Stock | Nomenc. tradicional |
|---|---|---|---|
| Cl2O | óxido de dicloro o monóxido de dicloro | óxido de cloro (I) | anhídrido hipocloroso |
| SO3 | trióxido de azufre | óxido de azufre (VI) | anhídrido sulfúrico |
| Cl2O7 | heptóxido de dicloro | óxido de cloro (VII) | anhídrido perclórico |
Cuando el flúor reacciona con el oxígeno se crea un compuesto diferente a un óxido ácido ya que el oxígeno deja de ser el elemento más electronegativo, distinto a como pasa con todos los óxidos donde el oxígeno es el elemento más electronegativo. El único elemento más electronegativo que el oxígeno es el flúor con 4.0 mientras el oxígeno tiene 3.5. Así que el compuesto deja de llamarse óxido y se nombra como fluoruro de oxígeno para el sistema tradicional, fluoruro de oxígeno (II) para el sistema Stock y difluoruro de oxígeno para el sistemático. La fórmula es O2F2-1.
Los óxidos de nitrógeno, al igual que los óxidos del azufre, son importantes por su participación en la lluvia ácida. Con el término óxido de nitrógeno se hace alusión a cualquiera de los siguientes:
- Óxido nítrico u Óxido de nitrógeno (II), de fórmula NO.
- Dióxido de nitrógeno, de fórmula NO2.
- Óxido nitroso o Monóxido de dinitrógeno, de fórmula N2O.
- Trióxido de dinitrógeno, de fórmula N2O3.
- Tetróxido de dinitrógeno, de fórmula N2O4.
- Pentóxido de dinitrógeno, de fórmula N2O5.
Entre las excepciones a las reglas de anhídridos para la nomenclatura tradicional están los óxidos de nitrógeno y óxidos de fósforo. Estos compuestos se nombran así:
- N21O-2 Anhídrido hiponitroso
- N2O-2 Óxido hiponitroso
- N23O3-2 Anhídrido nitroso
- N24O4-2 Óxido nitroso
- N4O2-2 Óxido nitroso
- N25O5-2 Anhídrido nítrico
- P23O3-2 Anhídrido fosforoso
- P4O2-2 Óxido fosforoso
- P25O5-2 Anhídrido fosfórico
Cuando los metales, con más de dos números de valencia y que trabajan con los números de valencia iguales o mayores a 4, se enlazan con el oxígeno, forman anhídridos (ver la sección de óxidos básicos, segundo párrafo).
Óxidos dobles
Resultan de escribir en una sola forma las fórmulas de los óxidos terminados en OSO e ICO. Se les nombra con la palabra ÓXIDO seguida de los “nombres iónicos” de los metales.
- FeO+Fe2O3=Fe3O4 óxido ferroso férrico
- 2SnO+SnO=Sn3O4 óxido estañoso estánico
- 2PbO+Pb2O3=Pb3O4 óxido plumboso plúmbico
- MnO+Mn2O3=Mn3O4 óxido manganoso mangánico
Peróxidos
Los peróxidos se obtienen por reacción de un óxido con oxígeno monoatómico y se caracterizan por llevar el grupo peróxido o unión peroxídica (-o-o-). Son compuestos diatómicos en donde participan el grupo peróxido y un metal. La fórmula general de los peróxidos es metal + (O-1) 2-2. En el sistema tradicional se utiliza el nombre peróxido en lugar de óxido y se agrega el nombre del metal con las reglas generales para los óxidos en esta nomenclatura. En las nomenclaturas Stock y sistemática se nombran los compuestos con las mismas reglas generales para los óxidos.
No todos los metales forman peróxidos y habitualmente lo hacen los del grupo 1A y 2A de la tabla periódica (alcalinos y alcalinotérreos).
| Compuesto | Nomenc. sistemática | Nomenc. Stock | Nomenc. tradicional |
|---|---|---|---|
| H2O2 | peróxido de dihidrógeno | peróxido de hidrógeno | peróxido hidrogénico |
| CaO2 | peróxido de calcio | peróxido de calcio | peróxido cálcico |
| ZnO2 | peróxido de zinc | peróxido de zinc (II) | peróxido zínquico |
Superóxidos
Los superóxidos, también llamados hiperóxidos, son compuestos binarios que contienen el grupo o anión superóxido, la fórmula general es metal + (O 2)-1 Aparentemente, el oxígeno tiene valencia -1/2. Generalmente el grupo superóxido reacciona con los elementos alcalinos y alcalinotérreos.
Se nombran como los peróxidos tan solo cambiando peróxido por superóxido o hiperóxido.
| Compuesto | Nomenclatura |
|---|---|
| KO2 | superóxido o hiperóxido de potasio |
| CaO4 ó Ca (O2)2 | superóxido de calcio |
| CdO4 | superóxido de cadmio |
Ozónidos
Son compuestos binarios formados por el grupo ozónido, que son 3 oxígenos enlazados con una valencia total de -1. La fórmula general para los ozónidos es metal + (O3)-1. Los ozónidos se nombran de forma análoga a los peróxidos con la diferencia que en estos compuestos se utiliza el nombre ozónido en lugar de peróxido.
| Compuesto | Nomenclatura |
|---|---|
| KO3 | ozónido de potasio |
| RbO3 | ozónido de rubidio |
| CsO3 | ozónido de cesio |
Hidruros (compuestos binarios con hidrógeno)
Los hidruros son compuestos binarios formados por hidrógeno y otro elemento.
Hidruros metálicos
Son compuestos binarios o diatómicos formados por hidrógeno y un metal. En estos compuestos, el hidrógeno siempre tiene valencia -1. Se nombran con la palabra hidruro. Su fórmula general es Metal + H. Para nombrar estos compuestos en el sistema tradicional se utiliza la palabra hidruro y se agrega el nombre del metal con los sufijos -oso o -ico con las reglas generales para esta nomenclatura. Para las nomenclaturas Stock y sistemática se utilizan las reglas generales con la palabra hidruro como nombre genérico.
| Compuesto | Nomenc. sistemática | Nomenc. Stock | Nomenc. tradicional |
|---|---|---|---|
| KH | monohidruro de potasio | hidruro de potasio4 | hidruro potásico o hidruro de potasio |
| NiH3 | trihidruro de níquel | hidruro de níquel (III) | hidruro niquélico |
| PbH4 | tetrahidruro de plomo | hidruro de plomo (IV) | hidruro plúmbico |
Hidrácidos o hidruros no metálicos
Los hidrácidos (compuestos binarios ácidos) o hidruros no metálicos son compuestos formados entre el hidrógeno y un no metal de las familias VIA y VIIA ( anfígenos y halógenos respectivamente). Los elementos de estas dos familias que pueden formar hidrácidos e hidruros no metálicos son: S, Se, Te, F, Cl, I y Br, que por lo general trabajan con el menor número de oxidación, -2 para los anfígenos y -1 para los halógenos. Estos compuestos se nombran en el sistema tradicional y de forma diferente según si están disueltos (estado acuoso) o en estado puro (estado gaseoso). Los hidrácidos pertenecen al grupo de los ácidos, Ver la sección oxácidos.
Los hidruros no metálicos son los que se encuentran en estado gaseoso o estado puro y se nombran agregando al no metal el sufijo -uro y la palabra hidrógeno precedido de la sílaba “de”. En este caso el nombre genérico es para el elemento más electropositivo que sería el del hidrógeno y el nombre especifico es para el elemento más electronegativo que sería el del no metal, por ejemplo H+1 Br-1 (g) bromuro de hidrógeno, bromuro como nombre específico e hidrógeno como nombre genérico.
Los hidrácidos provienen de disolver en agua a los hidruros no metálicos y por esa misma razón son estos los que se encuentran en estado acuoso. Se nombran con la palabra ácido, como nombre genérico, y como nombre específico se escribe el nombre del no metal y se le agrega el sufijo –hídrico. Al igual que en estado gaseoso el nombre genérico es nombrado por el elemento más electropositivo.
| Compuesto | en estado puro | en disolución |
|---|---|---|
| HCl | cloruro de hidrógeno | ácido clorhídrico |
| HF | fluoruro de hidrógeno | ácido fluorhídrico |
| HBr | bromuro de hidrógeno | ácido bromhídrico |
| HI | yoduro de hidrógeno | ácido yodhídrico |
| H2S | sulfuro de hidrógeno | ácido sulfhídrico |
| H2Se | seleniuro de hidrógeno | ácido selenhídrico |
| H2Te | teluluro de hidrógeno | ácido telurhídrico |
Hidruros con los nitrogenoides
Estos hidrácidos o hidruros no metálicos son compuestos binarios de hidrógeno y un elemento de la familia (V) (nitrogenoides) que se enlazan siguiendo la fórmula No Metal + H3. A estos compuestos se les llama por sus nombres comunes, aunque muy raramente se les nombra con las reglas de nomenclatura de los hidruros (metálicos). En estos hidruros no metálicos el hidrógeno es el elemento más electronegativo en el compuesto.
| Compuesto | Nombre |
|---|---|
| NH3 | amoniaco o trihidruro de nitrógeno |
| PH3 | fosfano o trihidruro de fósforo |
| AsH3 | arsano o trihidruro de arsénico |
| SbH3 | estibano o trihidruro de antimonio |
| BiH3 | bismutano o trihidruro de bismuto |
| BH3 | borano o trihidruro de boro |
| B2H6 | diborano o hexahidruro de boro |
| CH4 | metano o tetrahidruro de carbono |
| SiH4 | silano o tetrahidruro de silicio |
| GeH4 | germano o tetrahidruro de germanio |
Boranos
Los boranos son compuestos binarios entre el hidrógeno y el boro que generalmente se enlazan siguiendo la fórmula BnHn+4. Estos compuestos no se nombran en un sistema de nomenclatura específico ya que las reglas para nombrarlos son especiales. Se utiliza la palabra borano con un prefijo numérico griego (tabla de prefijos) que depende del número de átomos de borano presentes en la molécula.
| Compuesto | Nombre |
|---|---|
| BH3 | monborano o borano |
| B2H6 | diborano |
| B3H7 | triborano |
| B4H8 | tetraborano |
| B10H14 | decaborano |
Silanos
Los silanos son compuestos binarios de hidrógeno y silicio que se enlazan generalmente siguiendo la fórmula SinH2n+2. Los silanos al igual que los boranos no tienen un sistema de nomenclatura específico para ser nombrados y utilizan las mismas reglas de nomenclatura, con la palabra silano como base.
| Compuesto | Nombre |
|---|---|
| SiH4 | monosilano, silano o tetrahidruro de silano |
| Si2H6 | disilano |
| Si3H8 | trisilano |
| Si4H10 | tetrasilano |
| Si10H22 | decasilano |
Germanos
Los germanos son compuestos binarios de hidrógeno y germanio que se enlazan generalmente siguiendo la misma fórmula que los silanos GenH2n+2. Los germanos al igual que los boranos y silanos no tienen un sistema de nomenclatura específico para ser nombrados y utilizan las mismas reglas de nomenclatura que los silanos, con la palabra germano como base.
| Compuesto | Nombre |
|---|---|
| GeH4 | monogermano, germano o tetrahidruro de germano |
| Ge2H6 | digermano |
| Ge3H8 | trigermano |
| Ge4H10 | tetragermano |
| Ge10H22 | decagermano |
Oxácidos (compuestos ternarios ácidos)
Los oxácidos, también llamados oxoácidos y oxiácidos, son compuestos ternarios ácidos originados de la combinación del agua con un anhídrido u óxido ácido. La fórmula general para los oxácidos es H + NoMetal + O. En el sistema tradicional se les nombra con las reglas generales para los anhídridos sustituyendo la palabra anhídrido por ácido (ya que de los anhídridos se originan). Para el sistema Stock se nombra al no metal con el sufijo –ato, luego el número de valencia del no metal y por último se agrega “de hidrógeno”. Y para la nomenclatura sistemática se indica el número de átomos de oxígeno con el prefijo correspondiente (según reglas generales para este sistema) seguido de la partícula “oxo” unida al nombre del no metal y el sufijo –ato, por último se agrega al nombre las palabras “de hidrógeno”.
| Compuesto | Nomenclatura sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| H2SO4 | tetraoxosulfato de Hidrógeno | sulfato (VI) de hidrógeno4 | ácido sulfúrico |
| HClO4 | ácido tetraoxoclórico | clorato (VII) de hidrógeno4 | ácido perclórico |
| H2SO2 | ácido dioxosulfúrico | sulfato (II) de hidrógeno4 | ácido hiposulfuroso |
Como se indica en la sección de los anhídridos, el nitrógeno y el fósforo no forman anhídridos cuando se enlazan con el oxígeno, mientras estos trabajan con los números de valencia 4 y 2, si no que forman óxidos y por esta razón el nitrógeno y el fósforo no pueden formar oxácidos con estos números de valencia.
Ya que para nombrar a los compuestos se necesita saber con qué números de valencia trabajan los elementos, una manera muy fácil para determinar los números, según la fórmula molecular, es sumando los números de valencia del oxígeno y el hidrógeno planteando una ecuación para la valencia del no metal, ya que la suma de cargas o valencias debe ser cero para que la molécula sea neutra (ver la sección reglas generales). Como se describe anteriormente la fórmula general para estos compuestos es H + NoMetal + O, donde el oxígeno es el elemento más electronegativo y el hidrógeno y el no metal son los elementos más electropositivos. El hidrógeno trabaja con la valencia +1 y el oxígeno con la valencia -2, siempre en estos compuestos. Por ejemplo: H2SO4, como hay 4 átomos de oxígeno y este trabaja con -2, en total para los oxígenos la carga seria de -8. De la misma manera, como hay 2 hidrógenos y este trabaja con valencia +1 la carga para este elemento es de +2. Como la suma de las cargas debe ser igual a cero, entonces el azufre trabajara con la valencia +6. Los elementos con valencias y la operatoria serían: H2+1 + S+6 + O4-2 => (+1)2 + (+6) + (-2)4 = 0. Como el azufre trabaja con +6 su terminación o sufijo sería –ico y el compuesto se nombraría “ácido sulfúrico”.
Por otra parte, ciertos anhídridos pueden formar hasta tres oxácidos distintos dependiendo de cuantas moléculas de agua se agreguen por molécula de anhídrido. En otras palabras, en ciertos oxácidos especiales, un solo “no metal” con una sola valencia puede formar hasta tres oxácidos. Estos elementos son el yodo, fósforo, silicio, boro y teluro. Para diferenciar a estos oxácidos en el sistema tradicional se utilizan tres prefijos dependiendo de cuantas moléculas de agua se agregan por cada una molécula de anhídrido. Estos son:
- meta-… (1 molécula de agua)
- piro-… (2 moléculas de agua)
- orto-… (3 moléculas de agua) este prefijo se puede omitir
El silicio y el yodo también pueden formar oxácidos con más de una molécula de agua, en dos casos especiales.
| Compuesto | Nom. sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| P2O5 + H2O → 2HPO3 | ácido trioxofosfórico | trioxofosfato (V) de hidrógeno | ácido metafosfórico |
| P2O5 + 2H2O → H4P2O7 | ácido heptaoxodifosfórico | heptaoxodifosfato (V) de hidrógeno | ácido pirofosfórico |
| P2O5 + 3H2O → 2H3PO4 | ácido tetraoxofosfórico | tetraoxofosfato (V) de hidrógeno | ácido ortofosfórico o ácido fosfórico |
| I2O7 + 5H2O → 2H5IO6 | ácido hexaoxoyódico | hexaoxoyodato (VII) de hidrógeno | ácido ortoperyódico |
| SiO2 + 2H2O → H4SiO4 | ácido tetraoxosilícico | tetraoxosilicato (IV) de hidrógeno | ácido ortosilícico (excepción solo 2 moléculas de agua) |
Como se describe previamente los oxácidos están formados por un anhídrido (no metal + oxígeno) y el hidrógeno, pero como se indica en la secciones de anhídridos y óxidos básicos algunos metales, también pueden formar anhídridos, y por esta razón, también pueden formar oxácidos.
| Compuesto | Nomenclatura sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| H2CrO4 | ácido tetraoxocrómico | cromato (VI) de hidrógeno4 | ácido crómico |
| H2MnO3 | ácido trioxomangánico | manganato (IV) de hidrógeno4 | ácido manganoso |
| H2MnO4 | ácido tetraoxomangánico | manganato (VI) de hidrógeno4 | ácido mangánico |
| HMnO4 | ácido tetraoxomangánico | manganato (VII) de hidrógeno4 | ácido permangánico |
| HVO3 | ácido trioxovanádico | vanadato (V) de hidrógeno4 | ácido vanádico |
Los oxiácidos son compuestos que presentan uniones covalentes, pero cuando se disuelven en agua ceden fácilmente iones H+1 (protones). Esto se debe a que el agua, por la naturaleza polar de sus moléculas, tiene tendencia a romper las uniones covalentes polares de los ácidos, con formación de iones H+1 y del anión ácido correspondiente. Por ejemplo, el ácido nítrico que se disuelve en agua da lugar a un anión nitrato y un catión hidrógeno.
La ionización de un oxácido al disolverse en agua es un ejemplo de proceso que se cumple en ambos sentidos, es decir que, al mismo tiempo que se forman iones a partir del ácido, este se regenera constantemente por la unión de aniones y cationes. Los procesos de esta naturaleza se denominan reversibles.
Clasificación
Polibidratados
Su fórmula general es: Un óxido no metálico mas "n" moleculas de agua (H2O)
Ácidos
Los ácidos son compuestos que se originan por combinación del agua con un anhídrido u óxido ácido, o bien por disolución de ciertos hidruros no metálicos en agua. En el primer caso se denominan oxácidos y en el segundo, hidrácidos. Ácido, también es toda sustancia que en solución acuosa se ioniza, liberando cationes de hidrógeno.
Hidróxidos o bases (compuestos ternarios básicos)
Los hidróxidos son compuestos ternarios básicos formados por la unión de un óxido básico con agua. Se caracterizan por tener en solución acuosa el radical o grupo oxhidrilo o hidroxilo OH-1. Para nombrarlos se escribe con la palabra genérica hidróxido, seguida del nombre del metal electropositivo terminado en -oso o -ico según las reglas generales para el sistema tradicional. La fórmula general es Metal + (OH)-1x. En la nomenclatura Stock y sistemática se nombran genéricamente como hidróxido y las respectivas reglas generales.
| Compuesto | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|---|
| Li (OH) | hidróxido de litio | hidróxido de litio (I) | hidróxido de litio |
| Pb (OH)2 | dihidróxido de plomo | hidróxido de plomo (II) | hidróxido plumboso |
| Al (OH)3 | trihidróxido de aluminio | hidróxido de aluminio (III) | hidróxido de aluminio |
Los hidróxidos cuando se disuelven en agua se ionizan formando cationes metal e iones hidroxilo u oxhidrilo. Este proceso de ionización es reversible, es decir que así como se forma los cationes metal e iones hidroxilo a partir de un hidróxido, inversamente, también se pueden formar hidróxidos a partir de los cationes e iones ya mencionados.
Un caso especial lo constituye el hidróxido de amonio. El amoniaco es un gas muy soluble en agua, su fórmula es NH3. Al disolverse reacciona con el agua formando el compuesto hidróxido de amonio. Este proceso es reversible.
Sales
Las sales son compuestos que resultan de la combinación de sustancias ácidas con sustancias básicas. Las sales comprenden tanto compuestos binarios o diatómicos, como ternarios. Y hay distintos tipos o formas de clasificarlas que son: sales neutras, sales ácidas, sales básicas y sales mixtas.
Sales neutras
Las sales neutras son compuestos formados por la reacción de un ácido con un hidróxido (compuesto ternario básico) formando también agua. Entre las sales neutras se encuentran las binarias y las ternarias, que se diferencian entre si por el ácido con el que reaccionan, siendo estos un hidrácido o un oxácido.
Cuando reacciona un ácido con un hidróxido para formar una sal neutra se combinan todos los cationes hidronio (H+1) con todos los aniones hidroxilo (OH-1). Los cationes H+1 son los que dan la propiedad de ácido a los hidrácidos y oxácidos, y los aniones OH-1 son los que dan propiedad de base a los hidróxidos, y cuando estos ácidos y bases reaccionan dan lugar a una ización, que es la formación de agua, mientras que los iones restantes de la reacción forman una sal. Es por esta razón que estas sales reciben el nombre de "neutras". Ver las ecuaciones abajo mostradas.
Las sales neutras binarias o sales haloideas son compuestos formados por un hidrácido y un hidróxido. Para nombrarlos en el sistema tradicional, stock y sistemático se aplican las reglas generales usando el nombre del no metal con el sufijo –uro como nombre genérico y el nombre del metal como nombre específico.
En las dos primeras ecuaciones se presenta el proceso completo para la formación de una sal neutra binaria y en las últimas dos se ejemplifica por separado la neutralización y la formación de la sal neutra.
| Compuesto | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura Tradicional |
|---|---|---|---|
| NaCl | cloruro de sodio | cloruro de sodio (I) | cloruro sódico o cloruro de sodio |
| CaF2 | difluoruro de calcio | fluoruro de calcio (II) | fluoruro cálcico |
| FeCl3 | tricloruro de hierro | cloruro de hierro (III) | cloruro férrico |
| CoS | monosulfuro de cobalto | sulfuro de cobalto (II) | sulfuro cobaltoso |
- Nota: para el correcto nombramiento de estos compuestos hacer énfasis en que los no metales de los hidrácidos trabajan con la menor valencia (1 y 2), y como son los hidrácidos que reaccionan con los hidróxidos para formar las sales neutras binarias. Es por esta razón que en el caso del FeCl3 el hierro oficia con la valencia +3 y el "no metal" cloro con -1, aunque éste posea las valencias 1, 3, 5 y 7.
Las sales neutras ternarias son compuestos formados por un hidróxido y un oxácido. La denominación que reciben las sales provienen del nombre del ácido, oxácido, que las origina. Para nombrar una sal cuando deriva de un ácido cuyo nombre específico termina en -oso, se reemplaza dicha terminación por -ito. Análogamente cuando el nombre específico del ácido termina en –ico, se reemplaza por -ato. Por ejemplo: el Hidróxido de sodio (Na(OH)) reacciona con el ácido ortofósforico o ácido fosfórico (H3PO4) para formar la sal fosfato de sodio u ortofosfato de sodio (Na3PO4).
Otra manera para saber cuándo utilizar los sufijos –ito o –ato, en lugar de determinar de qué ácido proviene la sal neutra, para así nombrar el compuesto; se determina el número de valencia con el que figura el no metal diferente de oxígeno en el compuesto. El procedimiento es similar al utilizado en los oxácidos (sección oxácidos, tercer párrafo). Los puntos que hay que tener en cuenta son:
- El elemento más electronegativo es el oxígeno y los elementos más electropositivos son el metal y el no metal.
- En la fórmula molecular el metal va a la izquierda, el no metal va al centro y el oxígeno va a la derecha.
- El oxígeno trabaja con el número de valencia -2.
- Los elementos que formaran el radical u oxoanión son el no metal y el oxígeno, razón que obliga a que la suma de valencias o cargas entre estos dos elementos sea negativa.
- La suma de cargas entre los tres elementos o entre el metal y el radical será igual a cero, lo que significa que la molécula será neutra.
Por ejemplo: Ca(ClO3)2. En resumen el procedimiento se basa en determinar la carga de uno de los dos radicales, que será negativo, y con esto se puede establecer el número con el que debe trabajar el metal, para que la suma entre este y los dos radicales sea igual a cero. Como primer paso hay que determinar la carga del radical; como hay 3 oxígenos en el radical y cada oxígeno trabaja con -2 la carga total de los oxígenos en un radical es de -6; como hay 1 cloro en el radical y la suma de valencias entre el oxígeno y el cloro dentro del radical debe ser negativo, el cloro trabajara con +5 de valencia. Para probar que el cloro debe trabajar con +5 únicamente, en este compuesto, se hace la operatoria con cada número de valencia del cloro; si el cloro trabajara con +1, la sumatoria con la carga -6 de los oxígenos seria igual a -5, esta carga de -5 seria de un solo radical y como hay dos, los radicales tendrían una carga de -10, así que el calcio para sumar una carga neta de cero para la molécula debería trabajar con un número de valencia +10, el cual no existe, entonces el cloro no puede trabajar con -1 en el radical; si el cloro trabajara con el +3 ocurriría lo mismo, al final el calcio para equilibrar la molécula debería trabajar con la valencia +6, valencia con la que no cuenta el cloro; y si el cloro trabajara con +6 la sumatoria de valencias entre el cloro y los oxígenos dentro del radical seria igual a cero, lo cual no es correcto ya que el radical debe tener una carga negativa. Ya que el cloro trabaja con +5 la carga sumada de los dos radicales es de -2, así que el calcio tendría que usar la valencia +2 para hacer cero la carga neta de la molécula. Cuando en una molécula hay solamente un radical se omiten los paréntesis de la fórmula
En el sistema tradicional se utiliza como nombre genérico el nombre del no metal con el sufijo y prefijo correspondiente a su número de valencia y como nombre específico el nombre del metal, elemento proporcionado por el hidróxido. Según el número de valencia del no metal en la sal (o del no metal en el oxácido que da origen a la sal) los sufijos son:
| hipo- … -oso | (para números de valencia 1 y 2) | hipo- … -ito |
| … -oso | (para números de valencia 3 y 4) | … -ito |
| … -ico | (para números de valencia 5 y 6) | … -ato |
| per- … -ico | (para el número de valencia 7) | per- … -ato |
En el ejemplo anterior, Ca(ClO3)2, como el cloro trabaja con la valencia +5, el compuesto se nombra Clorato de calcio.
En la nomenclatura sistemática se utiliza como nombre genérico, el nombre del no metal con el prefijo correspondiente al número de oxígenos presentes por radical en el compuesto (según la tabla de prefijos griegos), seguido de la partícula “oxo”, más el nombre del no metal con el sufijo ato seguido de la valencia del no metal en números romanos, y como nombre específico se utiliza el nombre del metal seguido de la valencia del metal en números romanos.
En el sistema Stock, se utiliza como nombre genérico el nombre de no metal seguido de la valencia del no metal en números romanos, y como nombre específico se utiliza el nombre del metal.
| Compuesto | Nom. Sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| Na3PO4 | tetraoxofosfato (V) de sodio | fosfato (V) de sodio4 | fosfato de sodio u ortofosfato de sodio |
| CaSO4 | tetraoxosulfato (VI) de calcio | sulfato (VI) de calcio4 | sulfato de calcio |
| NaClO4 | tetraoxoclorato (VII) de sodio | clorato (VII) de sodio4 | perclorato de sodio |
| Mg(BrO)2 | dioxobromato (II) de magnesio | bromato (I) de magnesio4 | hipobromito de magnesio |
| Sn(NO2)4 | dioxonitrato (III) de estaño (IV) | nitrito de estaño (IV)4 | nitrito estáñico |
Sales ácidas
Las sales ácidas son compuestos cuaternarios que resultan del reemplazo parcial de los hidrógenos de un ácido por átomos metálicos. Los ácidos deben presentar dos o más hidrógenos en su molécula para formar estas sales. Para nombrarlos en el sistema tradicional se siguen las reglas de las sales neutras ternarias agregando la palabra “ácido” antes del nombre del metal. Y para nombrarlos en el sistema Stock y sistemático se usan las reglas generales para las sales neutras ternarias, en estos dos sistemas, agregando la palabra “hidrógeno” antes del nombre del no metal. Para poder encontrar la valencia del no metal para así poder nombrar correctamente la sal se puede usar el método utilizado en los compuestos de sales neutras ternarias, teniendo en cuenta: que el oxígeno trabaja con valencia -2; el hidrógeno trabaja con valencia +1; estos compuestos siguen la fórmula general Metal + Hidrógeno + No Metal + Oxígeno; los elementos con valencias positivas son el metal, el hidrógeno y los elementos con valencias negativas son el no metal y el oxígeno.
| Compuesto | Nom. Stock y sistemática | Nom. tradicional |
|---|---|---|
| NaHSO4 | hidrógenosulfato (VI) de sodio4 | sulfato ácido de sodio4 |
| KHCO3 | hidrógenocarbonato de Potasio4 | carbonato ácido de Potasio4 |
Sales básicas
Estas sales son compuestos que resultan de reemplazar parcialmente los oxhidrilos de un hidróxido por los aniones de un ácido. Para nombrarlos en el sistema tradicional depende de si el ácido es binario o ternario, es decir que si se trata de un hidrácido o un oxácido. Cuando el ácido es un hidrácido se utiliza el nombre del no metal con su sufijo uro y se le antepone el prefijo “hidroxi” para el nombre general y como nombre específico el nombre del metal. Y cuando el ácido es un oxacido, como nombre general, se utiliza el nombre del no metal con el prefijo “hidroxi” y su correspondiente sufijo según su valencia (como se indica en la sección de las sales neutras ternarias), y como nombre específico el nombre del metal.
| Compuesto | Nomenclatura tradicional |
|---|---|
| MgCl(OH) | hidroxicloruro de magnesio |
| CaNO3(OH) | hidroxinitrato de calcio |
Sales mixtas
Las sales mixtas son compuestos que resultan al sustituir los hidrógenos de un ácido por átomos metálicos de distintos hidróxidos. Las reglas para nombrar las sales mixtas en el sistema tradicional son análogas a las sales ácidas.
| Compuesto | Nomenclatura tradicional |
|---|---|
| NaKSO4 | tetraoxosulfato de sodio y potasio |
| CaNaPO4 | ortofosfato de calcio y sodio |
Poliácidos
Se trata de aquellos oxiácidos que resultan de la unión de 2 ó 3 moléculas de oxiácidos con la pérdida de una molécula de agua por cada unión que se realice. Es como si fuesen dímeros o trímeros.
Se nombran indicando el número de moléculas de ácido que se han unido con un prefijo (Nomenclatura tradicional) o indicando con prefijos el número de átomos del no metal o metal en los pocos casos en que ocurre (demás nomenclaturas).
| Ejemplo | Nom. Stock | Nom. sistemática | Nom. tradicional |
|---|---|---|---|
| H2S2O7 | ácido heptaoxodisulfúrico (VI) | heptaoxodisulfato (VI) de hidrógeno | ácido disulfúrico |
| H2Cr2O7 | ácido heptaoxodicrómico (VI) | heptaoxodicromato (VI) de hidrógeno | ácido dicrómico |
| H5P3O10 | ácido decaoxotrifosfórico (V) | decaoxotrifosfato (V) de hidrógeno | ácido trifosfórico |
Las sales de los poliácidos se nombran de forma análoga a las oxisales.
| Ejemplo | Nomenclatura sistemática y funcional | Nomenclatura tradicional |
|---|---|---|
| CaCr2O7 | heptaoxodicromato (VI) de calcio | dicromato cálcico o de calcio |
| Mg2P2O7 | heptaoxodifosfato (V) de magnesio | difosfato magnesico |
| Na2S2O7 | heptaoxodisulfato (VI) de sodio | disulfato sódico |
Peroxoácidos
Son aquellos oxoácidos que han sustituido un oxígeno por un grupo peroxo O22-. Su fórmula no se simplifica.
En la nomenclatura tradicional (la más frecuente) se añade peroxo-, y en las restantes se indica con -peroxo- el oxígeno sustituido. Si a la hora de formular pudiera haber confusión con otro oxoácido, se indica el grupo peroxo entre paréntesis.
| Ejemplo | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|---|
| H2SO5 | ácido trioxoperoxosulfúrico (VI) | trioxoperoxosulfato (VI) de hidrógeno | ácido peroxosulfúrico |
| HOONO ó HNO (O2) | ácido monoxoperoxonítrico (V) | monoxoperoxonitrato (V) de hidrógeno | ácido peroxonítrico |
| H3BO4 | ácido dioxoperoxobórico (III) | dioxoperoxoborato (III) de hidrógeno | ácido peroxobórico |
Las peroxisales se nombran de forma análoga a las oxisales.
| Ejemplo | Nomenclatura sistemática y Stock | Nomenclatura tradicional |
|---|---|---|
| K2S2O8 | hexaoxoperoxodisulfato (VI) de potasio | peroxodisulfato de potasio |
| Ba[NO (O2)]2 | oxoperoxonitrato (III) de bario | peroxonitrito de bario o bárico |
| CaSO5 | trioxoperoxosulfato (VI) de calcio | peroxosulfato de calcio |
Tioácidos
Son aquellos oxoácidos que resultan de la sustitución de uno o varios oxígenos por azufres. Se nombran con el prefijo tio- seguido por el ácido de origen (nomenclatura tradicional) o -tio- en la sistemática y de Stock, indicando con un prefijo el número de oxígenos restantes. Si se escribe tio sin prefijo numérico en la nomenclatura tradicional, se está indicando que se han sustituido todos los O por S, excepto en el caso de los tioácidos del azufre (aquí tio=monotio).
| Fórmula General: |
|---|
| R.CO.SH o R.CS.OH |
| Ejemplo | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|---|
| H2S2O3 | ácido trioxotiosulfúrico (VI) | trioxotiosulfato (VI) de hidrógeno | ácido tiosulfúrico |
| HNSO2 | ácido dioxotionítrico (V) | dioxotionitrato (V) de hidrógeno | ácido tionítrico |
| H3PS2O2 | ácido dioxoditiofosfórico (V) | dioxoditiofosfato (V) de hidrógeno | ácido ditiofosfórico |
Las tiosales se nombran de forma análoga a las oxisales.
| Ejemplo | Nomenclatura sistemática y stock | Nomenclatura tradicional |
|---|---|---|
| FeS2O3 | trioxotiosulfato (VI) de hierro (II) | tiosulfato ferroso |
| Al2(HPS4)3 | hidrógenotetratiofosfato (V) de aluminio | hidrógenotiofosfato de aluminio |
| Na3PS3O | oxotritiofosfato (V) de sodio | tritiofosfato de sodio |
Iones
Los iones son aquellos átomos o moléculas cargados eléctricamente. Pueden ser de carga positiva (cationes) o de carga negativa (aniones).
Cationes mono y poliatómicos
Son iones con carga positiva. Si son monoatómicos, se nombran simplemente nombrando el elemento después de la palabra catión. Por ejemplo, Li+ catión litio. Si el elemento tiene varios estados de oxidación (valencias) se usan números romanos (Stock) o los afijos hipo- -oso, -oso, -ico, per- -ico (tradicional).
| Ejemplo | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|
| Fe3+ | catión hierro (III) | catión férrico |
| Cu+ | catión cobre (I) | catión cuproso |
Cuando se trata de cationes poliatómicos, se distinguen dos casos:
a) Si proceden de oxoácidos se añade el sufijo -ilo al nombre del oxoácido correspondiente en nomenclaturas tradicional (éste puede indicar la valencia en números romanos), también se puede nombrar en la Stock. Es como el oxoácido sin moléculas de agua.
| Ejemplo | Nomenclatura tradicional | Nomenclatura Stock |
|---|---|---|
| NO2+ | catión nitroilo | catión dioxonitrógeno (V) |
| NO+ | catión nitrosilo | catión monoxonitrógeno (III) |
| SO2+ | catión sulfinilo o tionilo | catión monoxoazufre (IV) |
| SO22+ | catión sulfonilo o sulfurilo | catión dioxoazufre (VI) |
| UO2+ | catión uranilo (V) | catión dioxouranio (V) |
| UO22+ | catión uranilo (VI) | catión dioxouranio (VI) |
| VO3+ | catión vanadilo (V) | catión monoxovanadio (V) |
| VO2+ | catión vanadilo (IV) | catión dioxovanadio (IV) |
b) Si proceden de hidruros, lleva el sufijo -onio.
| Ejemplo | Nombre |
|---|---|
| H3O+ | hidronio u oxonio |
| NH4+ | amonio |
| PH4+ | fosfonio |
| SbH4+ | estibonio |
| AsH4+ | arsonio |
| BiH4+ | bismutonio |
| H3S+ | sulfonio |
| H2Cl+ | cloronio |
Nomenclaturas de compuestos inorgánicos
Se aceptan tres tipos de nomenclaturas para nombrar compuestos químicos inorgánicos:
Nomenclatura sistemática o IUPAC, con prefijos / Atomicidad
También llamada racional o estequiométrica. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia.2 En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula.
La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico
(Véase en la sección otras reglas nombre genérico y específico).
Los prefijos son palabras que se anteponen al prefijo nombre del compuesto y representan el número de átomos que hay en la molécula del elemento. Existen diferentes prefijos los cuales provienen del griego y a continuación se presenta el número de átomos al que hace referencia el prefijo.2
(Generalmente solo se utiliza hasta el prefijo hepta-)
| Prefijos griegos | Número de átomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| non-, nona-, eneá- | 9 |
| deca- | 10 |
- El prefijo mono- normalmente se elude salvo que haya posibilidad de confusión.
- Por ejemplo, CrBr3: tribromuro de cromo; CO: monóxido de carbono
- En casos en los que en vez de átomos se trate de grupos de átomos como compuestos tales como sales dobles y triples, oxisales y similares, se pueden emplear los prefijos bis-, tris-, tetraquis, pentaquis, hexaquis, etc.
- Por ejemplo la fluorapatita Ca5F (PO4)3 : fluoruro tris(fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería:
- Ca5F (P3O10)3
Nomenclatura sistemática o IUPAC, con números romanos / Numeral de Stock
También llamada antiguamente nomenclatura de Stock. Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos el estado de oxidación del elemento con “nombre específico”. Si solamente tiene un estado de oxidación, éste no se escribe.
La valencia (o más bien el estado de oxidación) es la que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + "de" + nombre del elemento específico + el estado de oxidación.
Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.
- Ejemplo: Fe2S3, Fe2+3S3-2, sulfuro de hierro (III)
- Ejemplo: SO3, S2+6O6-2, óxido de azufre (VI)
Nomenclatura tradicional, clásica o antigua / Estequiométrica
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento con el sufijo –ico.
-
- K2O, óxido de potasio u óxido potásico
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
-
- …O-2, hierro con la valencia 2, (estado de oxidación +2), óxido ferroso
- … -ico cuando el elemento usa la valencia mayor: Fe2O3, Fe2+3O3-2, hierro con valencia 3, (estado de oxidación +3), óxido férrico3
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
-
- hipo- … -oso (para la menor valencia): P2O, P2+1O-2, fósforo con la valencia 1, (estado de oxidación +1), óxido hipofosforoso
- … -oso (para la valencia intermedia): P2O3, P2+3O3-2, fósforo con valencia 3, (estado de oxidación +3), óxido fosforoso
- … -ico (para la mayor valencia): P2O5, P2+5O5-2, fósforo con valencia 5, (estado de oxidación +5), óxido fosfórico
- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos
-
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia pequeña)
- … -ico (para la valencia grande)
- per- … -ico (para la valencia más grande)
Hoy esta nomenclatura está en desuso. Sin embargo aún se usa mucho en el comercio y la industria.
Otras reglas y conceptos generales
Los compuestos (binarios y ternarios) en su nomenclatura están compuestos por dos nombres: el genérico y el específico. El nombre genérico o general es el que indica a qué grupo de compuestos pertenece la molécula o su función química, por ejemplo si es un óxido metálico/básico, un óxido no metálico/ácido, un peróxido, un hidruro, un hidrácido, un oxácido, una sal haloidea, etc. Y el nombre específico es el que diferencia a las moléculas dentro de un mismo grupo de compuestos. Por lo general en los tres sistemas de nomenclatura se escribe primero el nombre genérico seguido del específico. Por ejemplo: óxido ferroso y óxido férrico, estos dos compuestos pertenecen al grupo de los óxidos y por eso su nombre genérico es óxido y a la vez los nombres específicos ferroso y férrico hacen referencia a dos compuestos diferentes FeO y Fe2 O3, respectivamente.
En general, en una fórmula molecular de un compuesto se coloca a la izquierda el elemento con estado de oxidación positivo (elemento más electropositivo) y a la derecha el que tenga el estado de oxidación negativo (elemento más electronegativo). Y por el contrario, en nomenclatura se coloca primero el nombre genérico, que es el que designa al elemento de la derecha (el más electronegativo), y el nombre específico en segundo lugar, que es el que designa al elemento de la izquierda (el más electropositivo).
Por ejemplo en el óxido de sodio, Na2O, Na+12O-2, el nombre genérico óxido hace referencia al segundo elemento de la fórmula que es el “oxígeno”, el más electronegativo, y el nombre específico “sodio” hace referencia al primer elemento de la fórmula que es el sodio y el menos electronegativo o más electropositivo.
¿Cómo se trabajan los estados de oxidación para poder nombrar correctamente un compuesto inorgánico? Se puede trabajar con más de un estado de oxidación, hasta el estado de oxidación +7 en los elementos representativos (Nota: recordar que aquí estamos mostrando el estado de oxidación como superíndice de cada elemento en la fórmula del compuesto). Con las mismas fórmulas moleculares se puede determinar con qué estado de oxidación actúan los átomos de la sustancia aunque en su fórmula no se observen. Esto se logra con el hecho que en la fórmula de una sustancia la suma de los estados de oxidación de todos los átomos de la sustancia debe ser igual a cero, lo que significa que la molécula será neutra, sin carga.
En el caso de los iones, es decir cuando en la fórmula se indique una carga positiva o negativa para el conjunto, la suma de los estados de oxidación de todos los átomos de la sustancia debe ser igual a la carga del ion.
Véase como ejemplo la imagen del "ácido nítrico" al final de la sección oxácidos, del lado derecho de la imagen se encuentran el ion nitrato y el ion hidrógeno con cargas -1 y +1, respectivamente).
Como ejemplo para trabajar con valencias: FeO, este compuesto es un óxido y el oxígeno en los óxidos actúa con un estado de oxidación -2, así que para que la molécula sea neutra el hierro debe sumar el número de estados de oxidación suficientes para que la suma de los estados de oxidación sea cero. Los estado de oxidación con los que puede trabajar el hierro son +2 y +3, así que, en esta molécula el hierro va a utilizar el estado de oxidación +2. Como solo hay un átomo de hierro y la valencia es +2, el átomo de hierro en esa molécula tiene estado de oxidación +2 y de igual manera como solo hay un átomo de oxígeno y trabaja con el estado de oxidación -2, la suma de todos los estados de oxidación del oxígeno es -2. Y ahora la suma de todos los estados de oxidación de los átomos es igual a cero, pues la molécula es neutra, no tiene carga (+2) + (-2) = 0. La fórmula con estados de oxidación para este compuesto sería Fe2O-2.
En otro ejemplo, en el compuesto Fe2O3 se busca también un cero en la suma de los estado de oxidación de todos los átomos, para que la molécula sea neutra, así que como hay 3 átomos de oxígeno y este trabaja con el estado de oxidación -2, la suma de los estados de oxidación para los oxígenos en la molécula “son el número de átomos del elemento multiplicado por el estado de oxidación con el que este trabaja”, que en total sería -6. De esta manera los átomos de hierro deben de sumar estados de oxidación para que la suma total dé cero, pues la molécula es neutra. Como hay 2 átomos de hierro, este va a trabajar con el estado de oxidación +3 para hacer un total de +6, que sumados con los -6 de los oxígenos sería igual a cero, que significa una carga cero para la molécula. Los números de átomos y estado de oxidación en la molécula son:
- Número de átomos de hierro = (2)
- Estados de oxidación para cada uno de los átomos de hierro = (+3)
- Número de átomos de oxígeno = (3)
- Estados de oxidación para cada uno de los átomos de oxígeno = (-2)
La operatoria completa se vería así: [2(+3)] + [3(-2)] = 0. La fórmula con estados de oxidación sería Fe23O3-2. Como ya se había explicado anteriormente el estado de oxidación indica los electrones que intervienen en un enlace, y en este último compuesto, Fe23O3-2, cada uno de los dos átomos de hierro está cediendo 3 electrones a los átomos de oxígeno y a la vez cada uno de los tres átomos de oxígeno está ganando 2 electrones; dos de los tres átomos de oxígeno reciben 2 electrones de los dos átomos de hierro, y el tercer de oxígeno recibe 2 electrones, 1 electrón sobrante de cada uno de los dos átomos de hierro.
Tabla de números de valencia
- En la siguiente tabla se presentan los elementos que generalmente se usan para formar compuestos. Los estados de oxidación están en valor absoluto, es decir, son valencias.
| Elemento | Símbolo | Estado de oxidación | Elemento | Símbolo | Estado de oxidación | |
|---|---|---|---|---|---|---|
| Aluminio | Al | 3 | Antimonio | Sb | 3 y 5 | |
| Arsénico | As | 3 y 5 | Ástato | At | 1, 3, 5 y 7 | |
| Azufre | S | 2, 4 y 6 | Bario | Ba | 2 | |
| Berilio | Be | 2 | Bismuto | Bi | 3 y 5 | |
| Boro | B | 3 | Bromo | Br | 1 y 5 | |
| Cadmio | Cd | 2 | Calcio | Ca | 2 | |
| Carbono | C | 2 y 4 | Cesio | Cs | 1 | |
| Cinc | Zn | 2 | Circonio | Zr | 4 | |
| Cloro | Cl | 1, 3, 5 y 7 | Cobalto | Co | 2 y 3 | |
| Cobre | Cu | 2 y 1 | Cromo | Cr | 2, 3, 4, 5 y 6 | |
| Escandio | Sc | 3 | Estaño | Sn | 2 y 4 | |
| Estroncio | Sr | 2 | Flúor | F | 1 | |
| Fósforo | P | 1,3 y 5 | Galio | Ga | 3 | |
| Germanio | Ge | 2,4 y -4 | Hafnio | Hf | 4 | |
| Hidrógeno | H | 1 y -1 | Hierro | Fe | 2 y 3 | |
| Iridio | Ir | 2, 3, 4 y 6 | Itrio | Y | 3 | |
| Lantano | La | 3 | Litio | Li | 1 | |
| Magnesio | Mg | 2 | Manganeso | Mn | 2, 3, 4, 6, 7 | |
| Mercurio | Hg | 1 y 2 | Molibdeno | Mo | 2, 3, 4, 5 y 6 | |
| Niobio | Nb | 3 | Níquel | Ni | 2 y 3 | |
| Nitrógeno | N | 2, 3, 4 y 5 | Oro | Au | 1 y 3 | |
| Osmio | Os | 2, 3, 4 y 6 | Oxígeno | O | -2 | |
| Plata | Ag | 1 | Platino | Pt | 2 y 4 | |
| Plomo | Pb | 2 y 4 | Potasio | K | 1 | |
| Renio | Re | 1, 2, 4, 6 y 7 | Rodio | Rh | 2, 3 y 4 | |
| Rubidio | Rb | 1 | Rutenio | Ru | 2, 3, 4, 6 y 8 | |
| Selenio | Se | 2, 4 y 6 | Silicio | Si | 4 | |
| Sodio | Na | 1 | Talio | Tl | 1 y 3 | |
| Tántalo | Ta | 5 | Tecnecio | Tc | 7 | |
| Telurio | Te | 2, 4 y 6 | Titanio | Ti | 3 y 4 | |
| Vanadio | V | 2, 3, 4 y 5 | Yodo | I | +/-1,3, 5 y 7 |
Véase también: Estructura de Lewis
Óxidos (compuestos binarios con oxígeno)
Los óxidos son compuestos químicos inorgánicos binarios formados por la unión del oxígeno con otro elemento diferente. Según si este elemento es metal o no metal serán óxidos básicos u óxidos ácidos. El oxígeno en los óxidos siempre tiene estado de oxidación -2, salvo excepciones que se ven más adelante.
Los óxidos se pueden nombrar en cualquiera de los tres sistemas de nomenclatura; si se utiliza la nomenclatura sistemática estequiométrica con números romanos (antigua de Stock), el número romano es igual a la valencia del elemento diferente del oxígeno; si se utiliza el sistema tradicional los sufijos y prefijos se asignan de acuerdo a las valencias de cada elemento y si se utiliza la nomenclatura sistemática con prefijos no se tienen en cuenta las valencias, sino que se escriben los prefijos en cada elemento de acuerdo a sus atomicidades en la fórmula molecular. Hay excepciones que se ven más adelante.
Tipos de óxidos
Según la estequiometria del compuesto:
- Óxidos binarios, formados por oxígeno y otro elemento.
- Óxidos mixtos, formados por dos elementos distintos y oxígeno como son las espinelas.
Atendiendo al comportamiento químico hay tres tipos de óxidos: óxidos básicos, ácidos y óxidos anfóteros, aunque no muy comunes en la naturaleza.
Óxidos básicos (metálicos)
Son aquellos óxidos que se producen entre el oxígeno y un metal cuando el oxígeno actúa con un estado de oxidación -2. Su fórmula general es: metal más oxígeno. En la nomenclatura estequiométrica con números romanos (antigua de Stock) los compuestos se nombran con las reglas generales anteponiendo como nombre genérico la palabra óxido seguido por el nombre del metal y su estado de oxidación en números romanos y sin signo. En la nomenclatura tradicional se nombran con los sufijos -oso e -ico dependiendo de la menor o mayor valencia del metal que acompaña al oxígeno. Y en la nomenclatura sistemática con prefijos se utilizan las reglas generales con la palabra óxido como nombre genérico y los prefijos correspondientes a cada elemento según el número de átomos de este en la fórmula.. En la nomenclatura antigua o tradicional, ya en desuso, se les llaman también anhídridos o anhidridos básicos; ya que al agregar agua, pueden formar hidróxidos básicos. En la nomenclatura tradicional para los óxidos que se enlazan con metales que tienen más de dos estados de oxidación se utilizan las siguientes reglas: metales con estados de oxidación hasta el +3 se nombran con las reglas de los óxidos y los metales con estados de oxidación mayores o iguales a 4 se nombran con las reglas de los anhídridos. Ejemplos: V2+3O3-2 se nombra como óxido vanadoso; V2+5 O5-2 se nombra como óxido vanádico.
| Compuesto | Nomenclatura sistemática con prefijos | Nomenclatura sistemática con números romanos | Nomenclatura tradicional |
|---|---|---|---|
| K2O | óxido de dipotasio4 o monóxido de dipotasio | óxido de potasio4 | óxido potásico u óxido de potasio |
| Fe2O3 | trióxido de dihierro | óxido de hierro(III) | óxido férrico |
| FeO | monóxido de hierro | óxido de hierro(II) | óxido ferroso |
| SnO2 | dióxido de estaño | óxido de estaño(IV) | óxido estánico |
Cuando el nitrógeno, que es un no metal, actúa con los estados de oxidación +4 y +2, al enlazarse con el oxígeno, forma óxidos básicos similares a los de los metales (ver la sección de anhídridos, penúltimo párrafo).
Para nombrar a los óxidos básicos, se deben observar los estados de oxidación, o valencias, de cada elemento. Hay tres tipos de nomenclatura: tradicional, sistemática con prefijos y sistemática con números romanos (antigua de Stock).
1. Cuando un elemento tiene un solo número de oxidación, por ejemplo el galio), estado de oxidación +3, el óxido Ga2O3 se nombra así:
- Tradicional: óxido de galio.
- Sistemática con prefijos: Se nombra según la cantidad de átomos que tenga cada elemento en la molécula. En este caso, es trióxido de digalio (ya que la molécula del óxido queda Ga2O3).
- Sistemática con números romanos: Es igual a la nomenclatura tradicional, pero añadiendo el estado de oxidación en números romanos entre paréntesis. Recordemos que si el elemento sólo tiene un estado de oxidación, éste no se escribe: óxido de galio.
2. Cuando un elemento tiene dos números de oxidación, por ejemplo el Plomo), +2 y +4, los óxidos PbO y PbO2 se nombran así:
- Tradicional: PbO óxido plumboso (cuando el estado de oxidación utilizado es el menor), y PbO2 óxido plúmbico (cuando es el mayor).
- Ejemplos:
- Óxido cuproso: Cu2 O
- Óxido cúprico: CuO
- Óxido ferroso: FeO
- Óxido férrico: Fe2O3
- Sistemática con prefijos:
Este tipo de nomenclatura necesita de los siguientes prefijos:
| Prefijo | Número de átomos |
|---|---|
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| nona- | 9 |
| deca- | 10 |
Cuando el prefijo termina con las letras a u o, se eliminan antes de la palabra: Ej.: mono: Mon-oxido. Quedaría de tal manera: Monóxido. Estaría mal escrito; Monoóxido Hepta: Hept-óxido. Quedaría de tal manera heptóxido. Estaría mal escrito heptaóxido. Ej.: la escritura va de derecha a izquierda
- P2O3
- trióxido de difósforo
- Numeral de Stock: en esta nomenclatura solo se necesita saber el número de valencia del metal, para escribirlo al final de la fórmula en números romanos entre paréntesis.
Ej.: P2O3 óxido de fósforo(III)
3. Cuando un elemento tiene más de dos números de oxidación (puede llegar a tener hasta cuatro) se los denomina de la siguiente manera.
- Tradicional:
- cuando el elemento tiene una sola valencia se añade la terminación -ico, o simplemente se escribe la palabra óxido seguido de la preposición "de" y enseguida el nombre del elemento.
- cuando el elemento tiene dos valencias se añade la terminación -oso a la más pequeña y la terminación -ico a la más grande
- cuando el elemento tiene tres valencias se añade a la más pequeña hipo-oso con el elemento entre medias, a la intermedia se le añade la terminación -oso y a la más grande la terminación -ico
- cuando el elemento tiene cuatro valencias se añade a la más pequeña hipo-oso, a la siguiente -oso, a la siguiente -ico y por último a la más grande per-ico
- Atomicidad: es igual que en los casos anteriores. Por ejemplo, si la molécula es de uranio y queda formada como U2O3, su nomenclatura es "Trióxido de diuranio".
- Numeral de Stock: Exactamente igual que en los casos anteriores, se escribe el óxido normalmente y se le agrega el número de oxidación entre paréntesis.
Óxidos ácidos o anhídridos (no metálicos)
Son aquellos formados por la combinación del oxígeno con un no metal. Su fórmula general es no metal + O. En este caso, la nomenclatura tradicional emplea la palabra anhídrido en lugar de óxido, a excepción de algunos óxidos de nitrógeno y fósforo. La nomenclatura sistemática y la Stock nombran a los compuestos con las mismas reglas que en los óxidos metálicos. En la nomenclatura tradicional se nombran con los siguientes sufijos y prefijos.
| # de Valencia | Prefijo | Raíz - Elemento | Sufijo | |
|---|---|---|---|---|
| 1 | única | ..... | elemento | ico |
| 2 | mayor | ..... | elemento | ico |
| 2 | menor | ..... | elemento | oso |
| 3 | mayor | ..... | elemento | ico |
| 3 | intermedia | ..... | elemento | oso |
| 3 | menor | hipo | elemento | oso |
| 4 | máxima | per | elemento | ico |
| 4 | mayor | ..... | elemento | ico |
| 4 | menor | ..... | elemento | oso |
| 4 | mínima | hipo | elemento | oso |
| Compuesto | Nomenc. sistem. | Nomenc. Stock | Nomenc. tradicional |
|---|---|---|---|
| Cl2O | óxido de dicloro o monóxido de dicloro | óxido de cloro (I) | anhídrido hipocloroso |
| SO3 | trióxido de azufre | óxido de azufre (VI) | anhídrido sulfúrico |
| Cl2O7 | heptóxido de dicloro | óxido de cloro (VII) | anhídrido perclórico |
Cuando el flúor reacciona con el oxígeno se crea un compuesto diferente a un óxido ácido ya que el oxígeno deja de ser el elemento más electronegativo, distinto a como pasa con todos los óxidos donde el oxígeno es el elemento más electronegativo. El único elemento más electronegativo que el oxígeno es el flúor con 4.0 mientras el oxígeno tiene 3.5. Así que el compuesto deja de llamarse óxido y se nombra como fluoruro de oxígeno para el sistema tradicional, fluoruro de oxígeno (II) para el sistema Stock y difluoruro de oxígeno para el sistemático. La fórmula es O2F2-1.
Los óxidos de nitrógeno, al igual que los óxidos del azufre, son importantes por su participación en la lluvia ácida. Con el término óxido de nitrógeno se hace alusión a cualquiera de los siguientes:
- Óxido nítrico u Óxido de nitrógeno (II), de fórmula NO.
- Dióxido de nitrógeno, de fórmula NO2.
- Óxido nitroso o Monóxido de dinitrógeno, de fórmula N2O.
- Trióxido de dinitrógeno, de fórmula N2O3.
- Tetróxido de dinitrógeno, de fórmula N2O4.
- Pentóxido de dinitrógeno, de fórmula N2O5.
Entre las excepciones a las reglas de anhídridos para la nomenclatura tradicional están los óxidos de nitrógeno y óxidos de fósforo. Estos compuestos se nombran así:
- N21O-2 Anhídrido hiponitroso
- N2O-2 Óxido hiponitroso
- N23O3-2 Anhídrido nitroso
- N24O4-2 Óxido nitroso
- N4O2-2 Óxido nitroso
- N25O5-2 Anhídrido nítrico
- P23O3-2 Anhídrido fosforoso
- P4O2-2 Óxido fosforoso
- P25O5-2 Anhídrido fosfórico
Cuando los metales, con más de dos números de valencia y que trabajan con los números de valencia iguales o mayores a 4, se enlazan con el oxígeno, forman anhídridos (ver la sección de óxidos básicos, segundo párrafo).
Óxidos dobles
Resultan de escribir en una sola forma las fórmulas de los óxidos terminados en OSO e ICO. Se les nombra con la palabra ÓXIDO seguida de los “nombres iónicos” de los metales.
- FeO+Fe2O3=Fe3O4 óxido ferroso férrico
- 2SnO+SnO=Sn3O4 óxido estañoso estánico
- 2PbO+Pb2O3=Pb3O4 óxido plumboso plúmbico
- MnO+Mn2O3=Mn3O4 óxido manganoso mangánico
Peróxidos
Los peróxidos se obtienen por reacción de un óxido con oxígeno monoatómico y se caracterizan por llevar el grupo peróxido o unión peroxídica (-o-o-). Son compuestos diatómicos en donde participan el grupo peróxido y un metal. La fórmula general de los peróxidos es metal + (O-1) 2-2. En el sistema tradicional se utiliza el nombre peróxido en lugar de óxido y se agrega el nombre del metal con las reglas generales para los óxidos en esta nomenclatura. En las nomenclaturas Stock y sistemática se nombran los compuestos con las mismas reglas generales para los óxidos.
No todos los metales forman peróxidos y habitualmente lo hacen los del grupo 1A y 2A de la tabla periódica (alcalinos y alcalinotérreos).
| Compuesto | Nomenc. sistemática | Nomenc. Stock | Nomenc. tradicional |
|---|---|---|---|
| H2O2 | peróxido de dihidrógeno | peróxido de hidrógeno | peróxido hidrogénico |
| CaO2 | peróxido de calcio | peróxido de calcio | peróxido cálcico |
| ZnO2 | peróxido de zinc | peróxido de zinc (II) | peróxido zínquico |
Superóxidos
Los superóxidos, también llamados hiperóxidos, son compuestos binarios que contienen el grupo o anión superóxido, la fórmula general es metal + (O 2)-1 Aparentemente, el oxígeno tiene valencia -1/2. Generalmente el grupo superóxido reacciona con los elementos alcalinos y alcalinotérreos.
Se nombran como los peróxidos tan solo cambiando peróxido por superóxido o hiperóxido.
| Compuesto | Nomenclatura |
|---|---|
| KO2 | superóxido o hiperóxido de potasio |
| CaO4 ó Ca (O2)2 | superóxido de calcio |
| CdO4 | superóxido de cadmio |
Ozónidos
Son compuestos binarios formados por el grupo ozónido, que son 3 oxígenos enlazados con una valencia total de -1. La fórmula general para los ozónidos es metal + (O3)-1. Los ozónidos se nombran de forma análoga a los peróxidos con la diferencia que en estos compuestos se utiliza el nombre ozónido en lugar de peróxido.
| Compuesto | Nomenclatura |
|---|---|
| KO3 | ozónido de potasio |
| RbO3 | ozónido de rubidio |
| CsO3 | ozónido de cesio |
Hidruros (compuestos binarios con hidrógeno)
Los hidruros son compuestos binarios formados por hidrógeno y otro elemento.
Hidruros metálicos
Son compuestos binarios o diatómicos formados por hidrógeno y un metal. En estos compuestos, el hidrógeno siempre tiene valencia -1. Se nombran con la palabra hidruro. Su fórmula general es Metal + H. Para nombrar estos compuestos en el sistema tradicional se utiliza la palabra hidruro y se agrega el nombre del metal con los sufijos -oso o -ico con las reglas generales para esta nomenclatura. Para las nomenclaturas Stock y sistemática se utilizan las reglas generales con la palabra hidruro como nombre genérico.
| Compuesto | Nomenc. sistemática | Nomenc. Stock | Nomenc. tradicional |
|---|---|---|---|
| KH | monohidruro de potasio | hidruro de potasio4 | hidruro potásico o hidruro de potasio |
| NiH3 | trihidruro de níquel | hidruro de níquel (III) | hidruro niquélico |
| PbH4 | tetrahidruro de plomo | hidruro de plomo (IV) | hidruro plúmbico |
Hidrácidos o hidruros no metálicos
Los hidrácidos (compuestos binarios ácidos) o hidruros no metálicos son compuestos formados entre el hidrógeno y un no metal de las familias VIA y VIIA ( anfígenos y halógenos respectivamente). Los elementos de estas dos familias que pueden formar hidrácidos e hidruros no metálicos son: S, Se, Te, F, Cl, I y Br, que por lo general trabajan con el menor número de oxidación, -2 para los anfígenos y -1 para los halógenos. Estos compuestos se nombran en el sistema tradicional y de forma diferente según si están disueltos (estado acuoso) o en estado puro (estado gaseoso). Los hidrácidos pertenecen al grupo de los ácidos, Ver la sección oxácidos.
Los hidruros no metálicos son los que se encuentran en estado gaseoso o estado puro y se nombran agregando al no metal el sufijo -uro y la palabra hidrógeno precedido de la sílaba “de”. En este caso el nombre genérico es para el elemento más electropositivo que sería el del hidrógeno y el nombre especifico es para el elemento más electronegativo que sería el del no metal, por ejemplo H+1 Br-1 (g) bromuro de hidrógeno, bromuro como nombre específico e hidrógeno como nombre genérico.
Los hidrácidos provienen de disolver en agua a los hidruros no metálicos y por esa misma razón son estos los que se encuentran en estado acuoso. Se nombran con la palabra ácido, como nombre genérico, y como nombre específico se escribe el nombre del no metal y se le agrega el sufijo –hídrico. Al igual que en estado gaseoso el nombre genérico es nombrado por el elemento más electropositivo.
| Compuesto | en estado puro | en disolución |
|---|---|---|
| HCl | cloruro de hidrógeno | ácido clorhídrico |
| HF | fluoruro de hidrógeno | ácido fluorhídrico |
| HBr | bromuro de hidrógeno | ácido bromhídrico |
| HI | yoduro de hidrógeno | ácido yodhídrico |
| H2S | sulfuro de hidrógeno | ácido sulfhídrico |
| H2Se | seleniuro de hidrógeno | ácido selenhídrico |
| H2Te | teluluro de hidrógeno | ácido telurhídrico |
Hidruros con los nitrogenoides
Estos hidrácidos o hidruros no metálicos son compuestos binarios de hidrógeno y un elemento de la familia (V) (nitrogenoides) que se enlazan siguiendo la fórmula No Metal + H3. A estos compuestos se les llama por sus nombres comunes, aunque muy raramente se les nombra con las reglas de nomenclatura de los hidruros (metálicos). En estos hidruros no metálicos el hidrógeno es el elemento más electronegativo en el compuesto.
| Compuesto | Nombre |
|---|---|
| NH3 | amoniaco o trihidruro de nitrógeno |
| PH3 | fosfano o trihidruro de fósforo |
| AsH3 | arsano o trihidruro de arsénico |
| SbH3 | estibano o trihidruro de antimonio |
| BiH3 | bismutano o trihidruro de bismuto |
| BH3 | borano o trihidruro de boro |
| B2H6 | diborano o hexahidruro de boro |
| CH4 | metano o tetrahidruro de carbono |
| SiH4 | silano o tetrahidruro de silicio |
| GeH4 | germano o tetrahidruro de germanio |
Boranos
Los boranos son compuestos binarios entre el hidrógeno y el boro que generalmente se enlazan siguiendo la fórmula BnHn+4. Estos compuestos no se nombran en un sistema de nomenclatura específico ya que las reglas para nombrarlos son especiales. Se utiliza la palabra borano con un prefijo numérico griego (tabla de prefijos) que depende del número de átomos de borano presentes en la molécula.
| Compuesto | Nombre |
|---|---|
| BH3 | monborano o borano |
| B2H6 | diborano |
| B3H7 | triborano |
| B4H8 | tetraborano |
| B10H14 | decaborano |
Silanos
Los silanos son compuestos binarios de hidrógeno y silicio que se enlazan generalmente siguiendo la fórmula SinH2n+2. Los silanos al igual que los boranos no tienen un sistema de nomenclatura específico para ser nombrados y utilizan las mismas reglas de nomenclatura, con la palabra silano como base.
| Compuesto | Nombre |
|---|---|
| SiH4 | monosilano, silano o tetrahidruro de silano |
| Si2H6 | disilano |
| Si3H8 | trisilano |
| Si4H10 | tetrasilano |
| Si10H22 | decasilano |
Germanos
Los germanos son compuestos binarios de hidrógeno y germanio que se enlazan generalmente siguiendo la misma fórmula que los silanos GenH2n+2. Los germanos al igual que los boranos y silanos no tienen un sistema de nomenclatura específico para ser nombrados y utilizan las mismas reglas de nomenclatura que los silanos, con la palabra germano como base.
| Compuesto | Nombre |
|---|---|
| GeH4 | monogermano, germano o tetrahidruro de germano |
| Ge2H6 | digermano |
| Ge3H8 | trigermano |
| Ge4H10 | tetragermano |
| Ge10H22 | decagermano |
Oxácidos (compuestos ternarios ácidos)
Los oxácidos, también llamados oxoácidos y oxiácidos, son compuestos ternarios ácidos originados de la combinación del agua con un anhídrido u óxido ácido. La fórmula general para los oxácidos es H + NoMetal + O. En el sistema tradicional se les nombra con las reglas generales para los anhídridos sustituyendo la palabra anhídrido por ácido (ya que de los anhídridos se originan). Para el sistema Stock se nombra al no metal con el sufijo –ato, luego el número de valencia del no metal y por último se agrega “de hidrógeno”. Y para la nomenclatura sistemática se indica el número de átomos de oxígeno con el prefijo correspondiente (según reglas generales para este sistema) seguido de la partícula “oxo” unida al nombre del no metal y el sufijo –ato, por último se agrega al nombre las palabras “de hidrógeno”.
| Compuesto | Nomenclatura sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| H2SO4 | tetraoxosulfato de Hidrógeno | sulfato (VI) de hidrógeno4 | ácido sulfúrico |
| HClO4 | ácido tetraoxoclórico | clorato (VII) de hidrógeno4 | ácido perclórico |
| H2SO2 | ácido dioxosulfúrico | sulfato (II) de hidrógeno4 | ácido hiposulfuroso |
Como se indica en la sección de los anhídridos, el nitrógeno y el fósforo no forman anhídridos cuando se enlazan con el oxígeno, mientras estos trabajan con los números de valencia 4 y 2, si no que forman óxidos y por esta razón el nitrógeno y el fósforo no pueden formar oxácidos con estos números de valencia.
Ya que para nombrar a los compuestos se necesita saber con qué números de valencia trabajan los elementos, una manera muy fácil para determinar los números, según la fórmula molecular, es sumando los números de valencia del oxígeno y el hidrógeno planteando una ecuación para la valencia del no metal, ya que la suma de cargas o valencias debe ser cero para que la molécula sea neutra (ver la sección reglas generales). Como se describe anteriormente la fórmula general para estos compuestos es H + NoMetal + O, donde el oxígeno es el elemento más electronegativo y el hidrógeno y el no metal son los elementos más electropositivos. El hidrógeno trabaja con la valencia +1 y el oxígeno con la valencia -2, siempre en estos compuestos. Por ejemplo: H2SO4, como hay 4 átomos de oxígeno y este trabaja con -2, en total para los oxígenos la carga seria de -8. De la misma manera, como hay 2 hidrógenos y este trabaja con valencia +1 la carga para este elemento es de +2. Como la suma de las cargas debe ser igual a cero, entonces el azufre trabajara con la valencia +6. Los elementos con valencias y la operatoria serían: H2+1 + S+6 + O4-2 => (+1)2 + (+6) + (-2)4 = 0. Como el azufre trabaja con +6 su terminación o sufijo sería –ico y el compuesto se nombraría “ácido sulfúrico”.
Por otra parte, ciertos anhídridos pueden formar hasta tres oxácidos distintos dependiendo de cuantas moléculas de agua se agreguen por molécula de anhídrido. En otras palabras, en ciertos oxácidos especiales, un solo “no metal” con una sola valencia puede formar hasta tres oxácidos. Estos elementos son el yodo, fósforo, silicio, boro y teluro. Para diferenciar a estos oxácidos en el sistema tradicional se utilizan tres prefijos dependiendo de cuantas moléculas de agua se agregan por cada una molécula de anhídrido. Estos son:
- meta-… (1 molécula de agua)
- piro-… (2 moléculas de agua)
- orto-… (3 moléculas de agua) este prefijo se puede omitir
El silicio y el yodo también pueden formar oxácidos con más de una molécula de agua, en dos casos especiales.
| Compuesto | Nom. sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| P2O5 + H2O → 2HPO3 | ácido trioxofosfórico | trioxofosfato (V) de hidrógeno | ácido metafosfórico |
| P2O5 + 2H2O → H4P2O7 | ácido heptaoxodifosfórico | heptaoxodifosfato (V) de hidrógeno | ácido pirofosfórico |
| P2O5 + 3H2O → 2H3PO4 | ácido tetraoxofosfórico | tetraoxofosfato (V) de hidrógeno | ácido ortofosfórico o ácido fosfórico |
| I2O7 + 5H2O → 2H5IO6 | ácido hexaoxoyódico | hexaoxoyodato (VII) de hidrógeno | ácido ortoperyódico |
| SiO2 + 2H2O → H4SiO4 | ácido tetraoxosilícico | tetraoxosilicato (IV) de hidrógeno | ácido ortosilícico (excepción solo 2 moléculas de agua) |
Como se describe previamente los oxácidos están formados por un anhídrido (no metal + oxígeno) y el hidrógeno, pero como se indica en la secciones de anhídridos y óxidos básicos algunos metales, también pueden formar anhídridos, y por esta razón, también pueden formar oxácidos.
| Compuesto | Nomenclatura sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| H2CrO4 | ácido tetraoxocrómico | cromato (VI) de hidrógeno4 | ácido crómico |
| H2MnO3 | ácido trioxomangánico | manganato (IV) de hidrógeno4 | ácido manganoso |
| H2MnO4 | ácido tetraoxomangánico | manganato (VI) de hidrógeno4 | ácido mangánico |
| HMnO4 | ácido tetraoxomangánico | manganato (VII) de hidrógeno4 | ácido permangánico |
| HVO3 | ácido trioxovanádico | vanadato (V) de hidrógeno4 | ácido vanádico |
Los oxiácidos son compuestos que presentan uniones covalentes, pero cuando se disuelven en agua ceden fácilmente iones H+1 (protones). Esto se debe a que el agua, por la naturaleza polar de sus moléculas, tiene tendencia a romper las uniones covalentes polares de los ácidos, con formación de iones H+1 y del anión ácido correspondiente. Por ejemplo, el ácido nítrico que se disuelve en agua da lugar a un anión nitrato y un catión hidrógeno.
La ionización de un oxácido al disolverse en agua es un ejemplo de proceso que se cumple en ambos sentidos, es decir que, al mismo tiempo que se forman iones a partir del ácido, este se regenera constantemente por la unión de aniones y cationes. Los procesos de esta naturaleza se denominan reversibles.
Clasificación
Polibidratados
Su fórmula general es: Un óxido no metálico mas "n" moleculas de agua (H2O)
Ácidos
Los ácidos son compuestos que se originan por combinación del agua con un anhídrido u óxido ácido, o bien por disolución de ciertos hidruros no metálicos en agua. En el primer caso se denominan oxácidos y en el segundo, hidrácidos. Ácido, también es toda sustancia que en solución acuosa se ioniza, liberando cationes de hidrógeno.
Hidróxidos o bases (compuestos ternarios básicos)
Los hidróxidos son compuestos ternarios básicos formados por la unión de un óxido básico con agua. Se caracterizan por tener en solución acuosa el radical o grupo oxhidrilo o hidroxilo OH-1. Para nombrarlos se escribe con la palabra genérica hidróxido, seguida del nombre del metal electropositivo terminado en -oso o -ico según las reglas generales para el sistema tradicional. La fórmula general es Metal + (OH)-1x. En la nomenclatura Stock y sistemática se nombran genéricamente como hidróxido y las respectivas reglas generales.
| Compuesto | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|---|
| Li (OH) | hidróxido de litio | hidróxido de litio (I) | hidróxido de litio |
| Pb (OH)2 | dihidróxido de plomo | hidróxido de plomo (II) | hidróxido plumboso |
| Al (OH)3 | trihidróxido de aluminio | hidróxido de aluminio (III) | hidróxido de aluminio |
Los hidróxidos cuando se disuelven en agua se ionizan formando cationes metal e iones hidroxilo u oxhidrilo. Este proceso de ionización es reversible, es decir que así como se forma los cationes metal e iones hidroxilo a partir de un hidróxido, inversamente, también se pueden formar hidróxidos a partir de los cationes e iones ya mencionados.
Un caso especial lo constituye el hidróxido de amonio. El amoniaco es un gas muy soluble en agua, su fórmula es NH3. Al disolverse reacciona con el agua formando el compuesto hidróxido de amonio. Este proceso es reversible.
Sales
Las sales son compuestos que resultan de la combinación de sustancias ácidas con sustancias básicas. Las sales comprenden tanto compuestos binarios o diatómicos, como ternarios. Y hay distintos tipos o formas de clasificarlas que son: sales neutras, sales ácidas, sales básicas y sales mixtas.
Sales neutras
Las sales neutras son compuestos formados por la reacción de un ácido con un hidróxido (compuesto ternario básico) formando también agua. Entre las sales neutras se encuentran las binarias y las ternarias, que se diferencian entre si por el ácido con el que reaccionan, siendo estos un hidrácido o un oxácido.
Cuando reacciona un ácido con un hidróxido para formar una sal neutra se combinan todos los cationes hidronio (H+1) con todos los aniones hidroxilo (OH-1). Los cationes H+1 son los que dan la propiedad de ácido a los hidrácidos y oxácidos, y los aniones OH-1 son los que dan propiedad de base a los hidróxidos, y cuando estos ácidos y bases reaccionan dan lugar a una ización, que es la formación de agua, mientras que los iones restantes de la reacción forman una sal. Es por esta razón que estas sales reciben el nombre de "neutras". Ver las ecuaciones abajo mostradas.
Las sales neutras binarias o sales haloideas son compuestos formados por un hidrácido y un hidróxido. Para nombrarlos en el sistema tradicional, stock y sistemático se aplican las reglas generales usando el nombre del no metal con el sufijo –uro como nombre genérico y el nombre del metal como nombre específico.
En las dos primeras ecuaciones se presenta el proceso completo para la formación de una sal neutra binaria y en las últimas dos se ejemplifica por separado la neutralización y la formación de la sal neutra.
| Compuesto | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura Tradicional |
|---|---|---|---|
| NaCl | cloruro de sodio | cloruro de sodio (I) | cloruro sódico o cloruro de sodio |
| CaF2 | difluoruro de calcio | fluoruro de calcio (II) | fluoruro cálcico |
| FeCl3 | tricloruro de hierro | cloruro de hierro (III) | cloruro férrico |
| CoS | monosulfuro de cobalto | sulfuro de cobalto (II) | sulfuro cobaltoso |
- Nota: para el correcto nombramiento de estos compuestos hacer énfasis en que los no metales de los hidrácidos trabajan con la menor valencia (1 y 2), y como son los hidrácidos que reaccionan con los hidróxidos para formar las sales neutras binarias. Es por esta razón que en el caso del FeCl3 el hierro oficia con la valencia +3 y el "no metal" cloro con -1, aunque éste posea las valencias 1, 3, 5 y 7.
Las sales neutras ternarias son compuestos formados por un hidróxido y un oxácido. La denominación que reciben las sales provienen del nombre del ácido, oxácido, que las origina. Para nombrar una sal cuando deriva de un ácido cuyo nombre específico termina en -oso, se reemplaza dicha terminación por -ito. Análogamente cuando el nombre específico del ácido termina en –ico, se reemplaza por -ato. Por ejemplo: el Hidróxido de sodio (Na(OH)) reacciona con el ácido ortofósforico o ácido fosfórico (H3PO4) para formar la sal fosfato de sodio u ortofosfato de sodio (Na3PO4).
Otra manera para saber cuándo utilizar los sufijos –ito o –ato, en lugar de determinar de qué ácido proviene la sal neutra, para así nombrar el compuesto; se determina el número de valencia con el que figura el no metal diferente de oxígeno en el compuesto. El procedimiento es similar al utilizado en los oxácidos (sección oxácidos, tercer párrafo). Los puntos que hay que tener en cuenta son:
- El elemento más electronegativo es el oxígeno y los elementos más electropositivos son el metal y el no metal.
- En la fórmula molecular el metal va a la izquierda, el no metal va al centro y el oxígeno va a la derecha.
- El oxígeno trabaja con el número de valencia -2.
- Los elementos que formaran el radical u oxoanión son el no metal y el oxígeno, razón que obliga a que la suma de valencias o cargas entre estos dos elementos sea negativa.
- La suma de cargas entre los tres elementos o entre el metal y el radical será igual a cero, lo que significa que la molécula será neutra.
Por ejemplo: Ca(ClO3)2. En resumen el procedimiento se basa en determinar la carga de uno de los dos radicales, que será negativo, y con esto se puede establecer el número con el que debe trabajar el metal, para que la suma entre este y los dos radicales sea igual a cero. Como primer paso hay que determinar la carga del radical; como hay 3 oxígenos en el radical y cada oxígeno trabaja con -2 la carga total de los oxígenos en un radical es de -6; como hay 1 cloro en el radical y la suma de valencias entre el oxígeno y el cloro dentro del radical debe ser negativo, el cloro trabajara con +5 de valencia. Para probar que el cloro debe trabajar con +5 únicamente, en este compuesto, se hace la operatoria con cada número de valencia del cloro; si el cloro trabajara con +1, la sumatoria con la carga -6 de los oxígenos seria igual a -5, esta carga de -5 seria de un solo radical y como hay dos, los radicales tendrían una carga de -10, así que el calcio para sumar una carga neta de cero para la molécula debería trabajar con un número de valencia +10, el cual no existe, entonces el cloro no puede trabajar con -1 en el radical; si el cloro trabajara con el +3 ocurriría lo mismo, al final el calcio para equilibrar la molécula debería trabajar con la valencia +6, valencia con la que no cuenta el cloro; y si el cloro trabajara con +6 la sumatoria de valencias entre el cloro y los oxígenos dentro del radical seria igual a cero, lo cual no es correcto ya que el radical debe tener una carga negativa. Ya que el cloro trabaja con +5 la carga sumada de los dos radicales es de -2, así que el calcio tendría que usar la valencia +2 para hacer cero la carga neta de la molécula. Cuando en una molécula hay solamente un radical se omiten los paréntesis de la fórmula
En el sistema tradicional se utiliza como nombre genérico el nombre del no metal con el sufijo y prefijo correspondiente a su número de valencia y como nombre específico el nombre del metal, elemento proporcionado por el hidróxido. Según el número de valencia del no metal en la sal (o del no metal en el oxácido que da origen a la sal) los sufijos son:
| hipo- … -oso | (para números de valencia 1 y 2) | hipo- … -ito |
| … -oso | (para números de valencia 3 y 4) | … -ito |
| … -ico | (para números de valencia 5 y 6) | … -ato |
| per- … -ico | (para el número de valencia 7) | per- … -ato |
En el ejemplo anterior, Ca(ClO3)2, como el cloro trabaja con la valencia +5, el compuesto se nombra Clorato de calcio.
En la nomenclatura sistemática se utiliza como nombre genérico, el nombre del no metal con el prefijo correspondiente al número de oxígenos presentes por radical en el compuesto (según la tabla de prefijos griegos), seguido de la partícula “oxo”, más el nombre del no metal con el sufijo ato seguido de la valencia del no metal en números romanos, y como nombre específico se utiliza el nombre del metal seguido de la valencia del metal en números romanos.
En el sistema Stock, se utiliza como nombre genérico el nombre de no metal seguido de la valencia del no metal en números romanos, y como nombre específico se utiliza el nombre del metal.
| Compuesto | Nom. Sistemática | Nom. Stock | Nom. tradicional |
|---|---|---|---|
| Na3PO4 | tetraoxofosfato (V) de sodio | fosfato (V) de sodio4 | fosfato de sodio u ortofosfato de sodio |
| CaSO4 | tetraoxosulfato (VI) de calcio | sulfato (VI) de calcio4 | sulfato de calcio |
| NaClO4 | tetraoxoclorato (VII) de sodio | clorato (VII) de sodio4 | perclorato de sodio |
| Mg(BrO)2 | dioxobromato (II) de magnesio | bromato (I) de magnesio4 | hipobromito de magnesio |
| Sn(NO2)4 | dioxonitrato (III) de estaño (IV) | nitrito de estaño (IV)4 | nitrito estáñico |
Sales ácidas
Las sales ácidas son compuestos cuaternarios que resultan del reemplazo parcial de los hidrógenos de un ácido por átomos metálicos. Los ácidos deben presentar dos o más hidrógenos en su molécula para formar estas sales. Para nombrarlos en el sistema tradicional se siguen las reglas de las sales neutras ternarias agregando la palabra “ácido” antes del nombre del metal. Y para nombrarlos en el sistema Stock y sistemático se usan las reglas generales para las sales neutras ternarias, en estos dos sistemas, agregando la palabra “hidrógeno” antes del nombre del no metal. Para poder encontrar la valencia del no metal para así poder nombrar correctamente la sal se puede usar el método utilizado en los compuestos de sales neutras ternarias, teniendo en cuenta: que el oxígeno trabaja con valencia -2; el hidrógeno trabaja con valencia +1; estos compuestos siguen la fórmula general Metal + Hidrógeno + No Metal + Oxígeno; los elementos con valencias positivas son el metal, el hidrógeno y los elementos con valencias negativas son el no metal y el oxígeno.
| Compuesto | Nom. Stock y sistemática | Nom. tradicional |
|---|---|---|
| NaHSO4 | hidrógenosulfato (VI) de sodio4 | sulfato ácido de sodio4 |
| KHCO3 | hidrógenocarbonato de Potasio4 | carbonato ácido de Potasio4 |
Sales básicas
Estas sales son compuestos que resultan de reemplazar parcialmente los oxhidrilos de un hidróxido por los aniones de un ácido. Para nombrarlos en el sistema tradicional depende de si el ácido es binario o ternario, es decir que si se trata de un hidrácido o un oxácido. Cuando el ácido es un hidrácido se utiliza el nombre del no metal con su sufijo uro y se le antepone el prefijo “hidroxi” para el nombre general y como nombre específico el nombre del metal. Y cuando el ácido es un oxacido, como nombre general, se utiliza el nombre del no metal con el prefijo “hidroxi” y su correspondiente sufijo según su valencia (como se indica en la sección de las sales neutras ternarias), y como nombre específico el nombre del metal.
| Compuesto | Nomenclatura tradicional |
|---|---|
| MgCl(OH) | hidroxicloruro de magnesio |
| CaNO3(OH) | hidroxinitrato de calcio |
Sales mixtas
Las sales mixtas son compuestos que resultan al sustituir los hidrógenos de un ácido por átomos metálicos de distintos hidróxidos. Las reglas para nombrar las sales mixtas en el sistema tradicional son análogas a las sales ácidas.
| Compuesto | Nomenclatura tradicional |
|---|---|
| NaKSO4 | tetraoxosulfato de sodio y potasio |
| CaNaPO4 | ortofosfato de calcio y sodio |
Poliácidos
Se trata de aquellos oxiácidos que resultan de la unión de 2 ó 3 moléculas de oxiácidos con la pérdida de una molécula de agua por cada unión que se realice. Es como si fuesen dímeros o trímeros.
Se nombran indicando el número de moléculas de ácido que se han unido con un prefijo (Nomenclatura tradicional) o indicando con prefijos el número de átomos del no metal o metal en los pocos casos en que ocurre (demás nomenclaturas).
| Ejemplo | Nom. Stock | Nom. sistemática | Nom. tradicional |
|---|---|---|---|
| H2S2O7 | ácido heptaoxodisulfúrico (VI) | heptaoxodisulfato (VI) de hidrógeno | ácido disulfúrico |
| H2Cr2O7 | ácido heptaoxodicrómico (VI) | heptaoxodicromato (VI) de hidrógeno | ácido dicrómico |
| H5P3O10 | ácido decaoxotrifosfórico (V) | decaoxotrifosfato (V) de hidrógeno | ácido trifosfórico |
Las sales de los poliácidos se nombran de forma análoga a las oxisales.
| Ejemplo | Nomenclatura sistemática y funcional | Nomenclatura tradicional |
|---|---|---|
| CaCr2O7 | heptaoxodicromato (VI) de calcio | dicromato cálcico o de calcio |
| Mg2P2O7 | heptaoxodifosfato (V) de magnesio | difosfato magnesico |
| Na2S2O7 | heptaoxodisulfato (VI) de sodio | disulfato sódico |
Peroxoácidos
Son aquellos oxoácidos que han sustituido un oxígeno por un grupo peroxo O22-. Su fórmula no se simplifica.
En la nomenclatura tradicional (la más frecuente) se añade peroxo-, y en las restantes se indica con -peroxo- el oxígeno sustituido. Si a la hora de formular pudiera haber confusión con otro oxoácido, se indica el grupo peroxo entre paréntesis.
| Ejemplo | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|---|
| H2SO5 | ácido trioxoperoxosulfúrico (VI) | trioxoperoxosulfato (VI) de hidrógeno | ácido peroxosulfúrico |
| HOONO ó HNO (O2) | ácido monoxoperoxonítrico (V) | monoxoperoxonitrato (V) de hidrógeno | ácido peroxonítrico |
| H3BO4 | ácido dioxoperoxobórico (III) | dioxoperoxoborato (III) de hidrógeno | ácido peroxobórico |
Las peroxisales se nombran de forma análoga a las oxisales.
| Ejemplo | Nomenclatura sistemática y Stock | Nomenclatura tradicional |
|---|---|---|
| K2S2O8 | hexaoxoperoxodisulfato (VI) de potasio | peroxodisulfato de potasio |
| Ba[NO (O2)]2 | oxoperoxonitrato (III) de bario | peroxonitrito de bario o bárico |
| CaSO5 | trioxoperoxosulfato (VI) de calcio | peroxosulfato de calcio |
Tioácidos
Son aquellos oxoácidos que resultan de la sustitución de uno o varios oxígenos por azufres. Se nombran con el prefijo tio- seguido por el ácido de origen (nomenclatura tradicional) o -tio- en la sistemática y de Stock, indicando con un prefijo el número de oxígenos restantes. Si se escribe tio sin prefijo numérico en la nomenclatura tradicional, se está indicando que se han sustituido todos los O por S, excepto en el caso de los tioácidos del azufre (aquí tio=monotio).
| Fórmula General: |
|---|
| R.CO.SH o R.CS.OH |
| Ejemplo | Nomenclatura sistemática | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|---|
| H2S2O3 | ácido trioxotiosulfúrico (VI) | trioxotiosulfato (VI) de hidrógeno | ácido tiosulfúrico |
| HNSO2 | ácido dioxotionítrico (V) | dioxotionitrato (V) de hidrógeno | ácido tionítrico |
| H3PS2O2 | ácido dioxoditiofosfórico (V) | dioxoditiofosfato (V) de hidrógeno | ácido ditiofosfórico |
Las tiosales se nombran de forma análoga a las oxisales.
| Ejemplo | Nomenclatura sistemática y stock | Nomenclatura tradicional |
|---|---|---|
| FeS2O3 | trioxotiosulfato (VI) de hierro (II) | tiosulfato ferroso |
| Al2(HPS4)3 | hidrógenotetratiofosfato (V) de aluminio | hidrógenotiofosfato de aluminio |
| Na3PS3O | oxotritiofosfato (V) de sodio | tritiofosfato de sodio |
Iones
Los iones son aquellos átomos o moléculas cargados eléctricamente. Pueden ser de carga positiva (cationes) o de carga negativa (aniones).
Cationes mono y poliatómicos
Son iones con carga positiva. Si son monoatómicos, se nombran simplemente nombrando el elemento después de la palabra catión. Por ejemplo, Li+ catión litio. Si el elemento tiene varios estados de oxidación (valencias) se usan números romanos (Stock) o los afijos hipo- -oso, -oso, -ico, per- -ico (tradicional).
| Ejemplo | Nomenclatura Stock | Nomenclatura tradicional |
|---|---|---|
| Fe3+ | catión hierro (III) | catión férrico |
| Cu+ | catión cobre (I) | catión cuproso |
Cuando se trata de cationes poliatómicos, se distinguen dos casos:
a) Si proceden de oxoácidos se añade el sufijo -ilo al nombre del oxoácido correspondiente en nomenclaturas tradicional (éste puede indicar la valencia en números romanos), también se puede nombrar en la Stock. Es como el oxoácido sin moléculas de agua.
| Ejemplo | Nomenclatura tradicional | Nomenclatura Stock |
|---|---|---|
| NO2+ | catión nitroilo | catión dioxonitrógeno (V) |
| NO+ | catión nitrosilo | catión monoxonitrógeno (III) |
| SO2+ | catión sulfinilo o tionilo | catión monoxoazufre (IV) |
| SO22+ | catión sulfonilo o sulfurilo | catión dioxoazufre (VI) |
| UO2+ | catión uranilo (V) | catión dioxouranio (V) |
| UO22+ | catión uranilo (VI) | catión dioxouranio (VI) |
| VO3+ | catión vanadilo (V) | catión monoxovanadio (V) |
| VO2+ | catión vanadilo (IV) | catión dioxovanadio (IV) |
b) Si proceden de hidruros, lleva el sufijo -onio.
| Ejemplo | Nombre |
|---|---|
| H3O+ | hidronio u oxonio |
| NH4+ | amonio |
| PH4+ | fosfonio |
| SbH4+ | estibonio |
| AsH4+ | arsonio |
| BiH4+ | bismutonio |
| H3S+ | sulfonio |
| H2Cl+ | cloronio |
Nomenclaturas de compuestos inorgánicos
Se aceptan tres tipos de nomenclaturas para nombrar compuestos químicos inorgánicos:
Nomenclatura sistemática o IUPAC, con prefijos / Atomicidad
También llamada racional o estequiométrica. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia.2 En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula.
La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico
(Véase en la sección otras reglas nombre genérico y específico).
Los prefijos son palabras que se anteponen al prefijo nombre del compuesto y representan el número de átomos que hay en la molécula del elemento. Existen diferentes prefijos los cuales provienen del griego y a continuación se presenta el número de átomos al que hace referencia el prefijo.2
(Generalmente solo se utiliza hasta el prefijo hepta-)
| Prefijos griegos | Número de átomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| non-, nona-, eneá- | 9 |
| deca- | 10 |
- El prefijo mono- normalmente se elude salvo que haya posibilidad de confusión.
- Por ejemplo, CrBr3: tribromuro de cromo; CO: monóxido de carbono
- En casos en los que en vez de átomos se trate de grupos de átomos como compuestos tales como sales dobles y triples, oxisales y similares, se pueden emplear los prefijos bis-, tris-, tetraquis, pentaquis, hexaquis, etc.
- Por ejemplo la fluorapatita Ca5F (PO4)3 : fluoruro tris(fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería:
- Ca5F (P3O10)3
Nomenclatura sistemática o IUPAC, con números romanos / Numeral de Stock
También llamada antiguamente nomenclatura de Stock. Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos el estado de oxidación del elemento con “nombre específico”. Si solamente tiene un estado de oxidación, éste no se escribe.
La valencia (o más bien el estado de oxidación) es la que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + "de" + nombre del elemento específico + el estado de oxidación.
Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.
- Ejemplo: Fe2S3, Fe2+3S3-2, sulfuro de hierro (III)
- Ejemplo: SO3, S2+6O6-2, óxido de azufre (VI)
Nomenclatura tradicional, clásica o antigua / Estequiométrica
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento con el sufijo –ico.
-
- K2O, óxido de potasio u óxido potásico
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
-
- …O-2, hierro con la valencia 2, (estado de oxidación +2), óxido ferroso
- … -ico cuando el elemento usa la valencia mayor: Fe2O3, Fe2+3O3-2, hierro con valencia 3, (estado de oxidación +3), óxido férrico3
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
-
- hipo- … -oso (para la menor valencia): P2O, P2+1O-2, fósforo con la valencia 1, (estado de oxidación +1), óxido hipofosforoso
- … -oso (para la valencia intermedia): P2O3, P2+3O3-2, fósforo con valencia 3, (estado de oxidación +3), óxido fosforoso
- … -ico (para la mayor valencia): P2O5, P2+5O5-2, fósforo con valencia 5, (estado de oxidación +5), óxido fosfórico
- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos
-
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia pequeña)
- … -ico (para la valencia grande)
- per- … -ico (para la valencia más grande)
Hoy esta nomenclatura está en desuso. Sin embargo aún se usa mucho en el comercio y la industria.


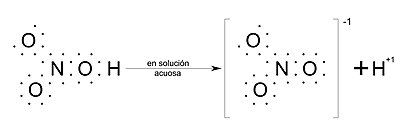


No hay comentarios:
Publicar un comentario