Disoluciones
Oir Lecc.
1. Disoluciones
Una disolución es un sistema material homogéneo formado por la mezcla de dos o más sustancias.
Al componente mayoritario de una disolución se le denomina disolvente, mientras que al resto de componentes se les conoce como solutos.
2. Tipos de disoluciones
Antes de hablar de los tipos de disoluciones existentes debemos conocer un concepto que nos va a ayudar a entender la clasificación de las disoluciones.
Solubilidad: llamamos solubilidad de una sustancia a la máxima cantidad de esa sustancia que se puede disolver en una cantidad de disolvente a una temperatura determinada. Cuanto mayor sea la temperatura, mayor será la solubilidad de una sustancia.
Así podemos entender los siguientes tipos de disoluciones:
- 1. Disolución diluida: es aquella disolución donde la cantidad de soluto está muy alejada de su solubilidad.
- 2. Disolución concentrada: es aquella disolución donde la cantidad de soluto está muy cerca de su solubilidad.
- 3. Disolución saturada: es aquella disolución que no admite más soluto.
- 4. Disolución sobresaturada: es aquella disolución que presenta más soluto del que puede admitir, para ello habrá que subir la temperatura de la mezcla.
3. Concentración de una disolución
La concentración de una disolución es una magnitud que nos informa sobre la cantidad de soluto presente en la disolución. Existen muchas formas de expresar la concentración de una disolución, nosotros nos vamos a detener en dos:
- Composición porcentual en masa: hace referencia al tanto por ciento en masa de soluto en la disolución.
Por ejemplo: tenemos una disolución de cloruro sódico en agua al 30%, quiere decir que de cada 100g de disolución 70g corresponden al agua y 30g al sodio. - Relación masa-volumen: expresa el número de gramos de soluto que hay por litro de disolución (g/L).Por ejemplo: tenemos una disolución de cloruro sódico en agua de 20g/L, quiere decir que por cada litro de agua hay una concentración de 20g de sodio.
4. Métodos de separación de mezclas
- 1. Filtración: se utiliza para separar mezclas formadas por sólidos insolubles en un líquido. El sólido queda retenido en el filtro.
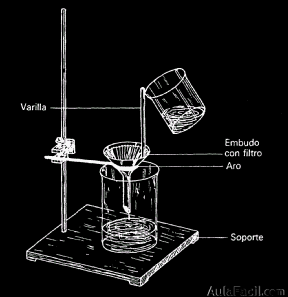
- 2. Centrifugación: se utiliza para separar mezclas formadas por sólidos insolubles y un líquido. Es más preciso que la filtración. Se utiliza una centrifugadora que hace girar a los tubos de muestra de tal manera que las partículas sólidas finalizan en el fondo de los tubos al final del proceso.
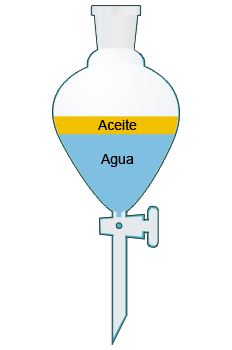
- 3. Decantación: se utiliza para separar mezclas formadas por dos líquidos no miscibles. Utilizaremos un embudo de decantación.
- 4. Cristalización: su objetivo principal es cristalizar el soluto de una solución por evaporación del solvente. Se lleva a cabo en un recipiente de base ancha que recibe el nombre de cristalizador.
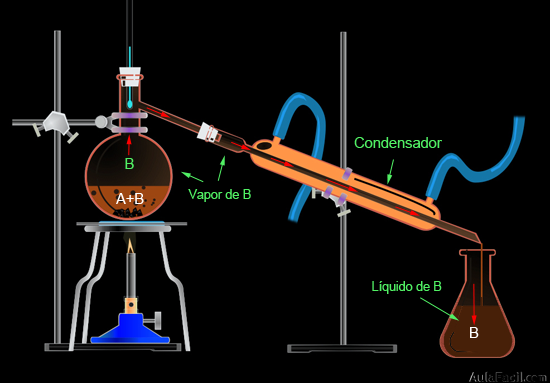
- 5. Destilación simple: se utiliza para separar mezclas de sólidos solubles en líquidos, así como las mezclas de dos líquidos miscibles y con diferentes punto de ebullición que difieran al menos en 25ºC.Este método requiere un montaje algo más complejo que los anteriores métodos, ya que se necesita un mayor número de material de laboratorio:
- 1. Colocamos la mezcla de dos líquidos miscibles (A y B) de distinto punto de ebullición en el matraz.
- 2. Al calentar la mezcla, el líquido de menor punto de ebullición (B) comenzará a vaporizarse, mantendremos constante esa temperatura para que no vaporice el líquido A.
- 3. El vapor de B sube por el matraz y llega al condensador, donde disminuye su temperatura debido al contacto que experimenta con las paredes frías del tubo por donde circula agua, con lo que el vapor de B condensa y vuelve a estado líquido.
- 4. El líquido de B resbala por el tubo del condensador y cae en el matraz de destilado. Entendemos que la destilación ha concluido cuando deja de gotear líquido B en el matraz de destilado.
- 5. Ya podemos observar como los líquidos A y B están perfectamente separados.
http://www.aulafacil.com
¿Qué es una Disolución?
Una disolución es una mezcla homogénea, es decir, una mezcla de 2 o más componentes que no reaccionan entre sí, es decir, que siguen siendo los mismos después de mezclados, y además por ser homogénea no se ven o diferencian sus componentes después de mezclados a simple vista.
Pero entonces... ¿Qué diferencia hay entre una mezcla homogénea y una disolución?.
Pues bien cuando en la mezcla homogénea uno de los dos componentes es líquido, normalmente agua, esta mezcla homogénea es a lo que se le suele llamar disolución. Las disoluciones quimicas suelen estar en estado líquido.

Por ejemplo el chocolate es una mezcla homogénea de varios componentes que no se diferencian a simple vista, pero están en estado sólido, por eso no se le llamaría disolución.
Si mezclamos agua con azúcar y revolvemos, al cabo de un tiempo no se verán los componentes en la mezcla, será una mezcla homogénea, pero ha esta si la podemos y debemos llamar disolución.
Componentes de una Disolución
Al componente más abundante en la disolución se le llama Disolvente y al resto se les llama Soluto.
A veces también se le llama a la disolución, solución, y al disolvente se le puede llamar solvente.


Como hemos dicho, normalmente el disolvente es el líquido y la disolución está en estado líquido.
En el caso del agua con azúcar, el agua será el disolvente y el azúcar el soluto.
Conceptos Sobre Disoluciones
Si echamos azúcar en un vaso de agua, llegará un momento que el agua ya no pueda absorber más azúcar y si echamos más azúcar, esta en lugar de formar parte de la disolución, irá al fondo del vaso.
Llega un momento que la disolución se satura, no admite más soluto. En este caso diremos que la disolución es saturada.
Pues bien, en 100 gramos de agua la máxima cantidad de azúcar que podría disolverse, sería la solubilidad de esa disolución.
- Solubilidad: en una disolución es la máxima cantidad de soluto expresada en gramos que se pueden disolver por cada 100 gramos de disolvente.
Tenemos que tener en cuenta que cuenta más caliente está el líquido más cantidad de soluto admite. Lo líquidos y los sólidos se disuelven mejor en otro líquido cuanto más caliente está este último. El soluto es más soluble en líquidos calientes.
Esto significa que si tengo agua a 20ºC y es capaz de absorver 10 gramos de azucar, a 50ºC es capaz de disolver más cantidad de azucar. La solubilidad aumenta con la temperatura de la disolución.
- Concentración : es la cantidad de soluto que hay disuelto en una cantidad de disolución. OJO Cantidad de soluto/cantidad de disolución. Nos da una relación de la cantidad de soluto que hay en la disolución.
c = cantidad de soluto/cantidad de disolución
Claro está que las cantidades se pueden expresar en gramos, en volúmenes, en moles, etc. Por ejemplo un alcohol comercial que pone al 70% quiere decir que el 70% es alcohol y el resto, el 30%, es agua. Pero también podemos decir que el 70% del volumen de la botella es de alcohol y el 30% del su volumen es agua, o que el 70% del peso es alcohol y el resto agua.
OJO a veces se puede hacer cantidad de soluto/cantidad de disolvente, en lugar de disolución, pero no es lo normal.
Normalmente a la fórmula anterior se le suele multiplica por 100 para que nos salga la concentración en porcentaje.
Veamos un ejemplo:
Tenemos 120 gramos de agua en la que echamos 20 gramos de azúcar. ¿Cual es su concentración?.
Cantidad de soluto= 20 gramos
Cantidad de disolvente= 120 gramos
Cantidad de disolución = 20 + 120 = 140 gramos.
Aplicamos la fórmula:
c = 20/140 x 100 = 14, 28%
Quiere decir que el 14,28% es azúcar y el resto es agua.
Tipos de Disoluciones
Según su concentración las disoluciones pueden ser:
Diluidas: si la cantidad de soluto respecto del disolvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del disolvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Fórmulas para Disoluciones
Lo primero decir dos pequeños trucos para resolver problemas.
- Al aplicar las fórmulas, antes obtener las cantidades de soluto y de disolvente en las mismas unidades.
- Si en un problema de disoluciones ni me dan ni me preguntan una cantidad, puedo suponer la cantidad que yo quiera, lo más utilizado es suponer 100gr de disolución o 1 litro de disolución.
Densidad = Masa / Volumen
Riqueza , pureza o % en masa % en masa = masa de soluto / masa disolución
Molaridad M = nº moles de soluto/litros de disolución
molalidad m = nº moles de soluto/Kg disolvente
fracción molar de soluto Xs = nº de moles de soluto/nº moles totales
fracción molar de disolvente Xd = nº de moles de disolvente/nº de moles totales
moles = Nº de moles = gramos/Mxm
gramos por litro g/l = gramos de soluto/litros de disolución
gramos de soluto + gramos de disolvente = gramos de disolución.
Ejercicios Disoluciones
1) Calcular Molaridad (M) de una disolución obtenida disolviendo en agua 100 g de sulfato de cobre (II) y añadiendo después más agua hasta completar un volumen de un litro.
Datos que se dan : Masas Atómicas: S=32; Cu=63,5; O=16.
Solución:
El sulfato de cobre es CuSO4 (4 átomos de oxígeno tiene la molécula)
M = Moles de sulfato / Litros de Agua
Con los datos de las masas atómicas sacamos los moles por gramo del sulfato de cobre.
Cu + S + 4xO = 63,5 + 32 + 4x 16 = 159,5 gramos/mol. Según esto podemos calcular la cantidad de moles de sulfato que tenemos en 100gramos de sulfato, sabiendo que en 159,5 gramos hay un mol


Pero entonces... ¿Qué diferencia hay entre una mezcla homogénea y una disolución?.
Pues bien cuando en la mezcla homogénea uno de los dos componentes es líquido, normalmente agua, esta mezcla homogénea es a lo que se le suele llamar disolución. Las disoluciones quimicas suelen estar en estado líquido.
Por ejemplo el chocolate es una mezcla homogénea de varios componentes que no se diferencian a simple vista, pero están en estado sólido, por eso no se le llamaría disolución.
Si mezclamos agua con azúcar y revolvemos, al cabo de un tiempo no se verán los componentes en la mezcla, será una mezcla homogénea, pero ha esta si la podemos y debemos llamar disolución.
Componentes de una Disolución
Al componente más abundante en la disolución se le llama Disolvente y al resto se les llama Soluto.
A veces también se le llama a la disolución, solución, y al disolvente se le puede llamar solvente.
Como hemos dicho, normalmente el disolvente es el líquido y la disolución está en estado líquido.
En el caso del agua con azúcar, el agua será el disolvente y el azúcar el soluto.
Conceptos Sobre Disoluciones
Si echamos azúcar en un vaso de agua, llegará un momento que el agua ya no pueda absorber más azúcar y si echamos más azúcar, esta en lugar de formar parte de la disolución, irá al fondo del vaso.
Llega un momento que la disolución se satura, no admite más soluto. En este caso diremos que la disolución es saturada.
Pues bien, en 100 gramos de agua la máxima cantidad de azúcar que podría disolverse, sería la solubilidad de esa disolución.
- Solubilidad: en una disolución es la máxima cantidad de soluto expresada en gramos que se pueden disolver por cada 100 gramos de disolvente.
Tenemos que tener en cuenta que cuenta más caliente está el líquido más cantidad de soluto admite. Lo líquidos y los sólidos se disuelven mejor en otro líquido cuanto más caliente está este último. El soluto es más soluble en líquidos calientes.
Esto significa que si tengo agua a 20ºC y es capaz de absorver 10 gramos de azucar, a 50ºC es capaz de disolver más cantidad de azucar. La solubilidad aumenta con la temperatura de la disolución.
- Concentración : es la cantidad de soluto que hay disuelto en una cantidad de disolución. OJO Cantidad de soluto/cantidad de disolución. Nos da una relación de la cantidad de soluto que hay en la disolución.
c = cantidad de soluto/cantidad de disolución
Claro está que las cantidades se pueden expresar en gramos, en volúmenes, en moles, etc. Por ejemplo un alcohol comercial que pone al 70% quiere decir que el 70% es alcohol y el resto, el 30%, es agua. Pero también podemos decir que el 70% del volumen de la botella es de alcohol y el 30% del su volumen es agua, o que el 70% del peso es alcohol y el resto agua.
OJO a veces se puede hacer cantidad de soluto/cantidad de disolvente, en lugar de disolución, pero no es lo normal.
Normalmente a la fórmula anterior se le suele multiplica por 100 para que nos salga la concentración en porcentaje.
Veamos un ejemplo:
Tenemos 120 gramos de agua en la que echamos 20 gramos de azúcar. ¿Cual es su concentración?.
Cantidad de soluto= 20 gramos
Cantidad de disolvente= 120 gramos
Cantidad de disolución = 20 + 120 = 140 gramos.
Aplicamos la fórmula:
c = 20/140 x 100 = 14, 28%
Quiere decir que el 14,28% es azúcar y el resto es agua.
Tipos de Disoluciones
Según su concentración las disoluciones pueden ser:
Diluidas: si la cantidad de soluto respecto del disolvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del disolvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Fórmulas para Disoluciones
Lo primero decir dos pequeños trucos para resolver problemas.
- Al aplicar las fórmulas, antes obtener las cantidades de soluto y de disolvente en las mismas unidades.
- Si en un problema de disoluciones ni me dan ni me preguntan una cantidad, puedo suponer la cantidad que yo quiera, lo más utilizado es suponer 100gr de disolución o 1 litro de disolución.
Densidad = Masa / Volumen
Riqueza , pureza o % en masa % en masa = masa de soluto / masa disolución
Molaridad M = nº moles de soluto/litros de disolución
molalidad m = nº moles de soluto/Kg disolvente
fracción molar de soluto Xs = nº de moles de soluto/nº moles totales
fracción molar de disolvente Xd = nº de moles de disolvente/nº de moles totales
moles = Nº de moles = gramos/Mxm
gramos por litro g/l = gramos de soluto/litros de disolución
gramos de soluto + gramos de disolvente = gramos de disolución.
Ejercicios Disoluciones
1) Calcular Molaridad (M) de una disolución obtenida disolviendo en agua 100 g de sulfato de cobre (II) y añadiendo después más agua hasta completar un volumen de un litro.
Datos que se dan : Masas Atómicas: S=32; Cu=63,5; O=16.
Solución:
El sulfato de cobre es CuSO4 (4 átomos de oxígeno tiene la molécula)
M = Moles de sulfato / Litros de Agua
Con los datos de las masas atómicas sacamos los moles por gramo del sulfato de cobre.
Cu + S + 4xO = 63,5 + 32 + 4x 16 = 159,5 gramos/mol. Según esto podemos calcular la cantidad de moles de sulfato que tenemos en 100gramos de sulfato, sabiendo que en 159,5 gramos hay un mol
http://www.areaciencias.com/quimica/disoluciones-quimicas.html
No hay comentarios:
Publicar un comentario