La Materia: teoría cinética
1. Teoría cinética de la materia
La teoría cinética de la materia parte de los siguientes conceptos:
- La Materia es discontinua: está formada por pequeñas partículas no visibles.
- Todas las partículas de una misma sustancia son idénticas entre sí.
- Las partículas están en un continuo movimiento.
- Las partículas de cada sustancia se atraen entre sí.
- El volumen ocupado por las partículas que forman un objeto material es menor que el volumen ocupado por el objeto.
2. La teoría cinética y los estados de agregación
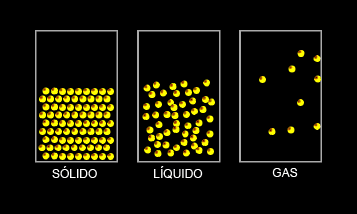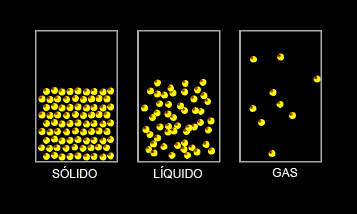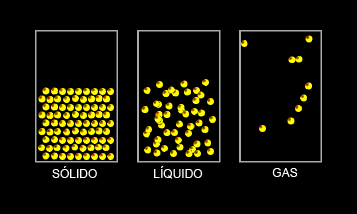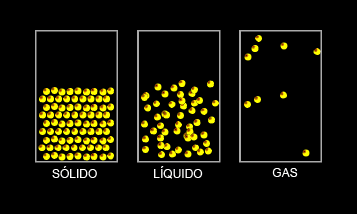
La materia presenta tres estados de agregación: estado sólido, estado líquido y estado gaseoso.
Utilizando la teoría cinética de la materia podemos explicar satisfactoriamente las propiedades de los tres estados de
agregación de la materia:
agregación de la materia:
- 1. Estado sólido: las fuerza entre sus partículas son muy fuertes, las partículas están próximas entre sí, esto hace que no gocen de libertad, sólo pueden presentar un pequeño movimiento de vibración. Así los sólidos tienen forma propia y un volumen constante.
- 2. Estado líquido: se caracteriza porque las fuerzas entre sus partículas son intermedias, existe cierta separación entre ellas, lo que permite que las partículas se muevan con algo de libertad y que los líquidos no tengan una forma definida sino que dependan del recipiente que los contenga, pero con volumen constante.
- 3. Estado gaseoso: las fuerzas entre sus partículas son prácticamente inexistentes, por lo que se encuentran muy separadas y con una alta libertad. Los gases no tienen ni forma ni volumen definido y a diferencia de los líquidos, se extienden por todo el recipiente que los contiene.
En el modelo cinético del gas ideal la única interacción entre esferas por las que consideramos está formado el gas es causada por choques elásticos. Esto es, las moléculas no ejercen ninguna fuerza entre sí, ni con otras del sistema, excepto en el momento de la colisión.
Figura 11. (a): Aquí se muestra una colisión entre dos esferas impenetrables, cada una con diámetros d. (b): Si r es la distancia entre los centros de las esferas, la fuerza F graficada contra res infinita si r es igual a d y cero para cualquier otro valor r mayor de d.
Ésta ocurre, como se muestra en la figura 11a, cuando la distancia entre los centros de las moléculas es igual al diámetro de una de ellas. Como las esferas son, por hipótesis, impenetrables, esta característica puede representarse por una fuerza que es infinita en el instante de dicha colisión e igual a cero para cualquier otra distancia de separación entre ellas (Figura 11 b). En las moléculas de los gases comunes y corrientes las cosas no ocurren así. De hecho, las fuerzas intermoleculares son diferentes para distintas clases de gases. De esta forma, para los gases nobles y los vapores de algunos metales monatómicos, como el litio, el sodio, la plata, el mercurio y otros, las fuerzas entre los átomos sólo dependen de la magnitud de la distancia entre dos de ellos; esto es, la fuerza entre los átomos sólo actúa entre pares de ellos. Como los átomos no tienen una estructura interna, pueden concebirse como esferas (no rígidas), y como tales no exhiben diferentes configuraciones al variar su orientación en el espacio. Por lo tanto decimos que las fuerzas son esféricamente simétricas. Si de nuevo llamamos d al diámetro de esas esferas, hay una fuerza repulsiva casi infinita cuando la distancia entre los centros de estos átomos se aproxima al valor de un diámetro. A distancias cortas se comportan casi como esferas duras, pero a distancias mayores que d, las fuerzas entre ellas son atractivas. La magnitud de esta fuerza va siendo cada vez menor a medida que las moléculas se alejan entre sí, para hacerse casi iguales a cero a distancias grandes. Usualmente estas distancias son del orden de una decena de diámetros moleculares (ver Figura 12).
Para una cierta distancia rm, la fuerza atractiva tiene en magnitud un valor máximo que representa la configuración más estable que pueden formar dos átomos. En términos energéticos, se requiere de una cierta energía, por ejemplo, producida por la presencia de una tercera molécula energética, para que los dos átomos que originalmente se encuentran a la distancia rm se alejen uno de otro.
Para gases formados por moléculas más complicadas, como los gases diatómicos H2, N202, CO, NO y otros, las fuerzas, aunque cualitativamente descriptibles, como en el ejemplo dado en la figura 12, pueden complicarse por la influencia de la estructura misma de la molécula. En gases poliatómicos como el agua (H2, el amoniaco (NH3, el metano (CH4), etc., las complicaciones son cada vez mayores y, entre más compleja es la molécula, obviamente mayor es la complicación.
Vamos a contentarnos en esta discusión con suponer que las fuerzas interatómicas o intermoleculares son de la forma general descrita en la figura 12. Es decir, entre N partículas, sean átomos o moléculas, las partículas interaccionan entre sí sólo por pares. La interacción total es la suma de estas interacciones sobre todos los pares de moléculas, las cuales son esféricamente simétricas. Aun con todas estas simplificaciones, la teoría cinética resultante, que podría aplicarse a una variedad de sustancias en la naturaleza, introduce las suficientes complicaciones, cuyas consecuencias no han sido todavía satisfactoriamente resueltas. Veamos cuáles son éstas antes de considerar mayores complicaciones.
Imaginemos ahora un recipiente repleto de átomos o moléculas entre las cuales existe una interacción como la representada en la figura 12. ¿Cómo afecta esta modificación en la fuerza interatómica la dependencia de la presión con el volumen y la temperatura? ¿Y la dependencia de la energía interna con la temperatura? La respuesta a estas preguntas ya no es tan sencilla como las que pudimos dar en el caso del gas ideal. En la ecuación de estado del gas ideal, la cual se obtiene sintetizando la Ley de Boyle y la Ley de Charles que vimos en el capítulo IV (véase Apéndice 2),
el volumen V que aparece en el miembro izquierdo es el volumen total del recipiente que contiene a las partículas. Esto implica que tácitamente hemos despreciado primeramente el volumen ocupado por las moléculas. En efecto, si éstas son esferas de radio d/2, el volumen ocupado por cada una de ellas es de .
Si hay N moléculas en el gas, ocuparán un volumen de  , y por lo tanto el volumen del espacio del contenedor accesible a ellas será de V -
, y por lo tanto el volumen del espacio del contenedor accesible a ellas será de V -  . A este volumen Clausius le llamó el covolumen, y propuso, en 1851, que la ecuación de Boyle para el gas ideal se substituyera por:
. A este volumen Clausius le llamó el covolumen, y propuso, en 1851, que la ecuación de Boyle para el gas ideal se substituyera por:
donde b = es el covolumen. Esta modificación de la ecuación de estado es acertada, pero no muy relevante. Un gas que obedece la ecuación de Clausius no difiere mucho en sus propiedades de las de un gas ideal. Pero en 1872, el gran físico holandés J. D. Van der Waals hizo ver que, debido a las fuerzas atractivas entre las partículas, la presión efectiva sobre una superficie dada tendría que ser modificada. Una molécula que se acerca a una pared va a "pegarle menos fuerte" al verse sometida a la atracción de las moléculas que la rodean. Por tanto, la fuerza del golpe es menor y eso redunda en una presión que tendrá que ser corregida por la presencia de estas fuerzas atractivas.
es el covolumen. Esta modificación de la ecuación de estado es acertada, pero no muy relevante. Un gas que obedece la ecuación de Clausius no difiere mucho en sus propiedades de las de un gas ideal. Pero en 1872, el gran físico holandés J. D. Van der Waals hizo ver que, debido a las fuerzas atractivas entre las partículas, la presión efectiva sobre una superficie dada tendría que ser modificada. Una molécula que se acerca a una pared va a "pegarle menos fuerte" al verse sometida a la atracción de las moléculas que la rodean. Por tanto, la fuerza del golpe es menor y eso redunda en una presión que tendrá que ser corregida por la presencia de estas fuerzas atractivas.
Razonando con respecto a estas ideas, Van der Waals logró modificar la ecuación de Clausius, sustituyendo el valor de la presión p por otro más complicado, que toma en cuenta la presencia de dichas fuerzas. La ecuación resultante, ahora conocida con el nombre de la ecuación Van der Waals, representó el avance más notable en nuestro entendimiento del comportamiento de los gases reales alcanzado en el siglo XIX. Vale la pena insistir que de tal ecuación es posible obtener una imagen cualitativa global de cómo se comporta una sustancia pura, no sólo en la fase gaseosa, sino también en la región donde el gas coexiste en equilibrio con el líquido —lo que comunmente llamamos ebullición— y en la región donde la sustancia existe en forma de líquido. Como vemos, ¡con una modificación relativamente simple de nuestro modelo cinético podemos pasar, de la abstracción, a una situación más apegada a la realidad! Los gases reales, como los conocemos en la vida cotidiana: el aire que respiramos, el vapor de una caldera, el anhídrido sulfuroso con que contaminamos el aire (S02), el amoniaco con que fabricamos fertilizantes, el bióxido de carbono en que convertimos el oxígeno por el proceso de respiración, etc., tienen propiedades todavía más complicadas que las que pueden predecirse de un modelo cinético como el usado por Van der Waals. No obstante, este modelo ha servido para generar otros más complicados que permiten incorporar en su descripción a gases como los arriba mencionados. Así pues, la teoría cinética nos permite establecer la plataforma mínima del conocimiento a partir de la cual esas extrapolaciones tienen una base molecular.
Todos sabemos diferenciar, en general, un líquido de un gas. En el líquido las moléculas tienden a ocupar parcialmente el volumen del recipiente que las contiene, adquiriendo, en grueso, la forma geométrica de éste. Forma una superficie a lo largo de toda la porción en contacto con la atmósfera que lo rodea, que es plana si la anchura del recipiente que lo contiene es grande, pero también sabemos que al ponerse en tubos pequeños forma una superficie curvada en general, llamada menisco. Además, son mucho más difíciles de comprimir o de dilatar que los gases. Todo esto apunta a la posibilidad de que en el líquido las moléculas están más densamente empaquetadas entre sí que en el gas. En el lenguaje usado al estudiar el modelo cinético del gas ideal podría decirse que la "vida media" de las moléculas, esto es, el tiempo entre dos colisiones sucesivas, debe ser muy pequeño comparado con el de un gas. Y ciertamente ya no podemos aceptar la tesis de las colisiones por contacto; si de acuerdo con la figura 11, sólo hubiera fuerzas repulsivas en un líquido, éste seria "inestable". Estallaría por la estrecha cercanía que hay entre las moléculas. Entonces, las fuerzas atractivas deben desempeñar aquí un papel preponderante. El vino de la pintura del gran Van Gogh, el vaso con agua que colocamos sobre la mesa..., son tan estables como una piedra, a menos que hagamos algo para perturbar esa estabilidad. ¿Cómo interpretar esta característica a nivel molecular?
En el caso de un gas, las moléculas, aun considerando la presencia de fuerzas atractivas, pueden moverse libremente en todo el recipiente que lo contiene. La energía cinética promedio de una molécula, que hemos usado para interpretar a la temperatura a nivel molecular; llega a tener valores relativamente grandes. En un líquido la situación es parecida, excepto que debido a su mayor densidad, o sea al mayor número de moléculas por unidad de volumen, hace que la distancia intermolecular promedio sea mucho menor que para un gas. En consecuencia, una molécula, a pesar de chocar con sus vecinos un gran número de veces, queda "enjaulada" por ellas, hasta que puede finalmente encontrar un hueco para escapar a otra región, no menos densa que la anterior y de la cual tendrá también dificultades para salir (ver Figura 13). Más que un movimiento ágil y vigoroso como lo visualizaríamos en un gas, una molécula de un líquido camina a saltos de una región a otra siguiendo un camino un tanto errático. Este movimiento es característico de los procesos difusivos, incluyendo en ellos al movimiento browniano.
Figura 13. Evaporación. (a) El éter se evapora más fácilmente que el agua, (b) porque las fuerzas atractivas entre sus móleculas son más débiles.
Con objeto de estudiar mejor y tener una idea más clara de lo que es un líquido, se han hecho una multitud de experimentos conducentes a obtener información sobre cómo están dispuestas las moléculas en él. Estos experimentos fueron iniciados por Max von Laue en 1912 en Alemania para averiguar la estructura de los sólidos mediante la difracción de rayos X. Estos rayos, de muy pequeña longitud de onda, al incidir sobre el material son desviados de su trayectoria original por los átomos que componen el sólido. Los rayos desviados, al salir del sólido, se registran en una placa fotográfica. Al revelar dicha placa se encuentra que alrededor de una intensa mancha negra central, que corresponde al rayo no desviado, hay un patrón de manchas más débiles dispuestas en un arreglo geométrico. De aquí pudo inferir Von Laue que los átomos en un cristal están dispuestos de tal manera que forman un patrón ordenado con geometrías bien definidas. Al radiografiar a un líquido se obtienen resultados sorprendentes. En efecto, si fijamos nuestra atención sobre una partícula arbitrariamente escogida del líquido, se observa que sus vecinas más cercanas no están dispuestas de manera irregular, sino que obedecen a un arreglo que guarda cierta semejanza con el orden geométrico que se observa en el mismo material en fase sólida. Sin embargo, a medida que nos alejamos de la molécula escogida, las vecinas próximas más cercanas exhibirán menos orden y a distancias de unos cuantos diámetros moleculares, la disposición de las moléculas es más o menos al azar. Por ello se dice que los líquidos exhiben solamente "orden de corto alcance". Esta distancia, donde se pierde el orden semejante al del sólido, se va reduciendo paulatinamente a medida que aumentamos la temperatura. Y desde luego, se pierde totalmente cuando el líquido empieza a evaporarse.
¿Cómo podemos ahora pensar sobre lo que es la presión o la energía cinética promedio por molécula en el líquido? Evidentemente la relación tan sencilla que pudimos establecer entre ellas en el modelo cinético simple del capítulo anterior ya no se va a cumplir. La presencia de las fuerzas atractivas debe dejarse sentir. Y en efecto, así ocurre pues la contribución más importante proviene de que en el líquido el empaquetamiento entre las moléculas es más intenso que en el gas. Aunque los argumentos necesarios para cuantificar estos efectos están fuera del alcance de este libro.
Ahora bien, la energía cinética promedio por molécula también se modifica. En los líquidos, el empaquetamiento entre las moléculas también da una contribución adicional a la energía total de las mismas. Su energía es, pues, no sólo cinética. Además, en el caso de líquidos formados por moléculas complicadas, éstas pueden realizar movimientos de vibración y rotación que a su vez generan contribuciones a la energía total. Uno de los problemas de actualidad en la teoría de los líquidos simples es encontrar la forma adecuada, tanto de la fuerza interatómica como función de la distancia, como de otros factores característicos de la estructura molecular que den lugar a valores teóricos de la presión y la energía interna de un gas, los cuales sean simultáneamente consistentes con los valores experimentales. Y hablamos aquí de líquidos simples porque este programa todavía no se ha llevado a cabo completamente para líquidos como el nitrógeno, el argón, etc. Para otros, como el agua, el benceno, el tetracloruro de carbono, esto es, líquidos más complejos, el problema es bastante más complicado.
Ahora que ya tenemos una idea cualitativa de la diferencia por medio de la cual podemos visualizar a un líquido y a un gas desde el punto de vista molecular, intentemos comprender cómo es que se puede cambiar de una fase a la otra y viceversa. Empecemos por considerar dos líquidos, por ejemplo, agua y éter; los cuales se colocan en sendos recipientes que están en contacto con el aire de la atmósfera. En cada uno de estos líquidos las moléculas se mueven con velocidades diferentes, en todas direcciones y a mayores velocidades unas que otras. En un instante dado, aquéllas con velocidad suficiente para sobreponerse a las fuerzas atractivas que ejercen sobre ellas las moléculas vecinas y que están suficientemente cerca de la superficie pueden escapar a la atmósfera. En el caso del éter eso es precisamente el mecanismo que nos permite percibir su aroma. Esta pérdida de moléculas más rápidas produce eventualmente que el líquido se evapore; como las moléculas más lentas son las que van quedando rezagadas en el líquido, la evaporación hace que éste se enfríe. Además, en nuestro ejemplo el éter se evapora con mayor prontitud, puesto que las fuerzas intermoleculares atractivas entre las moléculas del éter son más débiles que las correspondientes del agua; de aquí que puedan escapar en mayor número (Nuevamente: Figura 13).
Imagine el lector ahora que repetimos el mismo experimento, pero manteniendo al agua y al éter en recipientes herméticamente cerrados. Más aún, podríamos pensar que antes de cerrar dichos recipientes removemos el aire que queda sobre la superficie del líquido. Por supuesto, no podremos removerlo del todo, pero supongamos que lo hemos hecho con la eficiencia suficiente como para que las pocas moléculas de aire que ahí queden no interfieran sustancialmente con el proceso que deseamos examinar.
Va a ocurrir de nuevo lo que relatamos en el párrafo anterior, excepto porque ahora las moléculas de cada uno de los líquidos no pueden escapar: chocarán entre sí y con las paredes del recipiente y, eventualmente, algunas de ellas empezarán a regresar al líquido. En consecuencia, éste no se enfriará y el proceso continuará hasta que se alcance el punto en que el número de moléculas que salgan del líquido por unidad de tiempo y unidad de superficie sea igual al número que retorne. A la temperatura a la que ese equilibrio se alcance y obviamente el líquido ya no se enfría, decimos que está en equilibrio con "su vapor". Aquí el vocablo vapor se usa como un sinónimo de gas, derivado de la falsa idea de que vapor es un gas que condensa, esto es, que se convierte en líquido. En estas condiciones las moléculas de la sustancia que se encuentran sobre la superficie del líquido forman un gas que ejerce una presión sobre ella. Esta presión dependerá claramente de la temperatura. A la temperatura a la cual la rapidez de evaporación del líquido es igual a la rapidez de condensación del gas, la presión que éste ejerce sobre el líquido se conoce como la presión de vapor. Como podrá apreciar el lector, esta presión es una medida de la facilidad con que pueden escapar las moléculas del líquido a través de su superficie. De aquí que podamos decir que la presión de vapor del éter es mayor que la presión de vapor del agua.
Vamos ahora a repetir el experimento un poco a la manera cotidiana de un ama de casa cuando pone agua a hervir en una cacerola abierta. Sólo que nosotros quitaremos la tapa de nuestros recipientes y calentaremos lentamente los líquidos. ¿Qué ocurre? Si pensamos que en el líquido todavía una fracción de la energía media de una molécula es energía de traslación proporcional a la temperatura, al calentar los líquidos la energía suministrada por la parrilla o el mechero con que estemos calentando va a aumentar la energía cinética promedio de las moléculas facilitando su escape a través de la superficie. Esto no nos es desconocido; el calor ayuda a la evaporación. Es más, llegará un momento en que comencemos a ver como el gas forma una nubecilla blanca sobre el líquido, lo que usualmente líamamos vapor. Si dejamos de calentar ambos líquidos a intervalos de tiempo sucesivos, tapamos los recipientes y medimos la presión, observaremos que ésta aumenta rápidamente con la temperatura. Y lo que todos sabemos, llegará un momento, caracterizado por una temperatura que es diferente para cada líquido, en que todas las moléculas del líquido parecen tener suficiente energía para evaporarse. Este momento se manifiesta por la aparición de burbujas en todo el seno del líquido. En estas condiciones la presión del vapor es igual a la presión atmosférica del lugar, en que estamos; decimos entonces que el líquido hierve. Este es el fenómeno conocido como ebullición. A la temperatura a la que ocurre la ebullición las partículas del líquido tienen en promedio la suficiente energía como para contrarrestar las fuerzas atractivas y sobreponerse a la presión que ejerce la atmósfera, el aire, sobre la superficie del líquido. En el caso del agua, a nivel del mar, donde la presión es de una atmósfera 760 mm de Hg, ésta hierve a 100°C. En la ciudad de México, donde la presión es de sólo 586 mm de Hg, hierve a 96°C. Por lo tanto, el punto de ebullición de un líquido está definido como la temperatura a la cual su presión de vapor es igual a la presión atmosférica local (Figura 14).
Figura 14. Ebullición. El calor suministrado por la combustión del gas en el mechero permite a un líquido hervir cuando la presión de vapor ejercida por el vapor es igual a la presión atmosférica. La temperatura del líquido y del vapor es la misma, T.
Obsérvese también que, independientemente de que la ebullición ocurra en un recipiente de manera espontánea o con la ayuda de una fuente de calor; la formación de vapor de un líquido requiere de una cierta energía. En el primer caso la energía la suple el propio líquido, pues éste se enfría al perder las moléculas más energéticas. En el otro, la energía la suministra la corriente eléctrica que usamos para la parrilla o el combustible (gas doméstico) que quemamos en el mechero. Así, para evaporar 1 kg de agua líquida requerimos de 540 kilocalorías (kcal) a 100°C y de 1 atm de presión, o sea en el punto de ebullición. En este caso, la temperatura de ambos, líquido y gas, es la misma; esto nos lleva a preguntarnos: ¿cuál es el uso de esa energía? Como la temperatura es la misma, la energía cinética media también es la misma para todas las moléculas, estén en la fase líquida o en la gaseosa. De aquí que la respuesta sea obvia: la energía se consume en separar a las moléculas unas de otras en el líquido. Ahí están fuertemente ligadas por las fuerzas intermoleculares atractivas, y sus distancias de separación son pequeñas. Como vimos en la figura 12, si la distancia entre dos moléculas es la distancia denotada por rmen la figura, es necesario para separarlas gastar una energía que depende de la profundidad de la parte atractiva de la fuerza denotada por Fo en dicha figura. Cuando el gas se condensa, las moléculas que penetran al seno del líquido son "capturadas" por otras a través de la acción de estas fuerzas atractivas. Al hacerlo pierden energía que se transmite en forma de calor a los alrededores
La diferencia fundamental entre un sólido cristalino y un líquido es que en el primero existe el "orden de largo alcance". Esto quiere decir que las fuerzas intermoleculares son mucho más intensas en el sólido que en el líquido, al grado de que las partículas en aquél ya no tienen libertad alguna de moverse. Como encontró von Laue en sus experimentos de 1912, forman un patrón geométrico regular; por lo menos en los que forman cristales. En los que así lo hacen, las partículas están dispuestas a lo largo de líneas y de planos igualmente espaciados entre sí. Una partícula en el cristal está a la misma distancia que sus vecinos más cercanos (Figuras 15 y 16). Por eso es que a simple vista las caras de un cristal son lisas y sus ángulos son agudos. Pero, ¿están en reposo los átomos en el cristal? No. El lector puede imaginar que, en cada sitio de la red cristalina ocupado por un átomo éste vibra incesantemente en tres direcciones mutuamente perpendiculares entre sí, como si fuera jalado por otros tantos resortes fijos en los átomos vecinos. Este movimiento está provocado por la resultante de todas las fuerzas que el resto de los átomos del cristal ejercen sobre el átomo que estamos examinando. Así pues, en un sólido cristalino los únicos movimientos que pueden ejecutar los átomos que lo componen son movimientos de vibración. En esta fase de la materia no hay colisiones entre las partículas, de manera que los argumentos básicos de la teoría cinética que hemos empleado con tanto éxito en el caso de líquidos y gases no tienen mucha relevancia para describir a los sólidos. En ellos la característica esencial para comprender sus propiedades más relevantes en términos de su composición atómica es, precisamente, las simetrías inherentes a sus formas geométricas.
Figura 15 A: En un líquido las moleculas que oscilan entre sus vecinos pueden escapar de la jaula de sus vecinos más cercanos para ser atrapadas en otra jaula.
Figura 15 B: En un sólido las móleculas o átomos vibran u oscilan alrededor de sus posiciones de equilibrio sin llegar a chocar entre sí. ...
Sin embargo, conviene mencionar que no todos los sólidos en la naturaleza forman cristales en la forma que lo hemos descrito. De hecho, independientemente de que los sólidos exhiban caras cristalinas, como la sal de cocina, el cuarzo, el diamante y otros, el análisis por rayos X muestra que su estructura interna exhibe un patrón regular. A todos lo sólidos que muestran estra estructura con independencia de que su aspecto externo sea o no de un cristal, se les llama sólidos cristalinos. Tal es el caso de los ya citados arriba y de la mayor parte de los metales. Pero existen materiales que presentan el aspecto de un sólido y que sin embargo su estructura es un tanto irregular. A éstos se les conoce como sólidos amorfos. Ejemplos típicos son el hule, el plástico, el vidrio, etcétera.
A pesar de que en el sólido la teoría cinética no tiene tanta relevancia como en las fases fluidas, líquida y gaseosa, todavía nos permite entender cualitativamente la transformación molecular que tiene lugar en el fenómeno de la fusión. Todos sabemos que para fundir un sólido, sea hielo o cualquier otro, hay que suministrarle energía, por lo general, en forma de calor. ¿En qué se utiliza esta energía? La respuesta es un tanto obvia si el lector recuerda que la diferencia entre un sólido y un líquido radica en que, en el primero, las fuerzas intermoleculares atractivas generan, debido a su naturaleza, un orden de largo alcance manifiesto en la estructura geométrica regular del sólido, mientras que en el segundo, esta regularidad sólo se conserva entre los vecinos más cercanos, por lo que le hemos llamado de corto alcance. Así pues, a medida que calentamos el sólido, la energía suministrada se emplea en aumentar las amplitudes de las vibraciones de los átomos alrededor de sus posiciones de equilibrio. Cuando esta energía es suficiente, algunos de ellos rompen, por decir así, sus ligaduras y empiezan a crear un desorden local en la látiz cristalina. Cuando este desorden se propaga más allá de unos cuantos diámetros moleculares y sólo se conserva el orden "de corto alcance", el sólido se convierte en un líquido (ver Figura 15(b)). Parte de la energía potencial almacenada en los átomos en la fase sólida empieza a transformarse en energía cinética traslacional, característica de la fase líquida. La cantidad de energía por kilogramo-mol de sólido necesaria para llevar a cabo esta transición se conoce como calor de fusión. Para el agua es de 80 kcal por kg-mol. Es claro que ésta es la energía que un líquido transfiere a sus alrededores cuando se solidifica.
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/36/htm/sec_9.html
La teoría cinética de los gases es una teoría física y química que explica el comportamiento y propiedades macroscópicas de los gases (ley de los gases ideales), a partir de una descripción estadística de los procesos moleculares microscópicos. La teoría cinética se desarrolló con base en los estudios de físicos como Daniel Bernoulli en el siglo XVIII, Ludwig Boltzmann y James Clerk Maxwell a finales del siglo XIX.
Esta rama de la física describe las propiedades térmicas de los gases. Estos sistemas contienen números enormes de átomos o moléculas, y la única forma razonable de comprender sus propiedades térmicas con base en la mecánica molecular, es encontrar determinadas cantidades dinámicas de tipo promedio y relacionar las propiedades físicas observadas del sistema con estas propiedades dinámicas moleculares en promedio. Las técnicas para relacionar el comportamiento macroscópico global de los sistemas materiales con el comportamiento promedio de sus componentes moleculares constituyen la mecánica estadística.

No hay comentarios:
Publicar un comentario