Autofagia
La autofagia es un proceso catabólico altamente conservado en eucariotas, en el cual el citoplasma, incluyendo el exceso de orgánulos o aquellos deteriorados o aberrantes, son secuestrados en vesículas de doble membrana y liberados dentro del lisosoma/vacuola para su descomposición y eventual reciclado de las macromoléculas resultantes. Este proceso juega un papel esencial en la adaptación al ayuno y a las condiciones ambientales cambiantes, a la remodelación celular durante el desarrollo y acumulación de orgánulos alterados hipergeneradores de especies reactivas de oxígeno (ROS) en las células en envejecimiento.1 Durante la autofagia se forman, como se ha dicho, vesículas de doble membrana llamadas autofagosomas que capturan material citoplasmático y lo transportan hasta los compartimentos acídicos (vacuola en el caso de levaduras o lisosomas en el caso de células de mamífero), donde son degradados por enzimas hidrolíticas. Una vez que los autofagosomas se ha fusionado con los lisosomas, las vesículas resultantes (ya de membrana simple) pasan a denominarse autolisosomas. En mamíferos, la autofagia es un evento constitutivo que regula crecimiento celular, desarrollo y homeostasis. Mientras que en levaduras, la autofagía es inducida bajo condiciones de estrés celular, tales como falta de nutrientes, incremento de temperatura o estrés oxidativo. Los estudios más recientes apuntan que la autafagia, además de constituir un proceso reparativo, está implicado en fenómenos de muerte celular. Estos fenómenos han sido denominados "procesos de muerte tipo II" (no apoptótica).
Autofagia se ha relacionado con proliferación, diferenciación, respuesta inmune contra patógenos, cáncer, apoptosis y recientemente se ha propuesto como una herramienta que permite a la célula obtener energía, ácidos grasos y aminoácidos permitiendo su supervivencia en condiciones adversas. Un mecanismo de autofagia deficiente es también causante de distintas enfermedades neurodegenerativas.
En levaduras, los genes que participan en la autofagia son denominados Atg(1-16) y la mayoría de ellos cuenta con sus respectivosgenes ortologos en células de plantas, mamíferos y protistas. Los autofagosomas en levaduras tienen un diámetro de 300 a 900 nm, mientras que en células de mamífero son mayores (1000 a 1500 nm).
La biogénesis de estas vesículas es regulada por dos sistemas denominados UBL (ubiquitin like systems). El primer sistema conjuga Atg5 con Atg12, formando el complejo Atg5-Atg12. El segundo conjuga a Atg8 con fosfatidiletanolamina, esta modificación permite que una proteína citosolica como Atg8 se una a la membrana de los autofagosomas hasta que estos son degradados, haciendo de Atg8 el marcador autofagosomal por excelencia. La fosfolipidacion de Atg8 es regularmente monitoreada por Western blot utilizando geles de poliacrilamida suplementados con 6M de urea, en los cuales se puede diferenciar perfectamente la proteína de membrana de la citosolica.
La autofagia es un proceso celular que se encarga de la degradación y reciclaje de componentes celulares. Durante la autofagia, porciones del citosol, incluyendo orgánulos completos, son englobadas en una doble membrana que se cierra para formar un autofagosoma o vacuola de autofagia, que se fusionará permitien la digestión de los componentes englobados. La autofagia tiene un papel esencial en la obtención de nutrientes en condiciones de ayuno, en la degradación de orgánulos dañados, por lo que supone un mecanismo que permite a las células sobrevivir en condiciones de estrés.
Sin embargo también y se ha sugerido que es un modo alternativo de muerte celular programada que se ha observado tanto durante el desarrollo así como durante las enfermedades neurodegenerativas. Nuestro grupo está estudiando los mecanismos moleculares de la autofagia durante el desarrollo del sistema nervioso y los procesos neurodegenerativos para determinar en qué situaciones la autofagia supone un mecanismo citoprotector o si alternativamente también puede ser un mecanismo de muerte celular programada.
Nuestros resultados indican que la autofagia es esencial para la eliminación de las células apoptóticas durante la muerte celular asociada al desarrollo del sistema nervioso. El bloqueo de este proceso disminuye los niveles de ATP necesarios para la exposición de fosfatidilserina, molecula que esencial para el reconocimiento de la célula apoptótica y eliminación por fagocitosis.

Sorprendentemente este requerimiento para la eliminación de las celulas apoptóticas no parece ser universal y en otras fases de muerte celular como la muerte asociada a la salida del nervio óptico (muerte morfogenética) o la muerte neuronal asociada a la falta de factores tróficos (muerte neurotrófica) la inhibición de la autofagia no tiene ese efecto. En estos momentos estamos caracterizando el fenotipo en desarrollo de algunos modelos murinos deficientes en autofagia.
Sin embargo también y se ha sugerido que es un modo alternativo de muerte celular programada que se ha observado tanto durante el desarrollo así como durante las enfermedades neurodegenerativas. Nuestro grupo está estudiando los mecanismos moleculares de la autofagia durante el desarrollo del sistema nervioso y los procesos neurodegenerativos para determinar en qué situaciones la autofagia supone un mecanismo citoprotector o si alternativamente también puede ser un mecanismo de muerte celular programada.
Nuestros resultados indican que la autofagia es esencial para la eliminación de las células apoptóticas durante la muerte celular asociada al desarrollo del sistema nervioso. El bloqueo de este proceso disminuye los niveles de ATP necesarios para la exposición de fosfatidilserina, molecula que esencial para el reconocimiento de la célula apoptótica y eliminación por fagocitosis.
Sorprendentemente este requerimiento para la eliminación de las celulas apoptóticas no parece ser universal y en otras fases de muerte celular como la muerte asociada a la salida del nervio óptico (muerte morfogenética) o la muerte neuronal asociada a la falta de factores tróficos (muerte neurotrófica) la inhibición de la autofagia no tiene ese efecto. En estos momentos estamos caracterizando el fenotipo en desarrollo de algunos modelos murinos deficientes en autofagia.
La Autofagia es un mecanismo que la célula dispara, mediante el cual se forman vesículas autofágicas que van digiriendo partes de la célula, desde agregados proteicos hasta orgánulos dañados. Este proceso adquirió un papel fundamental en la investigación de los procesos de muerte celular hace una década ya que su disparo y características morfológicas hicieron que se catalogase como Muerte Celular Programada tipo II, ya que las células realmente entraban en procesos de autofagia generalizada en puntos cruciales del desarrollo o deterioro del individuo. En fechas posteriores se vio que los procesos definidos como autofágicos eran mucho más complejos. La célula dispara autofagia inicialmente como mecanismo de supervivencia, en un intento de luchar contra situaciones adversas de muy diversa índole, desde falta de nutrientes a exceso de radicales libres. Sin embargo, si a pesar de estos esfuerzos, la célula no consigue disminuir los marcadores adversos, la autofagia se continúa hasta provocar la muerte y desaparición de la célula sin inducir inflamación subsecuente y este es el proceso que realmente se define como Muerte Celular Programada tipo II.
El estrés oxidativo y los procesos autofágicos coexisten en diversas situaciones patológicas que varían desde procesos infecciosos hasta el envejecimiento pero actualmente aún no se ha podido discriminar si el disparo de estos procesos de supervivencia/muerte celular programada son una causa o una consecuencia del estrés oxidativo que aparece en dichas situaciones.
Por ello, nuestro grupo pretende caracterizar, los cambios que se producen debido a alteraciones del estrés oxidativo no sólo en los procesos de muerte celular programada (autofagia y apoptosis), sino también en la capacidad celular proteolítica en general y como estos pueden verse modificados ante alteraciones del estrés oxidativo imperante.
El estrés oxidativo y los procesos autofágicos coexisten en diversas situaciones patológicas que varían desde procesos infecciosos hasta el envejecimiento pero actualmente aún no se ha podido discriminar si el disparo de estos procesos de supervivencia/muerte celular programada son una causa o una consecuencia del estrés oxidativo que aparece en dichas situaciones.
Por ello, nuestro grupo pretende caracterizar, los cambios que se producen debido a alteraciones del estrés oxidativo no sólo en los procesos de muerte celular programada (autofagia y apoptosis), sino también en la capacidad celular proteolítica en general y como estos pueden verse modificados ante alteraciones del estrés oxidativo imperante.
Axonema
Se llama axonema a la estructura interna axil de los cilios y flagelos de los eucariotasbásicamente microtubular, que constituye el elemento esencial para la movilidad.
La longitud del axonema es de varios micrómetros en los cilios y puede llegar a más de 1 mm en los flagelos. Su diámetro es de 0,2 mm. El axonema está rodeado por la membrana ciliar externa, que es una dependencia de la membrana plasmática. Todos los componentes del axonema se encuentran en la matriz ciliar.
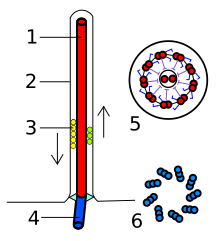
La estructura del axonema es de 9 pares de microtúbulos periféricos y 1 par central (9+2). Los dos microtúbulos de cada par periférico se disponen en forma algo oblicua, de modo que uno de los microtúbulos (A) se encuentra más próximo al centro del axonema que el otro (B). El microtúbulo A es pequeño, pero completo, mientras que el microtúbulo B es más grande, pero incompleto, ya que le faltan 3 protofilamentos en su pared, que comparte con A. El microtúbulo A tiene 13 protofilamentos, el B tiene solo 10.
El microtúbulo A presenta brazos de dineína, orientados en la misma dirección, dispuestos en sentido horario. La dineína es un complejo de 10 cadenas polipeptídicas, que pueden variar en diferentes tipos celulares, y que está formado por una cabeza globular doble o triple, que puede unirse de manera ATP-dependiente con la superficie del microtúbulo B del par vecino, y un tallo más delgado unido permanentemente al microtúbulo A al que pertenece. La dineína es una proteína fundamental en el movimiento ciliar.
La nexina conecta entre sí a los pares periféricos de microtúbulos. Las conexiones radiales son puentes que conectan al microtúbulo A de cada par periférico con una vaina proteica que rodea a los microtúbulos centrales. Estos puentes terminan en una cabeza o protuberancia.
El movimiento de un cilio o un flagelo es dependiente de ATP.
Estructura molecular de los cilios
Los cilios son prolongaciones del citoplasma apical de 8 mm de longitud y 0.25 mm de diámetro, que contiene un eje de microtúbulos llamado axonema.
|
|
En cada axonema hay un par central de microtúbulos y nueve pares periféricos. Esta disposición 9+2 es característica de los cilios. Mientras que cada microtúbulo del par central es un microtúbulo completo, cada de uno de los dobletes externos se compone de un microtúbulo completo y otro parcial, fusionados de tal manera que comparten parte de su pared (Figuras 1 y 2).
|
Las proteínas que se asocian a los microtúbulos del axonema, se disponen en forma regular a lo largo de los microtúbulos (Figura 3a).
Sus principales funciones son:
- mantener unidos a los microtúbulos que forman el axonema
- generar la fuerza que permite el movimiento de inclinación del cilio
- regular la interacción de los componentes del axonema para producir un cambio coordinado en la forma del cilio.
La más importante de estas proteínas accesorias es la dineína ciliar, proteína con actividad ATPásica, cuyos brazos laterales se extienden entre los pares de microtúbulos que forman los dobletes externos (Fig 3).
Esta proteína es responsable de generar la fuerza de deslizamiento entre los dobletes que permite la inclinación de los cilios .


No hay comentarios:
Publicar un comentario