Los inhibidores de la tirosina quinasa Bcr-Abl ( TKI, por sus siglas en inglés) son la terapia de primera líneapara la mayoría de los pacientes con leucemia mielógena crónica (LMC). Más del 90% de los casos de CML son causados por una anomalía cromosómica que resulta en la formación del llamado cromosoma Filadelfia . Esta anormalidad fue descubierta por Peter Nowell en 1960 [1] y es una consecuencia de la fusión entre el gen de la tirosina quinasa Abelson ( Abl ) en el cromosoma 9 y el gen del grupo de punto de ruptura ( Bcr ) en el cromosoma 22 , lo que resulta en un oncogén quimérico ( Bcr -Ab) y una tirosina quinasa Bcr-Abl constitutivamente activa que se ha implicado en la patogénesis de la CML. Se han desarrollado compuestos para inhibir selectivamente la tirosina quinasa.
Antes de la aprobación de imatinib por parte de la Administración de Drogas y Alimentos de los Estados Unidos(FDA) en 2001 , no había medicamentos disponibles para alterar la progresión natural de la CML. Sólo se utilizaron fármacos citotóxicos como busulfan , hidroxiurea o interferón -alfa (rIFN-α). A pesar de que el primer inhibidor de Bcr-Abl TK fue nombrado "la bala mágica" para curar el cáncer en la revista TIME , posteriormente se desarrolló una segunda generación de Bcr-Abl TKI para combatir la resistencia inicial que surgió. [2]
Las nuevas formas de resistencia pueden surgir como: mutaciones sin sentido dentro del dominio quinasa Abl , sobreexpresión de Bcr-Abl, aumento de la producción de proteínas plasmáticas transmembrana o activación constitutiva de moléculas de señalización corriente abajo, como las quinasas de la familia Src .
Historia [ editar ]
La CML tiene un objetivo molecular bien definido y terapias relativamente selectivas dirigidas a ese objetivo, lo cual no es el caso de la mayoría de los cánceres y las quimioterapias actuales. [3] Bcr-Abl fue considerado como un objetivo altamente atractivo para la intervención farmacológica ya que el gen de fusión Bcr-Abl codifica una quinasa activada constitutivamente. El descubrimiento de fármacos que se dirigía específicamente al sitio de unión de ATP de una quinasa única se consideraba una tarea bastante difícil ya que se conocían cientos de proteínas quinasas en el genoma humano . [4] En presencia de TKI se bloquea la unión de ATP, fosforilaciónse evita y las células que expresan Bcr-Abl tienen una desventaja de crecimiento selectiva o sufren muerte celular apoptótica . [5] [6]
Debido al aumento de la resistencia y la intolerancia a los esfuerzos de imatinib, se desarrollaron nuevos fármacos que podrían inhibir la tirosina quinasa Bcr-Abl. Esto llevó al descubrimiento de medicamentos de segunda generación. Mientras que la detección de drogas se usó para desarrollar imatinib, los TKI de segunda generación se desarrollaron con un enfoque de diseño racional de medicamentos debido a un mayor conocimiento en biología estructural de la tirosina quinasa Bcr-Abl. [7]
Primera generación [ editar ]
Imatinib (STI571) [ editar ]
Imatinib (Gleevec) se descubrió en 1992 [8] y se considera un fármaco de primera generación ya que es el primer inhibidor de la tirosina quinasa Bcr-Abl que se utiliza en el tratamiento de la CML.
Desarrollo [ editar ]
En el desarrollo de imatinib, la estructura de la tirosina quinasa Bcr-Abl jugó un papel limitado porque no se conocía. [7]Se realizó una selecciónde alto rendimiento de bibliotecas químicas en Novartis para identificar una molécula de partida, que se llamó pirimidina A. Este compuesto sirvió como compuesto de plomo y luego se probó y modificó para desarrollar imatinib. [9] Con la sustitución del grupo imidazol con un grupo benzamido, la especificidad del compuesto aumentó mientras que su actividad como inhibidor de la quinasa siguió siendo la misma. Posteriormente, la introducción de un orto subtituyente metilo.al grupo pirimidinil-amino potenciaba la potencia . [4]
Encuadernación [ editar ]
Desde entonces, los estudios cristalográficoshan revelado que imatinib se une al dominio de quinasa de Abl solo cuando el dominio adopta la conformación inactiva o "cerrada". [10] Aquí es donde el bucle de fosfato de unión a P (P-loop) rico en glicina se pliega sobre el sitio de unión de ATP y el bucle de activación adopta una conformación en la que ocluye el sitio de unión del sustrato y rompe el sitio de unión de fosfato de ATP Para bloquear la actividad catalítica de la enzima. [11] El cambio de la tríada Asp Phe Glyen el extremo N-terminal del bucle de activación da lugar a la exposición de un bolsillo de enlace que puede ser utilizado por los inhibidores.[12]
Imatinib se une al dominio Abl a través de seis interacciones de enlaces de hidrógeno . Esto estabiliza el complejo de imatinib Bcr-Abl y evita que el ATP alcance su sitio de unión. [4] [8] [10] Los enlaces de hidrógeno involucran la piridina -N y el esqueleto -NH de Met -318, la amino pirimidina y la cadena lateral hidroxilo de Thr-315, la amida-NH y el carboxilato de cadena lateral de Glu -286 , el carbonilo y la columna vertebral-NH de Asp-381, el metil protonada piperazina con los átomos de la columna vertebral-carbonilo de Ile-360 y su -361. Además, varias interacciones de van der Waals contribuyen a la unión. [8] Una bolsa hidrófoba está formada por los residuos de aminoácidos Ile-293, Leu -298, Leu-354 y Val -379 alrededor del anillo de fenilo adyacente al grupo piperazinil- metilo de imatinib. [10] En el momento de su descubrimiento, en ausencia de información estructural, no se pudo encontrar una explicación clara para la impresionante selectividad de imatinib. [6]
Aunque el tratamiento de primera generación logró una tasa de respuesta extremadamente alta y una tasa de recaída baja en pacientes con CML, algunos pacientes experimentan resistencia o intolerancia al imatinib. [2]
La resistencia a fármacos [ editar ]
La resistencia a los medicamentos es el principal motor en la investigación y el desarrollo continuos de Bcr-Abl TKI. Poco después de la introducción de imatinib, los investigadores comenzaron a describir una serie de líneas celulares derivadas in vitro con resistencia al fármaco. Esto fue seguido rápidamente por la descripción clínica de las células resistentes a imatinib en los pacientes, lo que ha resultado en esfuerzos para comprender mejor la biología detrás de estas observaciones. Las evaluaciones de la respuesta terapéutica de imatinib en pacientes con CML se basan en el cumplimiento de hitos hematológicos , citogénicos y moleculares . Pacientes que no logran respuestas definidas en cronológico predefinido.los puntos temporales se describen como principalmente resistentes a la terapia, y los que pierden los hitos obtenidos previamente en la regresión de la enfermedad se denominan resistencia secundaria. [3] Antes de que se extrae una conclusión, es importante tener en cuenta que la retrospectiva de datos ha mostrado una alta incidencia de imatinib no cumplimiento en pacientes con LMC y esto podría dar lugar a resultados clínicos deseados. [2]
En general, la resistencia al imatinib se puede subdividir en mecanismos dependientes e independientes de Bcr-Abl. Los mecanismos dependientes de Bcr-Abl incluyen la sobreexpresión o amplificación del gen Bcr-Abl y las mutaciones puntuales dentro del dominio de la quinasa Bcr-Abl que interfieren con la unión de imatinib. Los mecanismos independientes de Bcr-Abl incluyen factores que influyen en la concentración de imatinib dentro de la célula, por ejemplo, por alteraciones en la entrada y salida de fármacos y la activación de vías independientes de Bcr-Abl, como los miembros de la familia de quinasas Src. [2] La resistencia al imatinib también puede producirse por otros mecanismos que no se mencionarán aquí, ya que la importancia de esos mecanismos sigue siendo una cuestión debido a la falta de datos clínicos.
Bcr-Abl mecanismos dependientes de resistencia [ editar ]
Duplicación Bcr-Abl [ editar ]
Los primeros informes de resistencia al imatinib describieron un desarrollo de la amplificación de oncogenes . Es decir, el gen que codifica la tirosina quinasa Bcr-Abl patógena se duplica en la secuencia de ADN , lo que lleva a una mayor expresión del patógeno. [3] El aumento de la dosis de imatinib podría superar este tipo de resistencia, siempre que no se produzcan efectos adversos graves o intolerables . [2]
Bcr-Abl mutación [ editar ]
Las mutaciones puntuales pueden causar sustituciones de aminoácidos dentro del dominio de la quinasa de la proteína Bcr-Abl y alterar el sitio de unión de imatinib en la tirosina quinasa, lo que resulta en una pérdida de sensibilidad al fármaco. Estas mutaciones normalmente afectan la estructura de la proteína Bcr-Abl, lo que lleva a la interrupción de los puntos de contacto críticos entre el fármaco y la proteína Bcr-Abl o la inducción de un cambio conformacional, lo que da como resultado una proteína a la que imatinib no puede unirse. [2]
Las frecuencias mutacionales parecen aumentar a medida que la enfermedad, la CML , progresa desde la fase crónica hasta la fase blástica . Las mutaciones más importantes son las mutaciones del bucle P y la mutación T315I. También se han informado mutaciones en otros sitios de la quinasa, por ejemplo, en la hélice C , el dominio SH2 , el sitio de unión al sustrato, el bucle de activación y el lóbulo C-terminal . Algunas de estas mutaciones tienen importancia clínica, pero ninguna tanto como las mutaciones P-loop y T315I. [3]
Mutación T315I [ editar ]
El T315I es una mutación única debido a su resistencia a todos los inhibidores de Bcr-Abl aprobados, antes del ponatinib . [13] Es causada por la sustitución de un par de bases de citosina a timina (C -> T) en la posición 944 del gen Abl ( codón '315' de la proteína Abl), lo que resulta en la sustitución de aminoácido (T) hreonina por (I) soleucine en esa posición - por lo tanto 'T315I'. Esta sustitución elimina una molécula de oxígeno crítica necesaria para los enlaces de hidrógeno entre imatinib y la quinasa Abl, y también crea un impedimento estéricopara la unión de la mayoría de los TKI.[3] Cuando se descubrió, se estimó que cada 6 de 9 casos de LMC en estadio avanzado con resistencia a imatinib presentaban esta mutación. [14] T315I produce la mayor magnitud de resistencia de cualquier mutación tanto para imatinib como para los TKI de segunda generación. [2] Ponatinib(Iclusig) de Ariad fue aprobado en 2013 para su uso como tratamiento de segunda línea de la LMC, y es el único TKI con licencia que se une con éxito a la quinasa mutada T315I.
Mutaciones del bucle P [ editar ]
La estructura de Bcr-Abl contiene dos bucles flexibles, el bucle P de unión a ATP y el bucle de activación. Estos bucles tienen disposiciones específicas en la conformación inactiva de Bcr-Abl que estabilizan la conformación basal. Las mutaciones en estos bucles desestabilizan la disposición de los bucles de modo que el dominio de la quinasa no puede asumir la conformación inactiva requerida para la unión a imatinib. Las mutaciones en la región del bucle P son las más comunes, y representan el 36-48% de todas las mutaciones. Hay datos clínicos que indican que las mutaciones de Bcr-Abl en el bucle P son 70-100 veces menos sensibles a imatinib en comparación con Bcr-Abl nativo. [2]
Bcr-Abl Mecanismos independientes de resistencia [ editar ]
Se han postulado mecanismos adicionales para describir la resistencia vista en varios sistemas modelo, aunque ninguno ha sido identificado claramente como una fuente única de resistencia clínica. [3]
Eflujo de drogas causado por las glicoproteínas P [ editar ]
Algunas investigaciones en líneas celulares han demostrado que la resistencia a imatinib puede deberse en parte a un aumento en la expresión de la bomba de salida de glicoproteína P. Mediante la utilización de agentes que inhiben la actividad de la P-glicoproteína, la susceptibilidad al imatinib se ha restablecido en algunos casos. [3]
Importación de drogas por el transportador de cationes orgánicos 1 [ editar ]
La entrada de imatinib en las células depende de un transportador de cationes orgánicos ( OCT1 ). La OCT1 desempeña un papel importante en la resistencia al imatinib al inhibir su afluencia y, por lo tanto, disminuir la biodisponibilidad intracelular del imatinib. [15] Los pacientes con baja expresión, actividad o polimorfismos de OCT1 tuvieron niveles intracelulares de imatinib significativamente más bajos. La respuesta de los pacientes con baja actividad de OCT1 fue significativamente dependiente de la dosis. Estos datos indican que la actividad de OCT1 es un determinante importante en la respuesta molecular al imatinib. [2]
Activación de la vía de señalización alternativo [ editar ]
En unos pocos grupos de pacientes, la resistencia puede ser causada por la activación de otras vías de señalización, en particular las quinasas de la familia Src. Las quinasas de la familia Src se han implicado en la señalización de Bcr-Abl y median la resistencia a imatinib mediante la estabilización de la conformación activa de Bcr-Abl, una conformación que no se une a imatinib. Además, cada vez hay más evidencia que sugiere que las quinasas de la familia Src también están involucradas en formas de resistencia a imatinib independientes de Bcr-Abl.
Soluciones [ editar ]
Las opciones de tratamiento para pacientes con CML resistentes o intolerantes a imatinib pueden incluir estrategias como aumentar la dosis de imatinib o el uso de medicamentos de segunda generación. La escalada de dosis de imatinib ha demostrado superar algunos casos de resistencia primaria al imatinib, como la duplicación de Bcr-Abl, pero la respuesta suele ser de acción breve. [2] En el caso de resistencia o intolerancia, podría ser útil probar las mutaciones Bcr-Abl para dirigir la elección del tratamiento de segunda línea, ya que las opciones de la variable tienen un perfil de función diferente frente a los diferentes mecanismos de resistencia. [13]Los medicamentos de segunda generación ofrecen una potencia mejorada y una mayor probabilidad de éxito en pacientes resistentes. [2]También hay un interés creciente en probar la hipótesis de que la administración de múltiples inhibidores de quinasa Abl en pacientes en fase temprana podría usarse para retrasar o prevenir la aparición de clones resistentes a los medicamentos . La combinación de dos agentes dirigidos a diferentes víasinvolucradas en la CML puede mejorar significativamente las tasas de respuesta y potencialmente aumentar la supervivencia. [dieciséis]
Fármacos de segunda generación [ editar ]
Se pretende que los medicamentos de segunda generación tengan una menor resistencia e intolerancia que el imatinib. Los medicamentos de segunda generación que se comercializan actualmente son nilotinib, dasatinib, bosutinib y ponatinib.
Nilotinib (AMN107) [ editar ]
Desarrollo [ editar ]
Nilotinib es un derivado de fenilamino-pirimidina que está relacionado estructuralmente con imatinib. [11] Fue desarrollado en base a la estructura del complejo Abl-imatinib para abordar la necesidad asociada con la intolerancia y la resistencia al imatinib. [12] [16] [17] Se hicieron pequeños cambios en la molécula de imatinib para hacerla más potente y selectiva como inhibidor de Bcr-Abl y estos cambios dieron como resultado el descubrimiento de nilotinib. Nilotinib es un inhibidor selectivo de la quinasa Bcr-Abl. [12] [16]
El nilotinib es 10-30 veces más potente que el imatinib para inhibir la actividad de la tirosina quinasa Bcr-Abl y la proliferación de células que expresan Bcr-Abl. [11] [16] [17] [18] El medicamento inhibe efectivamente la auto fosforilación de Bcr-Abl en Tyr -177 que está involucrada en la patogénesis de la CML. [18] La actividad sinérgicade imatinib y nilotinib se ha informado después de la administración conjunta. Esto podría ser el resultado del hecho de que los fármacos son absorbidos por las células por diferentes mecanismos: el influjo de imatinib depende de la OCT1, pero el nilotinib no. El nilotinib tampoco es un sustrato para la bomba de glucoproteína P del transportador de flujo de salida, a diferencia del imatinib. [16] [18]Aunque las estructuras moleculares bidimensionales de estos dos fármacos pueden parecer similares, son diferentes en términos de estructura espacial y propiedades moleculares. [12]
Encuadernación [ editar ]
Nilotinib se une a la conformación inactiva del dominio quinasa Abl, en gran parte a través de interacciones lipofílicas y, por lo tanto, bloquea su actividad catalítica. [11] [16] El nilotinib se une al dominio quinasa al hacer cuatro interacciones de enlace de hidrógeno que involucran el piridil- N y el esqueleto NH de Met-318, el anilino -NH y la cadena lateral OH de Thr-315, el amido-NH y carboxilato de cadena lateral de Glu-286 y el amido carbonilo con el esqueleto NH del Asp-381. [12] [18]El segmento [4- (3-piridinil) -2-pirimidinil] anilino de nilotinib tiene interacciones de unión cercanas con los residuos Met-318, Phe-317 y Thr-315 de una región dentro del sitio de unión de ATP. La mitad restante del compuesto se extiende más allá del residuo del controlador de acceso Thr-315 para atar dentro de un bolsillo adicional. Los grupos 3-metilimidazol y trifluoro-metilo de nilotinib hacen interacciones importantes con el dominio quinasa Abl. Estos grupos también hacen que la forma de nilotinib sea muy diferente de la de imatinib. Nilotinib también se une a la quinasa a través de un gran número de interacciones débiles de van der Waals. [12]
Resistencia [ editar ]
Nilotinib ha mostrado un efecto contra la mayoría de las mutaciones (32/33) que están asociadas con la resistencia a imatinib, pero el mutante T315I sigue siendo resistente al nilotinib. [11] [12] [16] Su ineficacia contra el mutante T315I parece ser una consecuencia de la pérdida de una interacción del enlace H entre treonina-O y anilina-NH en nilotinib y un choque estérico entre el grupo isoleucina-metilo y Grupo 2-metilfenilfenilo de nilotinib. [11] Por otro lado, la resistencia al nilotinib está asociada con un espectro limitado de mutaciones de la quinasa Bcr-Abl que afectan principalmente al bucle P y T315I. Sin embargo, todas las mutaciones, excepto T315I, fueron suprimidas efectivamente al aumentar la concentración de nilotinib. [dieciséis]Aunque el nilotinib es más potente que el imatinib, es posible que su modo específico de unión a Abl pueda hacer que otros sitios sean vulnerables a nuevos tipos de resistencia a los medicamentos. [17]
Dasatinib (BMS-354825) [ editar ]
Desarrollo [ editar ]
Dasatinib es una tiazolilaminopirimidina desarrollada como la sal de hidrocloruro . Se descubrió con un programa dirigido a fármacos inmunosupresores y es 325 veces más potente contra las células que expresan Bcr-Abl de tipo salvaje que el imatinib. [11] [17] Dasatinib es un inhibidor de múltiples objetivos de las quinasas de la familia Bcr-Abl y Src. [11] [17] También tiene actividad inhibitoria contra otras quinasas en el sentido descendente. [17] [19]
Encuadernación [ editar ]
Dasatinib se une a Abl con requisitos conformacionales menos estrictos que el imatinib, por lo que exhibe una potencia incrementada pero una selectividad reducida en comparación con el imatinib. [17] Dasatinib se une tanto a la conformación activa como a la inactiva de la quinasa Abl, contrariamente a la unión de la mayoría de los otros TKI a la forma activa solamente. [21] Se han identificado compuestos que se dirigen a la conformación activa, pero el sitio de unión en todos los cientos de proteínas quinasas humanas es muy similar. Por lo tanto, hay un margen considerablemente mayor para las diferencias entre las conformaciones inactivas, por lo que los esfuerzos para descubrir inhibidores de quinasa altamente selectivos se dirigen hacia moléculas que se unen a la conformación inactiva. [11]
Dasatinib tiene algunos elementos estructurales en común con nilotinib, en particular la yuxtaposición de los grupos aminopirimidina y carboxamida . El aminotiazol segmento de dasatinib realiza una interacción H-unión bi-dentado con el CO columna vertebral y NH de Met-318 y la amida-NH hace un enlace de H con el oxígeno de la cadena lateral de Thr-315. [11]
Resistencia [ editar ]
Dado que dasatinib es un inhibidor de las quinasas de la familia Src, puede vencer la resistencia debido a la activación de la quinasa de la familia Src. Debido a que no se une a Bcr-Abl con los mismos requisitos conformacionales estrictos que imatinib, puede inhibir todos los mutantes del dominio quinasa Bcr-Abl, excepto T315I. Dasatinib tampoco es un sustrato de las bombas de eflujo de glicoproteína P multidroga como el imatinib. Debido a esto, el dasatinib puede estar activo en algunos pacientes después del fracaso tanto con imatinib como con nilotinib. [17] Aunque dasatinib es mucho más potente que el imatinib, es posible, como con nilotinib, que su modo específico de unión a Abl pueda llevar a nuevos sitios vulnerables que podrían conferir nuevos tipos de resistencia a los medicamentos. Se han encontrado mutaciones en Phe317, por lo que es un sitio potencialmente vulnerable para este medicamento. [17]
Bosutinib (SKI-606) [ editar ]
Desarrollo [ editar ]
La estructura de Bosutinib se basa en un andamio de quinolina y está relacionada estructuralmente con la plantilla de quinazolina AstraZeneca . [11] El examen de levadura dependiente de quinasa Src condujo a la caracterización de un carbonitrilo de 4-anilino-3-quinolina como un inhibidor de Src. La combinación de las características de este golpe y un compuesto relacionado, y la unión de grupos solubilizantes , llevaron al descubrimiento de bosutinib. Se sugirió que era un inhibidor de quinasa Abl y cuando se probó como tal, resultó ser ligeramente más potente contra Abl que Src ( IC50 1,4 nM frente a 3,5 nM ). [22]La actividad de bosutinib se describió por primera vez en 2001 y se describió como un inhibidor de la quinasa Abl en 2003. Al principio se creía que el bosutinib era un inhibidor selectivo de la quinasa Src, pero ahora se sabe que su perfil de inhibición de la quinasa es mucho menos restringido de lo que se pensaba originalmente. Bosutinib inhibe Src, Abl y una amplia gama de quinasas tanto de tirosina como de serina-treonina. [22]
Resistencia [ editar ]
Bosutinib inhibió las células que expresaban una variedad de mutaciones, algunas de las cuales llevaron a la resistencia a imatinib, pero la mutación T315 fue completamente resistente a bosutinib. [11] [22] A diferencia de imatinib, nilotinib y dasatinib, el bosutinib no es un sustrato eficaz para los transportadores de resistencia a múltiples fármacos (MDR) que promueve el flujo de moléculas extrañas de las células. Bosutinib incluso inhibe estas proteínas transportadoras en concentraciones más altas. [22]
Ponatinib (AP24534) [ editar ]
ARIAD Pharmaceuticals , Inc. anunció el 10 de septiembre de 2010 que ponatinib , un BK -Abl TKI activo por vía oral eficaz contra la mutación T315I, había sido aprobado para un ensayo clínico de fase II. [23]
El camino hacia el descubrimiento puede vincularse a AP23464, uno de los primeros inhibidores de Src / Abl duales competitivos ATP de Ariad. AP23464 se identificó mediante el diseño de fármacos de estructura básica y bibliotecas sintéticas enfocadas de análogos de purina trisustituidos . La sustancia inhibe potentemente, en escala nanomolar, las quinasas Src y Bcr-Abl, incluidas muchas mutaciones comunes de Bcr-Abl resistentes al imatinib. AP23464 no inhibe la mutación T315I, sin embargo, mientras que AP24534 (ponatinib) sí lo hace. [24]
Desarrollo [ editar ]
Ariad usó el fármaco altamente potente, AP23464, para investigar más a fondo las posibilidades inhibitorias de las plantillas con núcleo de purina para los inhibidores dobles de Src / Abl. Primero, buscando sustancias efectivas en la conformación inactiva de Abl, la cadena lateral unida al nitrógeno en el núcleo de purina se reemplazó con una estructura de di arilamida , que se sabía que tenía una alta afinidad con la conformación inactiva al formar enlaces de hidrógeno cruciales y Relleno de bolsillos hidrofóbicos en la quinasa. Además, se determinó que el grupo ciclopentilo en el núcleo de purina se enfrentó con un bucle P rico en glicina en esa confirmación y, por lo tanto, se eliminó de la molécula. Luego, con las pruebas in vitro sobre la actividad inhibitoria y los ensayos de absorción oral in vivo, un ciclopropilo más lipófilo, unido a amida.El grupo de C6 en el núcleo de purina mostró una farmacocinética y eficacia satisfactorias. Finalmente, las modificaciones en la cadena lateral de diarilamida agregando apéndices de imidazol se inspiraron en la estructura de nilotinib recién lanzada. Esas modificaciones resultaron en lo que se llamó AP24163. Durante este ciclo de desarrollo, Ariad probó varias sustancias contra células transfectadas con la quinasa Bcr-Abl mutada con T315I y, sorprendentemente, encontró que el AP24163 demostró una acción inhibitoria razonable además de la potente inhibición de la Bcr-Abl nativa. [25]
Siguiendo con ese avance, Ariad comenzó una investigación adicional para aumentar la eficacia del compuesto AP24163 contra la mutación T315I. El acoplamiento de la molécula al sitio de unión a ATP de la quinasa Bcr-Abl mutada en T315I reveló que el choque estérico esperado con isoleucina no estaba presente debido a un enlace vinílico estéricamente menos exigente entre el núcleo de purina y la cadena lateral de diarilamida en comparación con otros TKI. El primer paso fue tratar de encontrar una estructura aún menos exigente estéricamente. Primero se probó un enlace de acetileno , que resultó en una potencia mayor pero una farmacocinética desfavorable. Más tarde, un 2-butino más estable.Se seleccionó el enlace. Para lograr este enlace, se utilizó un núcleo de imidazol [1,2-a] piridina como material de partida para un Sonogashira.reacción; Pero la farmacocinética seguía siendo pobre. Al desarrollar AP24163, la adición de una cadena lateral de ciclopropano en C8 en el núcleo de purina dio como resultado una farmacocinética favorable. Luego se probaron varias cadenas laterales diferentes, pero los mejores resultados se obtuvieron sin ninguna cadena lateral, lo que resultó en una sustancia con una farmacocinética satisfactoria, pero ahora también con una potencia reducida contra T315I. El primer paso para aumentar la potencia nuevamente fue observar otros TKI. Imatinib tiene un grupo terminal de metilpiperazina que se ha demostrado que forma un enlace de hidrógeno con el átomo de oxígeno carbonilo del residuo Ile-360 en el circuito de activación de la quinasa Abl. El anillo de piperazina también es un grupo solubilizante común que podría mejorar aún más las propiedades farmacocinéticas de la molécula.La unión a proteínas plasmáticas de la sustancia (llamada '19a') parece haber disminuido, lo que permite dosis más pequeñas con la misma potencia. Mientras que '19a' mostró una buena farmacocinética oral tanto en ratones como en ratas, también mantuvo un alto coeficiente de partición en 6.69. Por lo tanto, en los intentos de reducir aún más la lipofilicidad de la molécula, se realizó la sustitución de un solo átomo de carbono en el núcleo de imidazo [1,2-a] piridina; que dio lugar a lo que ahora se conoce como el compuesto ponatinib. [26]
Encuadernación [ editar ]
El análisis cristalográfico de rayos X de ponatinib y quinasa mutada Bcr-Abl de T315I muestra que el núcleo de imidazo [1,2b] piridazina descansa en el bolsillo de adenina de la enzima. El grupo metilfenilo ocupa un bolsillo hidrofóbico detrás de I315, el etiniloEl enlace forma interacciones favorables de van der Waals con el aminoácido y el grupo trifluorometilo se une a una bolsa inducida por la quinasa de conformación inactiva. También en la conformación de la quinasa en la que descansa ponatinb, interacciones favorables adicionales de van der Waals entre el fármaco y Tyr-253 y Phe-382. Se generan cinco enlaces de hidrógeno, con el esqueleto de Met-318 en la región bisagra, con el esqueleto de Asp-381, con la cadena lateral de Glu-286 y la metilpiperazina protonada con los átomos de carbonato de esqueleto de Ile-360 y His -361. [27]
Con esta estructura, se ha demostrado que el ponatinib tiene un perfil de especificidad de quinasa relativamente amplio que probablemente se puede vincular a la linealidad de la sección de enlace de la molécula. Con esta estructura lineal, el fármaco parece evitar los choques estéricos con los residuos del controlador de TK hidrófobos. A pesar de, o incluso a causa de esto, el ponatinib es un fármaco potente y ataca no solo a la mayoría de las mutaciones conocidas en el Bcr-Abl TK sino, lo más importante de todo, al T315I. Esta mutación está emergiendo como una vía común para el fracaso de los tratamientos de primera y segunda línea. A diferencia de otros inhibidores de la focalización T315I en desarrollo, el ponatinib no se dirige a las cinasas Aurora, lo que las distingue claramente de ellas y enfatiza la importancia de su descubrimiento. [27]
Bafetinib (INNO-406) [ editar ]
Con la resistencia emergente al tratamiento con imatinib después de su lanzamiento, el tratamiento alternativo fue muy buscado. Bafetinib fue el producto de un intento de crear un fármaco más potente que el imatinib, con eficacia contra varias mutaciones puntuales en la quinasa Bcr-Abl, con menos efectos adversos y con espectros de quinasa más estrechos, a saber, solo Lyn y Bcr-Abl. [28]
Desarrollo [ editar ]
En la búsqueda de una sustancia que se ajuste a los criterios mencionados, se examinó la estructura cristalina del imatinib unido a Abl. Esto reveló una bolsa hidrófoba alrededor del anillo de fenilo adyacente al grupo piperazinilmetilo de imatinib. Los intentos de utilizar este bolsillo para aumentar la eficacia llevaron a la adición de varios grupos hidrófobos que incluyen flúor simple , bromo y clorosustituyentes. Finalmente, se encontró que un grupo trifluorometilo en la posición 3 daba los mejores resultados, con una mejora de aproximadamente 36 veces sobre el imatinib. La adición de un grupo hidrófobo ahora tenía que ser contrarrestada para sostener la solubilidad de la sustancia. Un examen más detenido de la estructura cristalina del complejo imatinib-quinasa reveló que Tyr-236 estaba muy cerca del anillo de piridina de imatinib, lo que sugiere que había poco o ningún espacio para un grupo más grande allí. Con eso en mente un aspecto más hidrófilo.El anillo de pirimidina se sustituyó por la piridina, que se encontró que aumentaba la solubilidad al tiempo que dejaba la eficacia igual o incluso ligeramente mayor. Finalmente, para mejorar el enlace de hidrógeno del anillo de piperazina de imatinib con Ile-360 y His-361, se introdujeron los derivados de pirrolidina y azetidina. La sustancia más prometedora de estas modificaciones finales fue etiquetada NS-187. [10]
Encuadernación [ editar ]
Debido a las similitudes estructurales de imatinib y bafetinib, su unión a Bcr-Abl también es bastante similar. La única diferencia notable proviene de la interacción hidrófoba entre el grupo trifluorometilo y el bolsillo hidrófobo creado por Ile-293, Leu-298, Leu-354 y Val-379. Este grupo también se puede vincular a la especificidad de bafetinib para Lyn, ya que el sitio de enlace es casi idéntico al de Bcr-Abl. [29]
Bafetinib tiene su lugar en la terapia TKI ya que es eficaz contra la mayoría de las mutaciones resistentes a imatinib (sin incluir T315I) y algunas mutaciones resistentes a dasatinib. Bafetinib también tiene más afinidad por Bcr-Abl que nilotinib (pero menos que dasatinib), pero solo se enfoca en las quinasas Lck y Lyn de las familias Bcr-Abl y Src; con una especificidad inigualable que sugiere la probabilidad de menos efectos adversos. [30]
CytRx tiene bafetinb en un ensayo clínico de fase II como tratamiento para la leucemia a partir de mayo de 2010. [31]
1,3,4 derivados de tiadiazol - Sustancia 14 [ editar ]
Se ha mostrado cierto interés por los derivados de tiazol y tiadiazol y su capacidad para inhibir los BCR-Abl TK.
Desarrollo [ editar ]
Un grupo de investigación italiano descubrió a través de la detección digital que los derivados de tiadiazol disponibles comercialmente mostraban una acción inhibitoria moderada en las quinasas Abl y Src. [32] Utilizando un núcleo de 1,3,4 tiadiazol y probando diferentes grupos o moléculas en los anillos de benceno, se produjeron varias sustancias diferentes con propiedades inhibitorias. La flexibilidad del núcleo permitió que varias conformaciones de las sustancias se unieran al sitio ATP de la quinasa Abl, aunque todas ellas se unieron a la forma activa de la quinasa. [32]Un estudio adicional de la unión mostró que la posición del azufre que se une a la estructura de tolueno jugó un papel importante con respecto a la unión de Abl y también que solo uno de los tiadiazoles del nitrógeno formó un enlace de hidrógeno. Además, el análisis computarizado de la estructura mostró que la benceno-cetona conectada a la amida podría sustituirse por un anillo de tiofeno más favorable . [33] Aunque se debe tener en cuenta, este análisis se realizó comparando la estructura cristalina de Abl y dasatinib, que es la conformación inactiva de Abl, el conocimiento obtenido del acoplamiento y el análisis de la estructura condujeron a la identificación de un compuesto, denominado Sustancia 14, con una alta afinidad por Abl.
Encuadernación [ editar ]
La unión de la sustancia 14 es en parte similar a la de dasatinib, el segmento de aminotiazol de la sustancia 14 hace una interacción de enlace H bi-dentada con el esqueleto CO y NH de Met-318 mientras que el metoxi-benceno cae muy bien en una bolsa hidrófoba creada por Val 256, Ala 253, Lys 271 y Ala 380. [33] Si bien las propiedades de unión similares a las de dasatinib, sugieren la posibilidad de producir Bcr-Abl TKI a partir de núcleos de tiazol, la pregunta sigue abierta si esta investigación solo conducirá a un análogo de dasatinib o una forma novedosa de inhibir los CT.
Otros [ editar ]
Rebastinib (DCC-2036) También un inhibidor de TIE-2 y VEGFR-2. [34] Ha tenido un ensayo clínico de fase 1 para leucemias (Ph + CML con mutación T315I). [35] Se encuentra en un ensayo clínico de fase 1 de terapia de combinación para el cáncer de mama metastásico. [36]
Resumen [ editar ]
| Fármaco | Estructura | Bonos H | Aminoácidos de enlace H | Confirmación de encuadernación | Descubrimiento | Estado a partir de 2017 |
|---|---|---|---|---|---|---|
| Imatinib(STI571) | 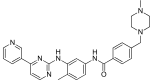 | 6 | Met-318, Thr-315, Glu-286, Asp-381, Ile-380, His-361 | Inactivo | La detección de drogas | Comercializado como terapia de primera línea. |
| Nilotinib(AMN107) |  | 4 | Met-318, Thr-315, Glu-286, Asp-381 | Inactivo | Diseño racional de drogas | Comercializado como terapia de segunda línea. |
| Dasatinib(BMS-345825) |  | 3 | Met-318, Thr-315 | Activo | Diseño racional de drogas | Comercializado como terapia de segunda línea. |
| Bosutinib(SKI-606) |  | - | - | Inactivo | Diseño racional de drogas | Comercializado como terapia de segunda línea. |
| Ponatinib(AP-24534) |  | 5 | Met-318, Asp-381, Glu-286, His-381, Ile-380 | Inactivo | Diseño racional de drogas | Comercializado como terapia de segunda línea. |
| Bafetinib(INNO-406) | 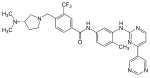 | 6 | Met-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | Inactivo | Diseño racional de drogas | Comercializado como terapia de segunda línea. |
Estado actual - re Ph + CML [ editar ]
Imatinib sigue siendo un TKI de primera línea estándar. El nilotinib y el dasatinib también están aprobados por la FDA como medicamentos de primera línea, en junio y octubre de 2010, respectivamente. Cuatro de estos medicamentos, nilotinib, dasatinib, bosutinib y ponatinib, están aprobados para el tratamiento de la CML resistente o intolerante a imatinib. Los datos de primera línea para estos compuestos son alentadores y sugieren que algunos o todos ellos pueden reemplazar a imatinib como un TKI estándar de primera línea en el futuro.









Excelente revisión. Muy didáctica
ResponderEliminar