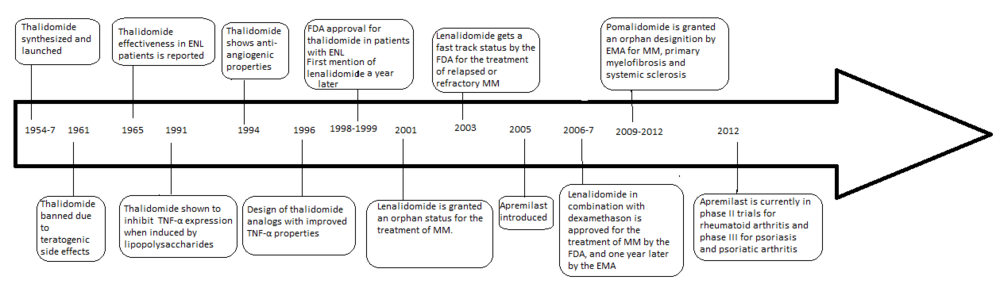
El desarrollo de análogos de la talidomida se precipitó por el descubrimiento de las propiedades anti-angiogénicas y antiinflamatorias del medicamento que produce una nueva forma de combatir el cáncer, así como algunas enfermedades inflamatorias después de haber sido prohibido en 1961. Los problemas de la talidomida incluían ; efectos secundarios teratogénicos, alta incidencia de otras reacciones adversas, escasa solubilidad en agua y mala absorción de los intestinos.
En 1998, la talidomida fue aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) para su uso en el mieloma múltiple (MM) recién diagnosticado bajo regulaciones estrictas. [1] Esto ha llevado al desarrollo de una serie de análogos con menos efectos secundarios y mayor potencia que incluyen lenalidomida , pomalidomida y apremilast , todos los cuales se comercializan y fabrican actualmente por Celgene .
Historia [ editar ]
La talidomida fue originalmente lanzada en la República Federal de Alemania ( Alemania Occidental) bajo la etiqueta de Contergan el 1 de octubre de 1957 por Chemie Grünenthal (ahora Grünenthal ). El medicamento se recetó principalmente como sedante o hipnótico, pero también se usó como antiemético (náuseas matutinas en mujeres embarazadas) y sedante . La droga fue prohibida en 1961 después de que se observaron sus propiedades teratogénicas . Los problemas con la talidomida fueron, además de los efectos secundarios teratogénicos, una alta incidencia de otras reacciones adversas junto con una pobre solubilidad en agua y la absorción porintestinos . [2] [3] Las reacciones adversas incluyen neuropatía periférica en la mayoría de los pacientes, estreñimiento , tromboembolismo y complicaciones dermatológicas . [4]
Cuatro años después de que la talidomida se retiró del mercado por su capacidad para inducir defectos congénitos graves, se descubrieron sus propiedades antiinflamatorias cuando los pacientes que sufrían eritema nudoso leproso (ENL) utilizaron la talidomida como sedante y redujeron los signos y síntomas clínicos de la enfermedad. Se descubrió que la talidomida inhibe el factor de necrosis tumoral alfa (TNF-α) en 1991 (5a Sampaio, Sarno, Galilly Cohn y Kaplan, JEM 173 (3) 699-703, 1991). TNF-α es una citoquina producida por macrófagosDel sistema inmunológico, y también un mediador de la respuesta inflamatoria. Por lo tanto, el fármaco es eficaz contra algunas enfermedades inflamatorias como ENL (6a Sampaio, Kaplan, Miranda, Nery ..... JID 168 (2) 408-414 2008). En 1994, se descubrió que la talidomida tiene actividad antiangiogénica [5] y actividad antitumoral [6], lo que impulsó el inicio de ensayos clínicos para el cáncer, incluido el mieloma múltiple. El descubrimiento de las actividades antiinflamatorias, antiangiogénicas y antitumorales de la talidomida aumentó el interés de futuras investigaciones y la síntesis de análogos más seguros. [7] [8]
La lenalidomida es el primer análogo de la talidomida que se comercializa. Es considerablemente más potente que su fármaco original con solo dos diferencias a nivel molecular, con un grupo amino agregado en la posición 4 del anillo de ftaloilo y la eliminación de un grupo carbonilo del anillo de ftaloilo. [9] El desarrollo de lenalidomida comenzó a fines de la década de 1990 y los ensayos clínicos de lenalidomida comenzaron en 2000. En octubre de 2001, se le otorgó el estatus de huérfana a la lenalidomida para el tratamiento de la MM. A mediados de 2002 entró en la fase II y, a principios de 2003, en la fase III. En febrero de 2003, la FDA otorgó el estado de vía rápida a la lenalidomida para el tratamiento de MM recidivante o refractaria. [7] En 2006, fue aprobado para el tratamiento de MM junto con dexametasona y en 2007 porAgencia Europea de Medicamentos (EMA). En 2008, el ensayo de fase II observó eficacia en el tratamiento del linfoma no Hodgkin . [10]
La pomalidomida (3-aminotalidomida) fue el segundo análogo de talidomida en ingresar a la clínica siendo más potente que sus dos antecesores. [11] Por primera vez en 2001, se observó que la pomalidomida inhibía directamente la proliferación de las células del mieloma y, por lo tanto, inhibía la MM tanto en el compartimento tumoral como en el vascular. [12] Esta actividad dual de la pomalidomida la hace más eficaz que la talidomida tanto in vitro como in vivo . [13] Este efecto no está relacionado con la inhibición del TNF-α, ya que los inhibidores potentes del TNF-α como el rolipram y la pentoxifilina no inhibieron el crecimiento celular del mieloma ni la angiogénesis. [8] Se ha informado sobre la regulación positiva de interferón gamma, IL-2 e IL-10 para pomalidomida y puede contribuir a sus actividades anti-angiogénicas y anti-mieloma.
Farmacocinética [ editar ]
Talidomida [ editar ]
| Talidomida | ||
|---|---|---|
| T máx [droga] | 4-6 horas en sujetos con MM [14] | 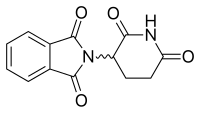 |
| Enlace proteico | 55–65% [15] | |
| Metabolitos | Metabolitos hidrolizados [15] | |
| Vida media [t 1/2 ] | 5.5–7.6 horas [15] | |
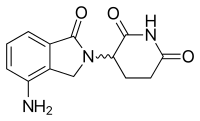
Lenalidomida [ editar ]
| Lenalidomida | ||
|---|---|---|
| T máx [droga] | 0.6-1.5 horas en sujetos sanos [16]
0.5–4 horas en sujetos con MM [17]
|  |
| Enlace proteico | ~ 30% [16] | |
| Metabolitos | Aún no ha sido estudiado [16] | |
| Vida media [t 1/2 ] | 3 horas en sujetos sanos [16] 3.1–4.2 horas en sujetos con MM [17] | |
Pomalidomida [ editar ]
| Pomalidomida | ||
|---|---|---|
| T máx [droga] | 0.5–8 horas [18] | 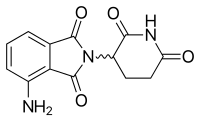 |
| Enlace proteico | Desconocido | |
| Metabolitos | Desconocido | |
| Vida media [t 1/2 ] | 6.2–7.9 horas [18] | |
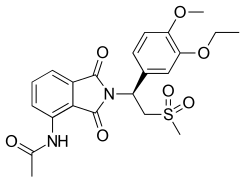
Apremilast [ editar ]
| Apremilast | ||
|---|---|---|
| T máx[droga] | 1.5–2 horas en sujetos sanos [19]
Mediana de 2 horas en pacientes con psoriasis grave tipo placa [20]
|  |
| Enlace proteico | ~ 90% [21] | |
| Metabolitos | O - desmetil apremilast glucurónido y apremilast desmetilado junto con productos hidrolizados [19] | |
| Vida media [t 1/2 ] | 8.2 horas [20] | |
Mecanismo de acción [ editar ]
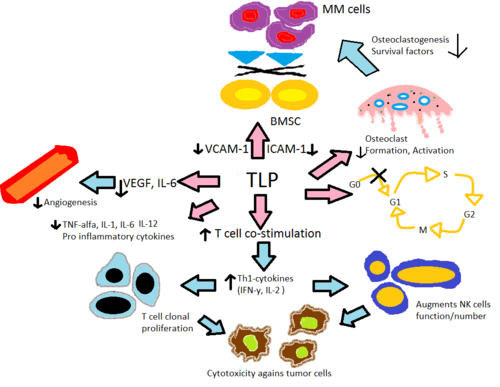
Se cree que la talidomida y sus análogos, la lenalidomida y la pomalidomida, actúan de manera similar, aunque su mecanismo de acción exacto aún no se conoce completamente. Se cree que funcionan a través de diferentes mecanismos en diversas enfermedades. El efecto neto es probablemente debido a diferentes mecanismos combinados. Sin embargo, se cree que Apremilast funciona a través de un mecanismo diferente y, por lo tanto, se analizará por separado. El mecanismo de acción se explicará a la luz del conocimiento actual, principalmente en MM (Figura 2).
Talidomida, lenalidomida y pomalidomida [ editar ]
Alterar la producción de citoquinas [ editar ]
La talidomida y sus análogos de modulación inmunitaria alteran la producción de las citoquinas inflamatorias TNF-α, IL-1 , IL-6 , IL-12 y la citoquina antiinflamatoria IL-10 . [22]Se cree que los análogos inhiben la producción de TNF-α, donde los análogos son hasta 50.000 veces más potentes in vitro que el fármaco original talidomida. [23] Se cree que el mecanismo es a través de la degradación mejorada del ARNm de TNF-α , lo que produce una disminución de las cantidades de esta citoquina proinflamatoria secretada. [24]Esto explica el efecto de la talidomida cuando se administra a pacientes con ENL, ya que comúnmente tienen altos niveles de TNF-α en la sangre y en lesiones dermatológicas. [7] En contraste, el ensayo in vitro demostró que el TNF-α en realidad está mejorado en la activación de las células T, donde los linfocitos T CD4 + y CD8 + fueron estimulados por el anti-CD3 [7] [23] que luego se confirmó en una fase temprana de ensayos Con tumores sólidos y enfermedades inflamatorias dermatológicas. [24] La IL-12 es otra citoquina suprimida y mejorada por la talidomida y sus análogos. Cuando los monocitos son estimulados por lipopolisacáridosLa producción de IL-12 se suprime, pero durante la estimulación de células T se mejora la producción. [23]
Se cree que la lenalidomida es aproximadamente 1000 veces más potente in vitro que la talidomida en propiedades antiinflamatorias y la pomalidomida es 10 veces más potente que la lenalidomida. Sin embargo, vale la pena notar que, al comparar lenalidomida y pomalidomida, la relevancia clínica de una mayor potencia in vitro no está clara, ya que la dosis máxima tolerada de pomalidomida es de 2 mg al día en comparación con 25 mg para la lenalidomida, lo que lleva a una concentración de fármaco en plasma de 10 a 100 veces menor. pomalidomida. [25]
Activación de células T [ editar ]
La talidomida y sus análogos ayudan con la coestimulación de las células T a través del complejo B7 - CD28mediante la fosforilación de la tirosina en el receptor CD28. [7] Los datos in vitro sugieren que esta coestimulación conduce a una mayor liberación de citoquinas tipo Th1 de IFN-γ e IL-2 que estimula aún más la proliferación de células T clonales y la proliferación y actividad de las células asesinas naturales . Esto aumenta la citotoxicidadcelular natural y dependiente de anticuerpos . [26] La lenalidomida y la pomalidomida son aproximadamente 100-1000 veces más potentes para estimular la proliferación clonal de células T que la talidomida. Además, in vitro.los datos sugieren que la pomalidomida revierte las células Th2 en Th1 al mejorar el factor de transcripción T-bet . [22]
Anti-angiogénesis [ editar ]
Se ha informado que la angiogénesis o el crecimiento de nuevos vasos sanguíneos se corresponde con la progresión de MM, donde el factor de crecimiento endotelial vascular (VEGF) y su receptor, bFGF [7] e IL-6 [23]parecen ser necesarios para la migración de las células endoteliales durante la angiogénesis. Se cree que la talidomida y sus análogos suprimen la angiogénesis mediante la modulación de los factores mencionados anteriormente, donde la potencia en la actividad antiangiogénica de lenalidomida y pomalidomida fue 2-3 veces mayor que la de la talidomida en varios ensayos in vivo , [27] La talidomida también ha sido se ha demostrado que bloquea la actividad de NF-κB a través del bloqueo de IL-6, y se ha demostrado que NF-κB está involucrado en la angiogénesis.[23] La inhibición de TNF-α no es el mecanismo de la inhibición de la talidomida de la angiogénesis, ya que muchos otros inhibidores de TNF-α no inhiben la angiogénesis. [5]
La actividad anti-tumor [ editar ]
Se cree que la actividad antitumoral in vivo de la talidomida se debe al potente efecto antiangiogénico y también a través de cambios en la expresión de citoquinas. Se ha demostrado que los ensayos in vitro sobre la apoptosisen células MM, cuando se tratan con talidomida y sus análogos, regulan la actividad de la caspasa-8 . Esto provoca interferencias entre la señalización apoptótica entre caspasa-8 y caspasa-9, lo que conduce a una regulación positiva indirecta de la actividad de caspasa-9. [22] [24] La actividad antitumoral adicional está mediada por la inhibición de la proteína-2 de la apoptosis [27] y los efectos pro-supervivencia de IGF-1 , lo que aumenta la sensibilidad a la muerte celular mediada por FASy mejora del ligando inductor de apoptosis relacionado con TNF. [24] También se ha demostrado que causan una detención del ciclo celular G0 / G1 dependiente de la dosis en líneas celulares de leucemia [23] donde los análogos mostraron una potencia 100 veces mayor que la talidomida. [25]
Entorno de la médula ósea [ editar ]
Vacca descubrió por primera vez la función de la angiogénesis en el soporte del mieloma en 1994. [28]Descubrieron que el aumento de la angiogénesis de la médula ósea se correlaciona con el crecimiento del mieloma y que las células estromales de soporte son una fuente importante de moléculas angiogénicas en el mieloma. Se cree que este es un componente principal del mecanismo in vivo por el cual la talidomida inhibe el mieloma múltiple.
Además, se cree que las respuestas inflamatorias dentro de la médula ósea fomentan muchas enfermedades hematológicas. La secreción de IL-6 por células estromales de médula ósea (BMSC) y la secreción de las moléculas de adhesión VCAM-1 , ICAM-1 y LFA , se induce en presencia de TNF-α y la adhesión de células MM a BMSC. La proliferación in vitro de líneas celulares de MM y la inhibición de la apoptosis mediada por Fas es promovida por IL-6. [24] La talidomida y sus análogos disminuyen directamente la regulación al alza de IL-6 e indirectamente a través de TNF-α, reduciendo así la secreción de moléculas de adhesión que conducen a que menos células MM se adhieran a BMSC. Los osteoclastos se vuelven altamente activos durante el MM, lo que lleva aReabsorción ósea y secreción de diversos factores de supervivencia del MM. Disminuyen los niveles de moléculas de adhesión que son fundamentales para la activación de los osteoclastos, disminuyen la formación de las células que forman los osteoclastos y regulan a la baja la catepsina K , una cisteína proteasa importante expresada en los osteoclastos. [27]
Apremilast [ editar ]
In vitro, apremilast reduce la actividad de PDE4 , lo que conduce a un aumento en las concentraciones de monofosfato de adenosina cíclica (AMPc) en los tipos de células inmunes y no inmunes, inhibiendo parcialmente la producción de muchas citoquinas proinflamatorias como el TNF-α, IFN-γ IL- 2, IL-12 e IL-23 y elevando la producción de la citoquina antiinflamatoria IL-10. [29] [30] La potencia de inhibición de apremilast en la producción de TNF-α es similar a la lenalidomida. [31]
Teratogenicidad [ editar ]
La teratogenicidad de la talidomida ha sido objeto de mucho debate y, a lo largo de los años , se han propuesto numerosas hipótesis . Dos de los más conocidos han sido la hipótesis antiangiogénesis y la hipótesis del modelo de estrés oxidativo, con evidencia experimental considerable que respalda estas dos hipótesis con respecto a la teratogenicidad de la talidomida. [32]
Recientemente, han surgido nuevos hallazgos que sugieren un nuevo mecanismo de teratogenicidad. Cereblones una proteína Da de 51 k localizada en el citoplasma , el núcleo y la membrana periférica de las células en numerosas partes del cuerpo. [22] Actúa como un componente de la ubiquitina ligasa E3 , regulando diversos procesos de desarrollo, incluida la embriogénesis , la carcinogénesis y la regulación del ciclo celular, a través de la degradación ( ubiquitinación) de sustratos desconocidos. Se ha demostrado que la talidomida se une al cereblón, lo que inhibe la actividad de la ubiquitina ligasa E3, lo que resulta en la acumulación de los sustratos de la ligasa y la regulación hacia abajo del factor de crecimiento de fibroblastos 8 (FGF8) y FGF10 . Esto interrumpe el circuito de retroalimentación positiva entre los dos factores de crecimiento, posiblemente causando defectos de nacimiento múltiples y efectos anti-mieloma.
Los hallazgos también apoyan la hipótesis de que un aumento en la expresión de cereblón es un elemento esencial del efecto antimieloma de lenalidomida y pomalidomida. [32] La expresión de Cereblon fue tres veces mayor en los pacientes que respondieron en comparación con los que no respondieron y una mayor expresión de cereblón también se asoció con una respuesta parcial o completa, mientras que una menor expresión se asoció con una enfermedad estable o progresiva. [22]
Uso clínico y posible [ editar ]
Talidomida [ editar ]
La talidomida ha sido aprobada por la FDA para ENL y MM en combinación con dexametasona . EMA también lo ha aprobado para tratar el MM en combinación con prednisona y / o melfalán . Las indicaciones huérfanas de la FDA incluyen enfermedad de injerto contra huésped , infección por micobacterias, úlceras aftosas recurrentes , estomatitis aftosa severa recurrente , tumores malignos primarios del cerebro, síndrome de desgaste asociado al sida , enfermedad de Crohn , sarcoma de Kaposi , síndrome mielodisplásico y trasplante de células madre hematopoyéticas . [33] [34]
Lenalidomida [ editar ]
La lenalidomida está aprobada en casi 70 países, en combinación con dexametasona para el tratamiento de pacientes con MM que han recibido al menos una terapia previa. Las indicaciones huérfanas incluyen linfoma difuso de células B grandes , leucemia linfocítica crónica y linfoma de células del manto . La lenalidomida también está aprobada para la anemia dependiente de transfusión debido a síndromes mielodisplásicos de riesgo bajo o intermedio 1 asociados con una anormalidad citogenética 5q supresión con o sin anomalías citogenéticas adicionales en los Estados Unidos, Canadá, Suiza, Australia, Nueva Zelanda, Malasia, Israel y Varios países latinoamericanos, mientras que la solicitud de autorización de comercialización.actualmente se está evaluando en otros países. [35] [36] Numerosos ensayos clínicos ya están en tramitación o se están realizando para explorar el uso adicional de la lenalidomida, solo o en combinación con otros medicamentos. Algunas de estas indicaciones incluyen leucemia mieloide aguda , linfoma folicular , linfoma MALT , macroglobulinemia de Waldenström , lupus eritematoso , linfoma de Hodgkin , síndrome mielodisplásico y más. [37] [38]
Pomalidomida [ editar ]
La pomalidomida se presentó para aprobación de la FDA el 26 de abril de 2012 [39] y el 21 de junio se anunció que el medicamento se sometería a una revisión estándar de la FDA. Se presentó una solicitud de autorización de comercialización a EMA el 21 de junio de 2012, donde se podría tomar una decisión a principios de 2013. EMA ya ha otorgado a pomalidomide una designación huérfana para mielofibrosis primaria , MM, esclerosis sistémica , post- policitemia y mielofibrosis post-esencial trombocitemia. [40]
Apremilast [ editar ]
A partir de septiembre de 2012, el apremilast se encuentra en ensayos de fase III para psoriasis y ensayos de fase II para artritis reumatoide . También se está probando la eficacia en la espondilitis anquilosante . [29] A partir de marzo de 2014, apremilast ha sido aprobado para la artritis psoriásica. [41] En septiembre de 2014, la FDA de EE. UU. Aprobó apremilast para el tratamiento de la psoriasis en placa de moderada a grave.
Desarrollo [ editar ]
La molécula de talidomida es un derivado sintético del ácido glutámico y consiste en un anillo de glutarimida y un anillo de ftaloilo (Figura 5). [21] [42] Su nombre IUPAC es 2- (2,6-dioxopiperidin-3-il) isoindol-1,3-diona y tiene un centro quiral [21] Después de la inhibición selectiva de la talidomida de TNF-α Se realizó un esfuerzo renovado en el desarrollo clínico de la talidomida. El desarrollo clínico llevó al descubrimiento de nuevos análogos que se esforzaron por tener mejores actividades y disminuir los efectos secundarios. [7] [43]
Clínicamente, la talidomida siempre se ha utilizado como un racemato . Generalmente, el S - isómero se asocia con los efectos teratogénicos infames de la talidomida y el R isómero está desprovista de las propiedades teratogénicas pero transmite los efectos sedantes, [7] sin embargo, este punto de vista es muy debatido y se ha argumentado que el modelo animal que estos diferentes efectos de R y S no fueron sensibles a los efectos teratogénicos de la talidomida. Informes posteriores en conejos, que es una especie sensible, revelaron efectos teratogénicos de ambos isómeros. [7] [21] [42] [43]Además, se ha demostrado que los enantiómeros de talidomida están interconvertidos in vivo debido al hidrógeno quiral ácido en el centro asimétrico (que se muestra, para el análogo EM-12, en la Figura 3), [42] [43], por lo que el plan para administrar una Un enantiómero único para evitar los efectos teratogénicos será en vano. [7] [21] [42]
Desarrollo de lenalidomida y pomalidomida [ editar ]
Uno de los análogos de interés se realizó mediante la sustitución con isoindolinona del anillo de ftaloilo. Se le dio el nombre EM-12 (Figura 3). Se pensó que este reemplazo aumentaba la biodisponibilidad de la sustancia debido a una mayor estabilidad. Se había informado que la molécula era un agente teratogénico aún más potente que la talidomida en ratas, conejos y monos. Además, estos análogos son inhibidores de la angiogénesis más potentes que la talidomida. [12] Además, la amino-talidomida y la amino-EM-12 eran inhibidores potentes de TNF-α. [42] Estos dos análogos más tarde recibieron el nombre de lenalidomida, que es el análogo amino EM-12, y pomalidomida, el análogo amino talidomida. [7]
Desarrollo de apremilast [ editar ]
Después de encontrar un nuevo conjunto de análogos de la talidomida, a saber, ácido 3- (1,3-dioxo-1,3 dihidroisoindol-2-il) -3- (3,4-dimetoxifenil) propiónico (no mostrado), que tenía inhibición de PDE4 Actividad El trabajo comenzó a optimizar la actividad. Para ese propósito, los investigadores utilizaron un resto de estructura conocido , 3,4-dialcoxifenilo, que es un farmacóforo reconocido en los inhibidores de la PDE4, como el rolipram (Figura 6) y el roflumilast.y lo agregó a la estructura de la serie analógica mencionada anteriormente. Después de ajustar la estructura y probar diferentes sustituciones en la posición 4 del anillo de ftaloilo y en el ácido carboxílico, los investigadores finalmente aterrizaron en una molécula que inhibe potentemente la PDE4 y el TNF-α, que más tarde llamaron apremilast (Figura 4). El enantiómero S de apremilast se eligió ya que era el enantiómero más activo. [21] Dado que la estructura de apremilast carece del hidrógeno quiral ácido, no debe racemizarse in vivo , a diferencia de la talidomida, la lenalidomida y la pomalidomida. [42] [43]
Relación estructura-actividad [ editar ]
Dado que el mecanismo de acción de la talidomida y sus análogos no está completamente claro y el biorreceptor de estas sustancias no se ha identificado, la información sobre la relación entre la estructura y la actividad de la talidomida y sus análogos se deriva principalmente del modelado molecular y la investigación de investigación continua. . [43] [44] La información sobre el SAR de la talidomida y sus análogos todavía está en proceso, por lo que se observan las tendencias detalladas aquí durante los estudios individuales. La investigación se ha centrado principalmente en mejorar la inhibición de la talidomida por TNF-α y PDE4, [7] [21] , así como la actividad anti-angiogénesis. [45] [46]
Inhibidores de TNF-α (no a través de PDE4) [ editar ]
La investigación indicó que una sustitución en el anillo de ftaloilo aumentaría la actividad de inhibición de TNF-α (Figura 5). Se probó una sustitución de grupo amino en varias ubicaciones en el anillo de ftaloilo (C4, C5, C6, C7) de talidomida y EM-12 (descrito anteriormente). La adición de aminoácidos en la ubicación C4 tanto en la talidomida como en la EM-12 dio como resultado una inhibición mucho más potente de TNF-α. Esto también reveló que el grupo amino debía estar directamente opuesto al grupo carbonilo en el sistema de anillo de isoindolinona para la actividad más potente. [47] Estos análogos no inhiben la PDE4 y, por lo tanto, no actúan mediante la inhibición de la PDE4. Otras adiciones de grupos más largos y más grandes en la posición C4 y C5 del sistema de anillo de ftaloilo de la talidomida, algunas con una olefinaFuncionalidad, han sido probados con diversos resultados. Se observó un aumento del efecto inhibitorio, en comparación con la talidomida, con los grupos que tenían un átomo de oxígeno unido directamente a la olefina C5 o C4. La adición de yodo y bromo en C4 o C5 dio como resultado una actividad igual o menor en comparación con la talidomida. [48] Estos grupos no se compararon con lenalidomida o pomalidomida.
Inhibidores de PDE4 [ editar ]
La estructura común para los análogos que inhiben el TNF-α a través de la inhibición de la PDE4 se prepara sobre la base de la hidrólisis del anillo de glutarimida de la talidomida. Estos análogos no tienen un hidrógeno quiral ácido, a diferencia de la talidomida, y por lo tanto se espera que sean quiralmente estables. [42]
En el anillo de fenilo, un resto 3,4-dialcoxifenilo (Figura 6) es un farmacóforo conocido en los inhibidores de PDE4, como el rolipram . La actividad óptima se logra con un grupo metoxi en la posición 4 (X2) y un grupo más grande, como ciclopentoxi en el carbono de la posición 3 (X3). Sin embargo, los análogos inhibidores de la talidomida PDE4 no siguen el SAR de los análogos de rolipram directamente. Para los análogos de la talidomida, un grupo etoxi en X3 y un grupo metoxi en X2, siendo X1 solo un hidrógeno, dio la inhibición más alta de PDE4 y TNF-α. [21] Los sustitutos más grandes que el dietoxi en la posición X2-X3 tuvieron una actividad disminuida. Los efectos de estas sustituciones parecen estar mediados por efectos estéricos. [42]
Para la posición Y, se han explorado varios grupos. Las amidas sustituidas que eran más grandes que la metilamida (CONHCH 3 ) disminuyen la actividad de inhibición de la PDE4. [42] Al utilizar un ácido carboxílico como punto de partida, un grupo amida tiene una actividad de inhibición de PDE4 similar, pero se demostró que ambos grupos son considerablemente menos potentes que un grupo de éster metílico, que tuvo un aumento de aproximadamente seis veces la actividad inhibidora de PDE4. El grupo sulfona tuvo una inhibición de PDE4 similar a la del grupo éster metílico. La mejor inhibición de PDE4 se observó cuando se unió un grupo nitrilo, que tiene 32 veces más actividad inhibidora de PDE4 que el ácido carboxílico. [21] Los sustituyentes en Y que conducen a un aumento de la actividad inhibitoria de la PDE4 siguieron el orden:
- COOH ≤ CONH 2 ≤ COOCH 3 ≤ SO 2 CH 3
Se han explorado las sustituciones en el anillo de ftaloilo y se observó que los grupos nitro en la ubicación C4 o C5 disminuían la actividad, pero la sustitución de los aminoácidos C4 o C5 la aumentaba dramáticamente. [42]Cuando se examinó la sustitución en la ubicación 4 (Z) del anillo de ftaloilo, los grupos hidroxilo y metoxi parecen hacer que el análogo sea un inhibidor de PDE4 menos potente. Se observó un aumento de la actividad con amino y dimetilamino en un grado similar, pero un grupo metilo mejoró la actividad más que los grupos mencionados anteriormente. Un grupo 4- N- acetilamino tenía una actividad inhibitoria de la PDE4 ligeramente más baja, en comparación con el grupo metilo, pero aumentó la actividad inhibidora del TNF-α del compuesto en un grado adicional. [21] Los sustituyentes en Z que conducen a incrementar la actividad inhibitoria de PDE4 siguieron el orden:
- N (CH 3 ) 2 ≤ NH 2
3 3
Inhibición de la angiogénesis [ editar ]
Para la actividad de inhibición de la angiogénesis, parece ser necesario un anillo de glutarimida intacto . Diferentes grupos fueron probados en la posición R. Las sustancias que tenían sales de nitrógeno como grupo R mostraron buena actividad. La actividad inhibidora de la angiogénesis mejorada podría deberse a una mayor solubilidad o al hecho de que el nitrógeno cargado positivamente ha agregado interacción con el sitio activo. La tetrafluoración del anillo de ftaloilo parece aumentar la inhibición de la angiogénesis. [45]
Síntesis [ editar ]
Esta sección puede ser demasiado técnica para que la mayoría de los lectores entiendan . Ayude a mejorarlo para que sea comprensible para los no expertos , sin eliminar los detalles técnicos. ( Abril de 2017 ) ( Aprenda cómo y cuándo eliminar este mensaje de plantilla )
|
A continuación se describen los esquemas para sintetizar talidomida, lenalidomida, pomalidomida y apremilast, según lo informado por la literatura primaria prominente . Tenga en cuenta que estos esquemas de síntesis no reflejan necesariamente las estrategias de síntesis orgánica utilizadas para sintetizar estas entidades químicas únicas.
Talidomida [ editar ]
La síntesis de talidomida se ha realizado generalmente como se ve en el esquema 1. Esta síntesis es un proceso de tres pasos bastante simplista. Sin embargo, el inconveniente de este proceso es que el último paso requiere una reacción de fusión a alta temperatura que requiere múltiples recristalizaciones y no cumple con el equipo estándar.
El Esquema 2 es la nueva ruta de síntesis que fue diseñada para hacer que la reacción sea más directa y para producir mejores rendimientos. Esta ruta utiliza L -glutamina en lugar de L -glutámico como material de partida y al dejar que reaccione con N -carbetoxifalalimida, se obtiene N- ftaloil- L- glutamina (4), con un rendimiento de 50–70%. La sustancia 4 se agita luego en una mezcla con carbonildiimidazol ( CDI ) con suficiente 4-dimetilaminopiridina ( DMAP ) en tetrahidrofurano ( THF ) para catalizar la reacción y se calienta a reflujo.Durante 15-18 horas. Durante el reflujo, la talidomida cristaliza fuera de la mezcla. El paso final da un rendimiento de 85-93% de talidomida, lo que lleva el rendimiento total a 43-63%. [49]
Lenalidomida y pomalidomida [ editar ]
Ambos de los análogos de amino se preparan a partir de la condensación de clorhidrato de 3-aminopiperidina-2,6-diona (Compuesto 3) que se sintetiza en una reacción de dos etapas a partir de Cbz - L -glutamina disponible comercialmente . La Cbz- L -glutamina se trata con CDI en THF a reflujo para producir Cbz-aminoglutarimida. Para eliminar el grupo protector Cbz, se realizó una hidrogenólisis , bajo 50–60 psi de hidrógeno con Pd / C al10% mezclado con acetato de etilo y HCl. El hidrocloruro formulado (Compuesto 3 en el Esquema 3) se hizo reaccionar luego con anhídrido 3-nitroftálico en ácido acético a reflujo para producir el análogo de talidomida 4-nitro-sustituido y luego el grupo nitro se redujo conHidrogenación para dar pomalidomida. [47]
La lenalidomida se sintetiza de manera similar utilizando el compuesto 3 (3-aminopiperidina-2,6-diona) tratado con un 2- (bromometil) benzoato de metilo nitro-sustituido y la hidrogenación del grupo nitro. [47]
Apremilast [ editar ]
En la síntesis de apremilast, el compuesto 3 en el esquema 5 se produce con un rendimiento del 41% a partir del compuesto 2 tratado con hexametildisilazida de litio , en mezcla con dimetilsulfona de litio y eterato de trifluoruro de boro. La resolución del compuesto 3 se realizó tratándola con N- acetil- L- leucina produciendo 3S. El paso final luego utiliza la condensación de anhídrido acetilminoftálico 3 N con 3S para obtener apremilast (1S) con un rendimiento del 75%.











No hay comentarios:
Publicar un comentario