Los antagonistas del receptor CCR5 son una clase de moléculas pequeñas que antagonizan el receptor CCR5. El receptor CCR5 de quimiocinas con motivos CC está involucrado en el proceso por el cual el VIH , el virus que causa el SIDA , ingresa a las células. Por lo tanto, los antagonistas de este receptor son inhibidores de la entraday tienen aplicaciones terapéuticas potenciales en el tratamiento de infecciones por VIH.
El ciclo de vida del VIH presenta objetivos potenciales para la terapia con medicamentos, uno de ellos es la vía de entrada viral. CCR5 y CXCR4 son los principales receptores involucrados en el proceso de ingreso de VIH. Estos receptores pertenecen a la familia de siete receptores transmembrana acoplados a proteína G ( GPCR ) y se expresan predominantemente en células T humanas , células dendríticas y macrófagos , células de Langerhans . [1] Juegan un papel importante como co-receptores que el VIH tipo 1 (VIH-1) utiliza para unirse a las células antes de la fusión viral y la entrada en las células huésped. [1]Los aislados de VIH se pueden dividir en cepas R5 y X4. La cepa R5 es cuando el virus usa el co-receptor CCR5 y la cepa X4 es cuando usa CXCR4. [2]La ubicación de los receptores CCR5 en la superficie celular, tanto grandes como pequeñas moléculas, tiene el potencial de interferir con la interacción viral CCR5 e inhibir la entrada viral en las células humanas.
Historia [ editar ]
Desde el descubrimiento del VIH en la década de 1980, se ha logrado un progreso notable en el desarrollo de nuevos fármacos antivirales . [2] El desencadenante del descubrimiento de los antagonistas de CCR5 fue la observación de que un pequeño porcentaje de poblaciones de alto riesgo mostró resistencia o retraso en el desarrollo de la enfermedad. Se descubrió que esta población tenía una mutación (CCR5-Δ32) en el gen que codifica el receptor CCR5, lo que da como resultado una resistencia casi completa contra la infección por VIH-1, y los científicos descubrieron el papel clave de los receptores de superficie celular CCR5 y CXCR4 con éxito. Fusión viral e infección. [4] En 1996, se demostró que CCR5 sirve como un co-receptor para las cepas de VIH-1 transmitidas con mayor frecuencia, R5. Este tipo de virus es predominante durante las primeras etapas de la infección y sigue siendo la forma dominante en más del 50% de los pacientes infectados con VIH-1 en las últimas etapas, [5] [6] sin embargo, las cepas R5 pueden eventualmente evolucionar a X4 a medida que avanza la enfermedad. [2] Esta información condujo al desarrollo de una nueva clase de medicamentos contra el VIH llamados antagonistas de CCR5. [7]
Mecanismo de acción [ editar ]
El VIH ingresa a las células huésped en la sangre al unirse a los receptores en la superficie de la célula CD4 + . [8] La entrada viral a las células CD4 + comienza con la unión de la glicoproteína 120 del VIH-1 R5 ( gp120 ) al receptor de células T CD4 +, que produce un cambio conformacional en gp120 y le permite unirse a CCR5, lo que desencadena la glicoproteína 41 ( gp41 ) la fusión mediada de la envoltura viral con la membrana celular y la nucleocápside entra en la célula huésped (Figura 1). [8] [9] Los antagonistas de los co-receptores de CCR5 evitan que el VIH-1 ingrese e infecte a las células inmunitarias al bloquear el receptor de la superficie de las células CCR5.[10] Losantagonistas de moléculas pequeñasde CCR5 se unen a unabolsa hidrófoba formada por las hélices transmembrana del receptor CCR5. [11] Se cree que interactúan con el receptor demanera alostérica y bloquean al receptor en una conformación que prohíbe su función de co-receptor. [12]
Desarrollo de fármacos [ editar ]
Esta sección necesita citas adicionales para su verificación . ( diciembre de 2014 ) ( Aprenda cómo y cuándo eliminar este mensaje de plantilla )
|
Como se mencionó, el receptor CCR5 es un receptor acoplado a proteína G (GPCR). Antes del descubrimiento del papel de CCR5 en la infección por VIH, muchas compañías farmacéuticas ya habían construido una colección sustancial de compuestos dirigidos a los GPCR. [ cita requerida ] Algunos de estos compuestos demostrarían ser un punto de partida para la química medicinal antagonista de CCR5 , pero necesitarían optimización para mejorar la selectividad y potencia de CCR5, y para mejorar las propiedades farmacocinéticas . [ cita requerida ] Un problema importante fue la afinidad de los éxitos de detección disponibles para el canal iónico hERG ; [ cita requerida ]la inhibición de hERG conduce a la prolongación del intervalo QT, lo que puede aumentar el riesgo de desarrollar arritmias ventriculares fatales . [3] [13] Muchos antagonistas de CCR5 han sido estudiados por compañías farmacéuticas, pero pocos de ellos han alcanzado estudios de eficacia en humanos; por ejemplo , AstraZeneca , [14] [se necesita fuente no primaria ] Novartis , [15] [se necesita fuente no primaria ] Merck , [16] [se necesita fuente no primaria ] y Takeda [17] [se necesita fuente no primaria ]han utilizado sus colecciones de compuestos dirigidos a GPRC para desarrollar un potente antagonista de CCR5, pero ninguno de ellos ha llegado a los ensayos clínicos. [ cita requerida ] Tres compañías farmacéuticas estaban compitiendo para ser las primeras en tener una pequeña molécula CCR5 antagonista aprobada: [ cita requerida ] GlaxoSmithKline (GSK) con su compuesto aplaviroc , [ cita requerida ] Schering-Plough con vicriviroc , [ cita requerida ] y Pfizer con maraviroc . [ cita requerida ] Todos los compuestos alcanzaron ensayos clínicos en humanos; [ cita requerida ] solo maraviroc ha sido aprobado [ vago ] por la Administración de Drogas y Alimentos de los Estados Unidos (FDA). [3] En la siguiente sección se discutirá el desarrollo de estos tres compuestos.
Aplaviroc [ editar ]
Aplaviroc se origina a partir de una clase de derivados de espirodicetopiperazina. La Figura 2muestra la estructura molecular del compuesto de plomo y el compuesto final aplaviroc. El compuesto principal mostró una buena potencia en el bloqueo de CCR5 en varias cepas de VIH R5 y contra cepas resistentes a múltiples fármacos. [3] El problema con este compuesto no fue su selectividad CCR5 sino su biodisponibilidad oral. [3] [18] Esto condujo a un mayor desarrollo de la molécula y el resultado fue un compuesto llamado aplaviroc. Desafortunadamente, a pesar de los prometedores resultados clínicos preclínicos y tempranos, cierta toxicidad hepática gravese observó en el tratamiento de pacientes ingenuos y con experiencia en el tratamiento que condujeron a la interrupción del desarrollo adicional de aplaviroc. [3]
Vicriviroc [ editar ]
Schering-Plough identificó un compuesto activo durante la selección. [3] La Figura 3 muestra la estructura molecular del compuesto principal, el compuesto intermedio y el compuesto final vicriviroc . El compuesto principal contenía un andamio de piperazina y era un potente antagonista del receptor de acetilcolina muscarínica (M 2 ) con una actividad de CCR5 modesta. Los cambios que se realizaron en el lado izquierdo del compuesto de plomo y la adición de un grupo metilo en el grupo de piperazina (( S) (metilpiperazina) resultó en el compuesto intermedio que tenía buena afinidad por los receptores CCR5 pero muy poca afinidad por la actividad muscarínica, sin embargo, el compuesto mostró afinidad por el canal iónico hERG. [19] [20]La reconstrucción posterior condujo al desarrollo del compuesto final vicriviroc, cuando Schering descubrió que el piridil N -óxido en el intermedio podría reemplazarse por 4,6-dimetilpirimidina carboxamida. Vicriviroc tuvo una excelente selectividad para los receptores CCR5 sobre muscarínica y la afinidad por hERG se redujo en gran medida. [21] [22]Ensayo clínico de fase IEl vicriviroc dio resultados prometedores, por lo que se inició un estudio de fase II en el tratamiento de pacientes sin tratamiento previo. El estudio de fase II se suspendió porque hubo un avance viral en el grupo de vicriviroc en comparación con el grupo de control . Estos resultados sugirieron que el vicriviroc no fue efectivo en el tratamiento de pacientes sin tratamiento previo en comparación con los tratamientos actuales. Se realizó otro estudio clínico de fase II en pacientes con experiencia en el tratamiento. Los resultados fueron que el vicriviroc tuvo una fuerte actividad antiviral, pero se informaron cinco casos de cáncer entre los participantes, sin embargo, el estudio continuó ya que no hubo asociación causal de las neoplasias malignas y el vicriviroc. [3]A finales de 2009, la compañía informó que el vicriviroc había ingresado en los estudios de fase II en el tratamiento de pacientes sin experiencia y en los estudios de fase III en pacientes con experiencia en el tratamiento. [23] [se necesita mejor fuente ]
Maraviroc [ editar ]
Pfizer recurrió a un análisis de alto rendimiento en su búsqueda de un buen punto de partida para un antagonista de CCR5 de molécula pequeña. Su selección dio como resultado un compuesto que presentaba una afinidad débil y ninguna actividad antiviral, pero representaba un buen punto de partida para una mayor optimización. [3]Los compuestos 1-9 en la Tabla 1 muestran el desarrollo de maraviroc en pocos pasos. La estructura química de la molécula de partida (UK-107,543) [24] se presenta como compuesto 1 . Su primer objetivo fue minimizar la actividad de CYP2D6 de la molécula y reducir su lipofilia . Reemplazaron la imidazopiridina conEl benzimidazol y el grupo benzhidrilo se intercambiaron por una benzamida . El resultado fue compuesto 2 . [3] Ese compuesto mostró una buena potencia de unión y el inicio de una actividad antiviral. La optimización adicional de la relación estructura-actividad (SAR) de la región amida y la identificación de la preferencia enantiomérica condujeron a la estructura de ciclobutil amida en el compuesto 3 . Sin embargo, el problema con la actividad CYP2D6 del compuesto todavía era inaceptable, por lo que tuvieron que realizar una optimización de SAR adicional que determinó que la [3.2.1] -azabicicloamina ( tropano ) podría reemplazar el resto de aminopiperidina. Este cambio en la estructura química condujo a compuesto.4 . El compuesto 4 no tenía actividad de CYP2D6 al tiempo que conservaba una excelente afinidad de unión y actividad antiviral. [3] [25] Aunque el compuesto 4 mostró resultados prometedores, demostró una inhibición del 99% en el canal de iones hERG . Esa inhibición era inaceptable, ya que puede conducir a la prolongación del intervalo QTc . Luego, el equipo de investigación realizó algunas modificaciones para ver qué parte de la molécula desempeñaba un papel en la afinidad hERG. El compuesto 5muestra un análogo que sintetizaron que contenía una cabeza de puente de oxígeno en el anillo de tropano; sin embargo, esa reconstrucción no tuvo un efecto en la afinidad hERG. [26]Luego se enfocaron en el área de la superficie polar en la molécula para marcar la afinidad hERG. Estos esfuerzos dieron como resultado el compuesto 6 . Ese compuesto conservó la actividad antiviral deseada y fue selectivo contra la inhibición de hERG, pero el problema fue su biodisponibilidad . La reducción de la lipofilicidad, al reemplazar el grupo bencimidazol con un grupo triazol sustituido, dio el compuesto 7 . El compuesto 7 había mostrado una reducción significativa en la lipofilicidad y mantenía la actividad antiviral, pero nuevamente, con la introducción de un grupo ciclobutilo, el compuesto mostraba inhibición de hERG. Cambio del tamaño del anillo en el compuesto 7 de una unidad de ciclobutilo a una unidad de ciclopentilo en el compuesto 8condujo a un aumento significativo en la actividad antiviral y la pérdida de afinidad hERG. Un mayor desarrollo llevó al descubrimiento de una 4,4'-difluorociclohexilamida también conocida como maraviroc. Maraviroc conservó una excelente actividad antiviral, mientras que no demostró una afinidad significativa de unión al hERG. Se predijo que la falta de afinidad de unión a hERG se debía al gran tamaño del grupo ciclohexilo y la alta polaridad de los sustituyentes flúor. [3] [25] [26] En agosto de 2007, la FDA aprobó el primer antagonista de CCR5, maraviroc, descubierto y desarrollado por Pfizer. [4] [7]
Farmacóforo [ editar ]
El modelo de farmacóforo predictivo fue desarrollado para una gran serie de antagonistas de CCR5 a base de piperidina y piperazina por el Instituto de Investigación Schering-Plough. Su hipótesis consistía principalmente en cinco características, dos aceptadores de enlaces de hidrógeno, marcados con C y D en la figura 4 y tres grupos hidrófobos, A, B y E en la figura 4. La Parte B generalmente tiene un grupo de nitrógeno básico. El modelo se validó utilizando un conjunto diverso de seis antagonistas de CCR5 de cinco compañías farmacéuticas diferentes. El mejor modelo predijo correctamente estos compuestos como altamente activos. Es posible utilizar el modelo como una herramienta en la selección virtual de nuevos antagonistas de CCR5 de pequeño peso molecular y también para predecir las actividades biológicas de los compuestos antes de emprender su síntesis costosa.[27]
Encuadernación [ editar ]
CCR5 es un miembro de siete receptores del segmento transmembrana acoplados a la proteína G. La estructura del receptor comprende un haz de siete hélices en la región transmembrana, estas regiones están etiquetadas I-VII en las figuras 5 y 6. Se predice que los antagonistas de CCR5 se unirán a un bolsillo de unión putativo que está enterrado dentro del dominio transmembrana, encerrado por las siete hélices transmembrana. El bolsillo de encuadernación es muy hidrófobo con múltiples residuos aromáticos que recubren el bolsillo. Los residuos clave son triptófano 86 y 248 (Trp86, Trp248), tirosina 108 y 251 (Tyr108, Tyr251), fenilalanina 109 (Phe109), treonina 195 (Thr195), isoleucina 198 (Ile198),ácido glutámico 283 (Glu283). Los antagonistas de CCR5 son muy diferentes en forma y potencial electrostático,aunque todos comparten el mismo bolsillo de unión. Lo interesante de la unión de estas moléculas es que exhiben modos de unión significativamente diferentes, aunque todas ellas establecen una red de interacción extensa con CCR5. [28] [29] [30] [31]
Aplaviroc [ editar ]
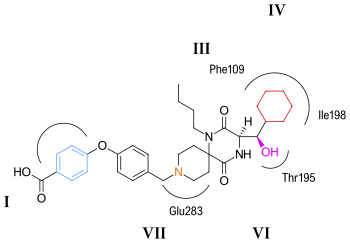
El modo de unión putativo para aplaviroc se muestra en la figura 5 . Se predice que la interacción clave de saltbridge entre aplaviroc y Glu283 es bastante débil en comparación con otros antagonistas de CCR5. El grupo hidroxilo en el aplaviroc forma un fuerte enlace de hidrógeno al residuo polar Thr195. Esta interacción del enlace H es la más fuerte con aplaviroc en comparación con otros antagonistas de CCR5. Se predice que el grupo ciclohexilo en la estructura de aplaviroc interactúa con el receptor en una bolsa hidrófoba formada por Ile198, Thr195 y Phe109 y se cree que muestra interacciones hidrófobas bastante fuertes. Los investigadores predicen que el grupo butilo de aplaviroc está enterrado dentro del haz helicoidal a través de una fuerte interacción hidrófoba con múltiples residuos aromáticos del receptor CCR5. [29]Aplaviroc tiene una característica única de preservar dos de los ligandos de la proteína de la quimiocina natural que se unen a CCR5 y su posterior activación, mientras que el maraviroc y los otros antagonistas bloquean casi por completo las interacciones quimiocina-CCR5. Hasta ahora se considera que este tipo de interferencia es seguro, y las personas que naturalmente carecen de CCR5 no muestran ningún problema de salud obvio. Sin embargo, para limitar la toxicidad y los efectos secundarios de los antagonistas de CCR5, sería ideal poder preservar la función del receptor de quimiocinas. Por consiguiente, debería ser interesante diseñar inhibidores que interrumpan específicamente la unión de CCR5-gp120 pero no afecten la activación de la quimiocina CCR5. [30]
Maraviroc [ editar ]
El modo de enlace putativo para maraviroc se muestra en la figura 6 . Se estima que la interacción más fuerte es entre maraviroc y ácido glutámico (Glu283) a través de una fuerte interacción puente salino. La interacción entre el triptófano (Trp86) y el maraviroc implica el apilamiento π-π en forma de T, mientras que la interacción con la fenilalanina (Phe109) se predice que es hidrófoba. Se piensa que la tirosina (Tyr108) interactúa con el grupo fenilo en el maraviroc a través de una interacción desplazada paralela. Se predice que la interacción entre maraviroc e isoleucina (Ile198) es principalmente de naturaleza hidrófoba y la interacción entre maraviroc y tirosina (Tyr251) es muy limitada. [29]
Otros antagonistas de CCR5 [ editar ]
El desarrollo de nuevos antagonistas de CCR5 continúa, tanto por sus efectos antivirales como por su utilidad potencial en una variedad de indicaciones autoinmunes . Los investigadores de Ono han descubierto una nueva serie de potentes antagonistas de moléculas pequeñas CCR5. La optimización del plomo se buscó al equilibrar las tendencias opuestas de estabilidad metabólica y potencia. La combinación de la plantilla de espiropiperidina con elementos farmacóforos tanto de aplaviroc como del programa antagonista CCR5 de Schering, llevó al compuesto líder inicial de esta serie. Un mayor desarrollo de ese compuesto líder condujo al descubrimiento del compuesto A en la figura 7 , un compuesto que posee una buena selectividad y propiedades farmacocinéticas. [32]
El antagonista de CCR5 INCB009471 tiene actividad nanomolar contra el VIH-1 in vitro . Este compuesto demostró una actividad antiviral potente y prolongada contra R5-tropic HIV-1 cuando se administró una dosis diaria de 200 mg durante 14 días. Estos hallazgos respaldaron un mayor desarrollo clínico de INCB009471 y desde entonces han progresado a los ensayos clínicos de fase IIb. A partir de 2009, el estudio de este compuesto está inactivo y no se planea realizar más estudios en este momento.















No hay comentarios:
Publicar un comentario