gráfico de entalpía-entropía , también conocido como gráfico H - So diagrama de Mollier , traza el calor total contra la entropía, [1] quedescribe la entalpía de un sistema termodinámico . [2] Un gráfico típico cubre un rango de presión de 0.01–1000 bar y temperaturas de hasta 800 grados Celsius . [3] Muestra entalpía. en términos de energía interna , presión y volumen usando la relación (o, en términos de entalpía específica , entropía específica y volumen específico ,).
Historia [ editar ]
El diagrama se ha creado en 1904, cuando Richard Mollier representa el calor total [4] H contra de la entropía S . [5] [1]
En la Conferencia de Termodinámica de 1923 celebrada en Los Ángeles, se decidió nombrar, en su honor, como un "diagrama de Mollier" cualquier diagrama termodinámico utilizando la entalpía como uno de sus ejes. [6]
Detalles [ editar ]
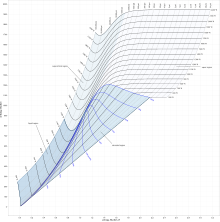
En el diagrama, se trazan líneas de presión constante, temperatura y volumen constantes, por lo que en una región de dos fases, las líneas de presión constante y temperatura coinciden. [7] Por lo tanto, las coordenadas en el diagrama representan la entropía y el calor . [8]
El trabajo realizado en un proceso en ciclos de vapor está representado por la longitud de h , por lo que puede medirse directamente, mientras que en un diagrama T-s debe calcularse utilizando la relación termodinámica entre las propiedades termodinámicas. [1]
En un proceso isobárico , la presión permanece constante, por lo que la interacción de calor es el cambio en la entalpía. [2]
En un proceso isenthalpic , la entalpía es constante. [2] Una línea horizontal en el diagrama representa un proceso isenthalpic .
Una línea vertical en el gráfico h – s representa un proceso isentrópico . El proceso 3–4 en un ciclo de Rankine es isentrópico cuando se dice que la turbina de vapor es ideal. Por lo tanto, el proceso de expansión en una turbina se puede calcular fácilmente utilizando el gráfico h – s cuando el proceso se considera ideal (como ocurre normalmente cuando se calculan entalpías, entropías, etc.). Posteriormente, las desviaciones de los valores ideales pueden ser calculada considerando la eficiencia isentrópica de la turbina de vapor utilizada).
Las líneas de fracción de sequedad constante ( x ), a veces llamadas calidad , se dibujan en la región húmeda y las líneas de temperatura constante se dibujan en la región sobrecalentada. [3] X proporciona la fracción (en masa) de sustancia gaseosa en la región húmeda, el resto son gotitas de líquido coloidal . Sobre la línea gruesa, la temperatura está por encima del punto de ebullición y la sustancia seca (sobrecalentada) es solo gas.
En general, tales gráficos no muestran los valores de volúmenes específicos , ni muestran las entalpías de agua saturada a presiones que son del orden de las experimentadas en condensadores en una central térmica . [3] Por lo tanto, la tabla solo es útil para cambios de entalpía en el proceso de expansión del ciclo de vapor. [3]
Aplicaciones y uso [ editar ]
Se puede utilizar en aplicaciones prácticas, como malteado , para representar el sistema de grano-aire-humedad. [9]
Los datos de propiedades subyacentes para el diagrama de Mollier son idénticos a los de un gráfico psicrométrico . En la primera inspección, puede parecer poco parecido entre los gráficos, pero si el usuario gira un gráfico noventa grados y lo mira en un espejo, el parecido es evidente. Las coordenadas del diagrama de Mollier son la entalpía h y la relación de humedad x . La coordenada de entalpía está sesgada y las líneas de entalpía constante son paralelas y están espaciadas uniformemente.
La compensación entre entalpía y entropía es un ejemplo específico del efecto de compensación. El efecto de compensación se refiere al comportamiento de una serie de reacciones químicas estrechamente relacionadas (por ejemplo, reactivos en diferentes solventes o reactivos que difieren solo en un solo sustituyente ), que muestran una relación lineal entre uno de los siguientes parámetros cinéticos o termodinámicos para describir las reacciones : [1]
(i) entre el logaritmo de los factores pre-exponenciales (o prefactores) y las energías de activación
-
-
- En A i = α + E a, i / R β
-
donde las series de reacciones estrechamente relacionadas están indicadas por el índice i , A i son los factores preexponenciales, E a, i son las energías de activación, R es la constante de gas y α y β son constantes.
-
-
- Δ H ‡ i = α + β Δ S ‡ i
-
donde H ‡ i son las entalpías de activación y S ‡ i son las entropías de activación.
(iii) entre los cambios de entalpia y entropía de una serie de reacciones similares ( compensación de entalpía-entropía )
-
-
- Δ H i = α + β Δ S i
-
donde H i son los cambios de entalpía y S i son los cambios de entropía.
Cuando la energía de activación varía en primera instancia, podemos observar un cambio relacionado en los factores pre-exponenciales. Un aumento en A tiende a compensar un aumento en E a, i , por lo que llamamos a este fenómeno un efecto de compensación. Del mismo modo, para el segundo y tercer casos, de acuerdo con la energía libre de Gibbs ecuación, con la cual se deriva de las ecuaciones mencionadas, Δ H escalas proporcionalmente con Δ S . La entalpía y la entropía se compensan entre sí por sus signos algebraicos opuestos en la ecuación de Gibbs.
Se ha observado una correlación entre entalpia y entropía para una amplia variedad de reacciones. La correlación es significativa porque, para que se cumplan las relaciones lineales de energía libre (LFER), se debe cumplir una de las tres condiciones para la relación entre entalpía y entropía para una serie de reacciones, siendo el escenario más común el que describe la entalpía: Compensación de entropía. Las relaciones empíricas anteriores fueron notadas por varios investigadores a partir de la década de 1920, ya que los efectos compensatorios que gobiernan se han identificado bajo diferentes alias.
Términos relacionados [ editar ]
Muchos de los términos más populares utilizados para discutir el efecto de compensación son específicos de su campo o fenómeno. En estos contextos, los términos no ambiguos son, por supuesto, preferidos. Sin embargo, la aplicación errónea y la interferencia frecuente entre los campos en esta materia a menudo ha llevado al uso de términos inapropiados y un cuadro confuso para pintar. Para los propósitos de esta entrada, por lo tanto, es importante tener en cuenta que se pueden usar diferentes términos para referirse a lo que parece ser el mismo efecto, pero que se está utilizando un término como una abreviatura (las relaciones isocinética e isoequilibrium son diferentes, pero a menudo se agrupan de forma sinecdóquica como relaciones isocinéticas en aras de la brevedad) o es el término correcto en contexto. Esta sección debería ayudar a resolver cualquier incertidumbre. ( ver Críticasección para más sobre la variedad de términos )
efecto / regla de compensación : término general para la relación lineal observada entre: (i) el logaritmo de los factores preexponenciales y las energías de activación, (ii) entalpías y entropías de activación, o (iii) entre los cambios de entalpía y entropía de una serie de reacciones similares.
Compensación entalpía-entropía : la relación lineal entre entalpías y entropías de activación o los cambios de entalpía y entropía de una serie de reacciones similares.
relación de isoequilibrio (IER) , efecto de isoequilibrio : en un gráfico de Van 't Hoff , existe un punto de intersección común que describe la termodinámica de las reacciones. A la temperatura β de equilibrio de equilibrio, todas las reacciones en la serie deben tener la misma constante de equilibrio ( K i )
-
-
- Δ G i (β) = α
-
Relación isocinética (IKR) , efecto isocinético : en una gráfica de Arrhenius , existe un punto de intersección común que describe la cinética de las reacciones. A la temperatura isocinética β, todas las reacciones en la serie deben tener la misma velocidad constante ( k i )
-
-
- k i (β) = exp (α)
-
temperatura de isoequilibrio : utilizada para los LFER termodinámicos; se refiere a β en las ecuaciones donde posee dimensiones de temperatura
temperatura isocinética : utilizada para LFER cinéticos; se refiere a β en las ecuaciones donde posee dimensiones de temperatura
Compensación cinética : un aumento en los factores preexponenciales tiende a compensar el aumento en la energía de activación:
-
-
- ln A = ln A 0 + αΔ E 0
-
Regla de Meyer-Neldel (MNR) : se utiliza principalmente en la ciencia de los materiales y la física de la materia condensada; el MNR a menudo se establece como la gráfica del logaritmo del factor preexponencial contra la energía de activación es lineal:
-
-
- σ ( T ) = σ 0 exp (- E a / k B T )
-
donde lnσ 0 es el factor preexponencial, E a es la energía de activación, σ es la conductividad yk B es la constante de Boltzmann y T es la temperatura. [2]
Matemáticas [ editar ]
Compensación de entalpía-entropía como requisito para los LFERs [ editar ]
Las relaciones lineales de energía libre (LFER) existen cuando la influencia relativa de cambiar los sustituyentes en un reactivo es similar al efecto en otro reactivo, e incluye gráficos de Hammett lineales , diagramas de Swain-Scott y diagramas de Brønsted . No siempre se encuentra que los LFER se mantienen, y para ver cuándo se puede esperar, examinamos la relación entre las diferencias de energía libre para las dos reacciones en comparación. La medida en que se cambia la energía libre de la nueva reacción, a través de un cambio en el sustituyente, es proporcional a la medida en que la reacción de referencia se cambió por la misma sustitución. Una relación de las diferencias de energía libre es el cociente de reacción o constante Q .
-
-
- (Δ G ' 0 - Δ G ' x ) = Q (Δ G 0 - Δ G x )
-
La ecuación anterior se puede reescribir como la diferencia (δ) en los cambios de energía libre (Δ G ):
-
-
- δΔ G = Q δΔ G
-
Sustituyendo la ecuación de energía libre de Gibbs (Δ G = Δ H - T Δ S ) en la ecuación anterior se obtiene una forma que deja en claro los requisitos para que los LFER se cumplan.
-
-
- (Δ H ' - T Δ S ' ) = Q (Δ H - T Δ S )
-
Uno debe esperar que los LFER se mantengan si se cumple una de las tres condiciones:
(1) Los δΔ H son casualmente los mismos tanto para la nueva reacción en estudio como para la reacción de referencia, y los δΔ S son linealmente proporcionales para las dos reacciones que se comparan.
(2) δΔ S 's son coincidentemente el mismo tanto para la nueva reacción bajo estudio y la reacción de referencia, y la δΔ H ' s son linealmente proporcional para que se comparan las dos reacciones.
(3) Los δΔ H y δΔ S están relacionados linealmente entre sí, tanto para la reacción de referencia como para la nueva reacción.
La tercera condición describe el efecto entalpía-entropía y es la condición que se cumple más comúnmente. [3]
Temperatura isocinética e isoequilibrio [ editar ]
Para la mayoría de las reacciones, la entalpía de activación y la entropía de activación son desconocidas, pero si estos parámetros se han medido y se encuentra que existe una relación lineal (lo que significa que se encontró que un LFER se mantuvo), la siguiente ecuación describe la relación entre Δ H ‡ i y Δ S ‡ i :
-
-
- Δ H ‡ = βΔ S ‡ + Δ H ‡ 0
-
Insertar la ecuación de energía libre de Gibbs y combinar términos semejantes produce la siguiente ecuación:
-
-
- Δ G ‡ = Δ H ‡ 0 - ( T- β) Δ S ‡
-
donde Δ H ‡ 0 es constante independientemente de los sustituyentes y Δ S ‡ es diferente para cada sustituyente.
En esta forma, β tiene la dimensión de la temperatura y se conoce como la temperatura isocinética (o isoequilibrio ) . [4]
Alternativamente, la temperatura isocinética (o equilibrio isoquímico) puede alcanzarse observando que, si se encuentra una relación lineal, entonces la diferencia entre los Δ H ‡ para cualquier reactivo estrechamente relacionado estará relacionada con la diferencia entre los Δ S ‡ 's para los mismos reactivos:
-
-
- δΔ H ‡ = βδΔ S ‡
-
Usando la ecuación de energía libre de Gibbs,
-
-
- δΔ G ‡ = (1 - T / β) δΔ S ‡
-
En ambas formas, es evidente que la diferencia en las energías libres de Gibbs de las activaciones (δΔ G ‡ ) será cero cuando la temperatura esté en la temperatura isocinética (o de equilibrio isoquímico) y, por lo tanto, idéntica para todos los miembros del conjunto de reacción a esa temperatura .
Comenzando con la ecuación de Arrhenius y asumiendo una compensación cinética (obedeciendo a ln A = Ln A 0 + αΔ E ‡ 0 ), la temperatura isocinética también puede estar dada por k B β = 1 / α. Las reacciones tendrán aproximadamente el mismo valor de su constante de velocidad k a una temperatura isocinética.
Historia [ editar ]
En un artículo de 1925, FH Constable describió la relación lineal observada para los parámetros de reacción de la deshidrogenación catalítica de alcoholes primarios con óxido de cobre-cromo . [5]
Fenómeno explicado [ editar ]
Los fundamentos del efecto de compensación aún no se comprenden completamente y se han presentado varias teorías. Se puede aplicar un modelo de ciclo de Carnot, en el que una transición de micro-fase juega un papel crucial, racionalizando los casos biológicos de compensación de entalpía-entropía en el plegamiento de proteínas y reacciones enzimáticas, entre otros procesos. [6] En la unión del receptor de drogas, se ha sugerido que la compensación de entalpia-entropía surge debido a una propiedad intrínseca de los enlaces de hidrógeno. [7]Falta una explicación mecánica estadística general, verdaderamente molecular. Una base mecánica para la compensación de entalpía-entropía inducida por solvente se ha presentado y probado en el límite de gas diluido. [8]
La crítica [ editar ]
Las relaciones cinéticas se han observado en muchos sistemas y, desde su concepción, han tenido muchos términos, entre los que se encuentran el efecto o la regla de Meyer-Neldel , [9] la regla de Barclay-Butler , [10]la regla de theta , [11] y el efecto Smith-Topley . [12] En general, los químicos hablarán sobre la relación isocinética (IKR), de la importancia de la temperatura isocinética (o isoequilibrio), los físicos de la materia condensada y los científicos de materiales que usan la regla de Meyer-Neldel, y los biólogos usarán el efecto de compensación o la regla . [13]
Aparece un problema de tarea interesante después del Capítulo 7: Relaciones estructura-reactividad en el libro de texto de Kenneth Connors Química cinética: el estudio de las tasas de reacción :
- A partir de los últimos cuatro dígitos de los números de teléfono de la oficina de la facultad en su departamento, construya sistemáticamente pares de "constantes de frecuencia" como números de dos dígitos por 10 −5 s -1 a temperaturas de 300 K y 315 K (obviamente, la mayor constante de velocidad de cada par para asociarse con la temperatura más alta). Haga una gráfica de Arrhenius de dos puntos para cada miembro de la facultad, evaluando ΔH ‡ y ΔS ‡ . Examine la gráfica de ΔH ‡ contra ΔS ‡ en busca de evidencia de una relación isocinética. [14]
La existencia de cualquier efecto de compensación real ha sido ampliamente ridiculizada en los últimos años y atribuida al análisis de factores interdependientes y al azar. Debido a que las raíces físicas aún no se han entendido por completo, se ha cuestionado si la compensación es un fenómeno verdaderamente físico o una coincidencia debida a conexiones matemáticas triviales entre parámetros. El efecto de compensación ha sido criticado en otros aspectos, principalmente por ser el resultado de errores experimentales y sistemáticos aleatorios que producen la apariencia de compensación. [15] [16] La queja principal presentada establece que la compensación es un artefacto de datos de un rango de temperatura limitado o de un rango limitado para las energías libres. [17] [18]
En respuesta a las críticas, los investigadores han enfatizado que los fenómenos compensatorios son reales, pero siempre es necesario un análisis apropiado y profundo de los datos. La prueba F se ha utilizado para este objetivo y minimiza las desviaciones de los puntos obligados a pasar a través de una temperatura isocinética a la desviación de los puntos de la línea no restringida que se logra comparando las desviaciones medias de los puntos. [19] También deben realizarse pruebas estadísticas apropiadas. [20] [21] W. Linert escribió en un artículo de 1983:
- Hay pocos temas en química en los que han surgido tantos malentendidos y controversias como en relación con la llamada relación isocinética (IKR) o ley de compensación. Hasta la fecha, una gran cantidad de químicos parecen estar inclinados a descartar que el IKR sea accidental. El problema crucial es que los parámetros de activación son mutuamente dependientes debido a su determinación a partir de los datos experimentales. Por lo tanto, se ha enfatizado repetidamente, la trama isocinética (es decir, ΔH ‡ contra S ‡ ) no es apta en principio para justificar una afirmación de una relación isocinética. Al mismo tiempo, sin embargo, es un error fatal despedir al IKR debido a esa falacia. [22]
Común entre todos los defensores es el acuerdo de que se deben cumplir criterios estrictos para la asignación de los verdaderos efectos de compensación.







No hay comentarios:
Publicar un comentario