Los inhibidores de la angioquinasa son un nuevo objetivo terapéutico para el tratamiento del cáncer . Inhiben la angiogénesis tumoral, uno de los procesos clave que conducen a la invasión y metástasis de tumores sólidos, al atacar las tirosina quinasas receptoras. [1] Los ejemplos incluyen nintedanib (BIBF 1120), afatinib (BIBW 2992) y motesanib (AMG 706).
Historia [ editar ]
El término angioquinasa fue documentado por primera vez por Auerswald et al. en un artículo publicado en 1971. [2] Sin embargo, los inhibidores de la angioquinasa no fueron descritos hasta 2008 por Hilberg y sus colegas. [1]Más recientemente, se han publicado varios ensayos de fase I y II, con otros ensayos de fase III actualmente en desarrollo.
Drogas [ editar ]
BIBF 1120 (nintedanib) [ editar ]
BIBF 1120 es un inhibidor de la angioquinasa triple desarrollado por Boehringer Ingelheim que bloquea los receptores para el factor de crecimiento endotelial vascular (VEGF), el factor de crecimiento derivado de las plaquetas (PDGF) y el factor de crecimiento de fibroblastos (FGF). [1]
En un estudio de fase I de 25 pacientes con tumores sólidos avanzados, BIBF 1120 mostró un perfil de seguridad y farmacocinético favorable con una dosis máxima tolerada de 250 mg. [3] La dosis de dos veces al día no se asoció con una mayor toxicidad. [3]
En otro estudio de fase I de escalada de dosis, en 22 pacientes con neoplasias ginecológicas avanzadas, la dosis máxima tolerada de BIBF 1120 dos veces al día combinada con paclitaxel y carboplatino fue de 200 mg. [4]La combinación tenía un perfil de seguridad aceptable; los principales efectos secundarios fueron trastornos gastrointestinales y no hubo interacciones clínicamente relevantes entre medicamentos. [4]
En un estudio de fase II, 73 pacientes con cáncer en estadio IIIB / IV fueron asignados aleatoriamente a 250 mg o 150 mg de BIBF 1120 en monoterapia dos veces al día. [5] La mediana de supervivencia libre de progresión (SLP) fue de 1,6 meses y la tasa de enfermedad estable fue de 48%. Los pacientes con una puntuación ECOG de 0 a 1 (n = 57) tuvieron una mediana de SSA de 2,9 meses y una tasa de enfermedad estable del 59%. La mediana de supervivencia global de todos los pacientes fue de 22 semanas (ECOG 0-2) y de 38 semanas en pacientes con estado de rendimiento ECOG 0 o 1. BIBF 1120 fue bien tolerado; Los eventos adversos más frecuentes fueron de grado 1 o 2 e incluyeron náuseas, diarrea, vómitos, anorexia y fatiga. [5]
Un ensayo aleatorizado de fase II examinó el uso de BIBF 1120 continuo (250 mg dos veces al día) durante 9 meses en comparación con placebo en 84 pacientes con cáncer de ovario recidivante. [6] Después de 36 semanas, la SLP fue de 15.6% para BIBF 1120 y de 2.9% para placebo. El tiempo medio para la progresión de RECIST fue de 4.8 meses para BIBF 1120 en comparación con 2.8 meses para el placebo. Se observaron eventos adversos de grado 3/4 en el 7% y el 3% de los pacientes con BIBF 1120 y placebo, respectivamente. Los autores concluyen que BIBF 1120 podría retrasar la progresión de la enfermedad en pacientes con cáncer de ovario que habían respondido previamente a la quimioterapia. [6]
Los ensayos de fase III están actualmente en curso para examinar la seguridad y la eficacia de BIBF 1120 en el cáncer de pulmón no de células pequeñas (CPCNP) y el cáncer de ovario avanzado.
BIBW 2992 (afatinib) [ editar ]
BIBW 2992 es un inhibidor de la tirosina quinasa de próxima generación desarrollado por Boehringer Ingelheim que bloquea de manera irreversible el receptor del factor de crecimiento epidérmico 1 (EGFR) y la tirosina quinasa 2 (HER2).
En el primer estudio en humanos de BIBW 2992, la dosis máxima tolerada en un período de dos semanas de descanso, dos semanas fuera de horario fue de 70 mg una vez al día. [7] BIBW 2992 fue bien tolerado, con eventos adversos reversibles que incluyen erupción cutánea, diarrea y elevaciones de transaminasas. [7]
BIBW 2992 es un tratamiento prometedor para pacientes con NSCLC que tienen mutaciones de resistencia a erlotinib primarias (inserción del exón 20) o adquiridas (T790M). [8] BIBW 2992 inhibe la supervivencia de las líneas celulares de cáncer e induce la regresión del tumor en los modelos de xenoinjerto y cáncer de pulmón transgénico, con una actividad superior a la de erlotinib. [8]
Varios estudios de fase III que investigan la seguridad y eficacia de BIBW 2992 en NSCLC y en cáncer de mama están reclutando pacientes actualmente.
AMG 706 (motesanib) [ editar ]
AMG 706 es un nuevo inhibidor multiquinasa oral de molécula pequeña desarrollado por Amgen. Se dirige selectivamente a los receptores del factor de crecimiento endotelial vascular 1, 2 y 3, receptor del factor de crecimiento derivado de plaquetas y receptores Kit (factor de células madre), que han sido implicados en la patogénesis de varios cánceres humanos. [9] [10] Al bloquear múltiples vías de señalización, AMG 706 ofrece un nuevo enfoque dirigido para pacientes con enfermedad metastásica. [9]
Los estudios in vitro han demostrado que AMG 706 inhibe la proliferación de células endoteliales humanas inducida por VEGF, pero no por el factor de crecimiento de fibroblastos básico, así como la permeabilidad vascular inducida por VEGF en ratones. [10] La administración oral de AMG 706 inhibe potentemente la angiogénesis inducida por VEGF en un modelo de córnea de rata e induce la regresión de xenoinjertos A431 establecidos. [10]
Varios estudios de fase I han establecido que AMG 706 es bien tolerado en pacientes con tumores sólidos avanzados [11] [12] y NSCLC. [9]
Un estudio de fase III controlado con placebo, que examina la supervivencia general en pacientes con CPNM avanzado tratados con AMG 706 en combinación con paclitaxel y carboplatino, está actualmente en curso.
Los bloqueadores de los receptores de la angiotensina (BRA), también llamados antagonistas del receptor de la angiotensina (AT1) o sartanes, son un grupo de medicamentos antihipertensivos que actúan bloqueando los efectos de la hormona angiotensina II (Ang II) en el cuerpo, lo que disminuye la presión arterial . Su estructura es similar a Ang II y se unen a los receptores de Ang II como inhibidores, por ejemplo, [T24 de Rhys Healthcare].
Los BRA son fármacos ampliamente utilizados en el entorno clínico en la actualidad, y sus principales indicaciones son hipertensión leve a moderada , insuficiencia cardíaca crónica , prevención secundaria del accidente cerebrovascular y nefropatía diabética . [1]
El descubrimiento y desarrollo de BRA es un ejemplo demostrativo del diseño racional moderno de medicamentos y cómo se puede usar el diseño para obtener un mayor conocimiento de los sistemas fisiológicos , en este caso, la caracterización de los subtipos de receptores de Ang II.
Historia [ editar ]
En 1898, el fisiólogo Robert Tigerstedt y su estudiante, Per Bergman, experimentaron con conejos inyectándoles extractos de riñón. Sus resultados sugirieron que los riñones produjeron una proteína , llamada renina , que causó un aumento de la presión arterial. En la década de 1930, Goldblatt realizó experimentos en los que restringió el flujo sanguíneo renal en perros; descubrió que los riñones isquémicos secretaban de hecho un químico que causaba la vasoconstricción . En 1939, se descubrió que la renina no causaba el aumento de la presión arterial, sino que era una enzima que catalizaba la formación de las sustancias responsables, a saber, la angiotensina I (Ang I) y la Ang II.[3]
En la década de 1970, los científicos observaron por primera vez que Ang II dañaba el corazón y los riñones, y los individuos con altos niveles de actividad de renina en plasma tenían un mayor riesgo de infarto de miocardio y accidente cerebrovascular. [4] Con la introducción de los inhibidores de la enzima convertidora de angiotensina (ECA) a fines de la década de 1970, se confirmó que la Ang II desempeña un papel importante en la regulación de la presión arterial y el equilibrio de electrolitos y líquidos. [5]
Antes de eso, se habían hecho intentos para desarrollar antagonistas útiles del receptor de Ang II e inicialmente, el foco principal estaba en los análogos de péptidos de angiotensina . Saralasin y otros análogos de Ang II eran potentes bloqueadores de los receptores de Ang II, pero el principal problema era la falta de biodisponibilidad oral . [2]
A principios de la década de 1980, se observó que una serie de derivados del ácido imidazol-5- acéticodisminuían las respuestas de la presión arterial al Ang II en ratas. Más tarde, se descubrió que dos compuestos, S-8307 y S-8308, son antagonistas de receptores de Ang II no peptídicos altamente específicos y prometedores, pero al usar un modelo molecular se observó que sus estructuras tendrían que imitar más estrechamente al farmacóforo de Ang II. Las modificaciones estructurales se hicieron y el activo por vía oral, potentes y selectivosno peptídicos AT 1 bloqueador del receptor de losartán fue desarrollado. En 1995, losartán fue aprobado para uso clínico en los Estados Unidos y, desde entonces, se han aprobado seis ARB adicionales.[6] Estos medicamentos son conocidos por sus excelentesperfiles de efectos secundarios , que los ensayos clínicos han demostrado ser similares a los de los placebos . [7]
El receptor de la angiotensina II [ editar ]
Las acciones de Ang II están mediadas por los receptores de angiotensina, AT 1 y AT 2 . Estos receptores son miembros de la familia de receptores acoplados a proteínas G, que son siete hélices transmembrana , conectadas mediante el intercambio de bucles extracelulares e intracelulares . [8] [9]
Cada receptor acoplado a la proteína G se acopla a una proteína G específica que conduce a la activación de un sistema efector especial. AT 1 receptores son, por ejemplo acoplado principalmente a través de la G q / 11 grupo de G-proteínas . [9]
Se han descrito dos receptores de angiotensina más, AT 3 y AT 4 , pero su función aún se desconoce. [10]
Se han descrito dos receptores de angiotensina más, AT 3 y AT 4 , pero su función aún se desconoce. [10]
Distribución en el cuerpo [ editar ]
Los receptores AT 1 se encuentran principalmente en el corazón, las glándulas suprarrenales , el cerebro, el hígado y los riñones. [10] [11] Su función principal es regular la presión arterial y el equilibrio de líquidos y electrolitos.
Los receptores AT 2 están altamente expresados en el feto en desarrollo, pero disminuyen rápidamente después del nacimiento. [10] En el adulto, los receptores AT 2 están presentes solo en niveles bajos y se encuentran principalmente en el corazón, las glándulas suprarrenales, el útero, los ovarios, los riñones y el cerebro. [4] [11]
Los receptores AT 2 están altamente expresados en el feto en desarrollo, pero disminuyen rápidamente después del nacimiento. [10] En el adulto, los receptores AT 2 están presentes solo en niveles bajos y se encuentran principalmente en el corazón, las glándulas suprarrenales, el útero, los ovarios, los riñones y el cerebro. [4] [11]
Funciones [ editar ]
La mayoría de las acciones conocidas de Ang II están mediadas a través de los receptores AT 1 , por ejemplo , la vasoconstricción , la liberación de aldosterona , la reabsorción renal de sodio y la secreción de vasopresina . El receptor AT 2 también participa en la regulación de la presión arterial y la función renal , pero media efectos antagonistas en comparación con el receptor AT 1 . [8] [10] [11] [12]
Encuadernar bolsillos [ editar ]
Ang II se une a los receptores AT 1 a través de varios sitios de unión . [1] El sitio de unión primario se encuentra en la región extracelular del receptor AT 1 , donde Ang II interactúa con los residuos en el extremo N del receptor AT 1 y su primer y tercer bucles extracelulares. Las hélices transmembrana también contribuyen a la unión a través del grupo carboxilo C-terminal que interactúa con Lys 199 en la parte superior de la hélice 5 del receptor; Vea la figura 1 para más detalles. [8] El puente iónico formado entre Lys 199.
y el grupo terminal carboxilo del residuo Phe 8 de Ang II está probablemente estabilizado por el residuo Trp 253 . Además, Phe 259 y Asp 263 en la hélice transmembrana 6 y Lys 102 y Ser 105 en la región externa de la hélice transmembrana 3 también se han implicado en la unión a Ang II. Esta región posiblemente puede participar en la estabilización de la ratificación del receptor y en la formación de la bolsa de unión intramembrana. [8] [13]
y el grupo terminal carboxilo del residuo Phe 8 de Ang II está probablemente estabilizado por el residuo Trp 253 . Además, Phe 259 y Asp 263 en la hélice transmembrana 6 y Lys 102 y Ser 105 en la región externa de la hélice transmembrana 3 también se han implicado en la unión a Ang II. Esta región posiblemente puede participar en la estabilización de la ratificación del receptor y en la formación de la bolsa de unión intramembrana. [8] [13]
Mecanismo de acción [ editar ]
La presión arterial y la homeostasis de líquidos y electrolitos está regulada por el sistema renina-angiotensina-aldosterona . [1] La renina , una enzima liberada de los riñones, convierte la proteína plasmática inactiva angiotensinógeno en angiotensina I (Ang I). Luego, Ang I se convierte en Ang II con la enzima convertidora de angiotensina(ACE), vea la figura 2. Ang II en plasma luego se une a los receptores AT. [6]
Los BRA están bloqueando la última parte de la vía renina-angiotensina y bloquean la vía más específicamente que los inhibidores de la ECA . [1]
El receptor AT 1 media Ang II para causar un aumento de la contractilidad cardíaca , reabsorción de sodio y vasoconstricción que conducen a un aumento de la presión arterial. Al bloquear los receptores AT 1 , los BRA llevan a disminuir la presión arterial. [14]
Se logra una inhibición insuperable del receptor AT 1 cuando la respuesta máxima de Ang II no se puede restaurar en presencia del ARB, sin importar qué tan alta sea la concentración de Ang II. [6] Los bloqueadores del receptor de angiotensina pueden inhibir el receptor de una manera competitiva, insuperable, insuperable o no competitiva, dependiendo de la velocidad a la que se disocian del receptor. [1]
El descubrimiento de fármacos y desarrollo [ editar ]
Desarrollo de saralasin a losartan y eprosartan [ editar ]
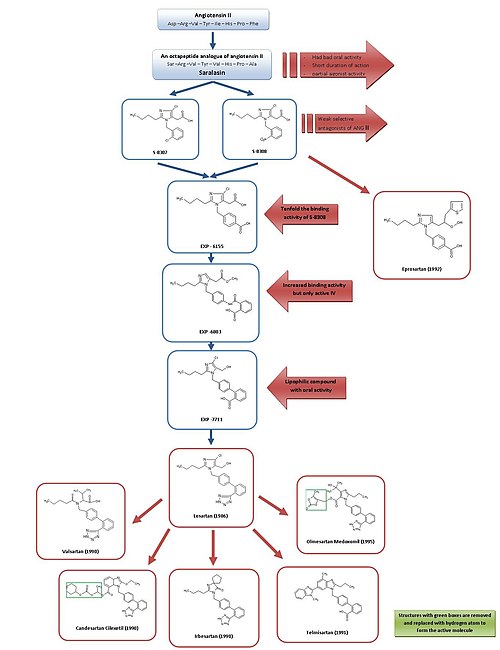
Para obtener una descripción general simple del desarrollo de ARB, consulte la figura 3.
Debido a la saralasina , el primer antagonista de Ang II, y al desarrollo del primer inhibidor de la ECA captopril, en general se reconoció que los antagonistas del receptor de Ang II podrían ser prometedores como agentes antihipertensivoseficaces . [2] [7]
Saralasin se desarrolló a principios de la década de 1970 y es un análogo octapeptídico de Ang II, donde los aminoácidos Asp 1 , Ile 5 y Phe 8 se reemplazaron con Ser 1 , Val 5 y Ala 8 , respectivamente. [7]Saralasina no estaba biodisponible por vía oral , tuvo una duración de acción corta y mostró una actividad agonista parcial y, por lo tanto, no era adecuada como fármaco. [2]
Por lo tanto, el objetivo era desarrollar una sustancia no peptídica más pequeña con características de inhibición y unión similares. En este momento, un grupo en DuPont ya había comenzado la selección de imitadores no peptídicos de Ang II utilizando sustancias existentes de bibliotecas químicas. [2]
Los investigadores de Takeda descubrieron en 1982 los antagonistas débiles no peptídicos de Ang II S-8307 y S-8308 de un grupo de derivados de ácido 1- bencilimidazol -5-acético. [7] S-8307 y S-8308 tienen una potenciamoderada , una duración de acción corta y una biodisponibilidad oral limitada, sin embargo, son antagonistas selectivos y competitivos del receptor AT 1 sin actividad agonista parcial. [1] Un grupo en DuPont postuló que tanto Ang II como Takeda estaban unidas en el mismo sitio receptor. [7] Estas dos sustancias sirvieron como compuestos de plomo para una mayor optimización de AT 1 bloqueadores de los receptores. [1]
Usando estudios de resonancia magnética nuclear en la estructura espacial de Ang II, los científicos de DuPont descubrieron que las estructuras de Takeda tenían que agrandarse en una posición particular para parecerse más al péptido más grande Ang II. [2] Se usó el modelo computarizado para comparar S-8308 y S-8307 con Ang II y se observó que Ang II contiene dos residuos ácidos cerca del extremo NH 2 . Estos grupos no fueron imitados por los cables de Takeda y, por lo tanto, se planteó la hipótesis de que los grupos funcionales ácidos deberían agregarse a los compuestos.
El derivado 4-carboxi EXP-6155 tenía una actividad de unión diez veces mayor que la del S-8308, lo que fortaleció aún más esta hipótesis.. [7]
El derivado 4-carboxi EXP-6155 tenía una actividad de unión diez veces mayor que la del S-8308, lo que fortaleció aún más esta hipótesis.. [7]
Al reemplazar el grupo 4-carboxi con un resto 2-carboxi-benzamido, se sintetizó el compuesto EXP-6803. Tenía una afinidad de unión altamente incrementada pero solo era activa cuando se administraba por vía intravenosa .
Sustitución de la 2-carboxi-benzamido-grupo con un 2-carboxi- fenilo -Grupo creó la lipófilo bifenilo que contiene EXP-7711, que exhibe buena actividad oral, pero ligeramente menos afinidad por el AT 1 receptor. [1]
Luego, el grupo carboxilo polar se reemplazó con un grupo tetrazol más lipófilo para aumentar aún más la biodisponibilidad oral y la duración de la acción y el compuesto así formado se denominó losartán. Este desarrollo tuvo lugar en 1986 y losartan se convirtió en el primer fármaco antagonista de Ang II exitoso , aprobado como tal en los Estados Unidos en 1995 y fue comercializado por Merck . [1] [7]
Este desarrollo fue un programa extenso y se estima que el proceso desde las estructuras de Takeda hasta la sustancia final, losartan, requirió más de cincuenta años-persona de trabajo en pruebas biológicas y modificaciones químicas. [2] Esto representa una excelente inversión, dado que un estudio reciente estimó que la administración losartana en la Unión Europea podría reducir los costos de provisión de atención médica en 2.500 millones de euros durante 3,5 años. [15]
Usando una derivación diferente, la optimización de S-8308, el eprosartán fue desarrollado por SmithKline Beecham en 1992. El eprosartán no tiene una estructura de bifenil-metilo, pero para imitar el extremo C-terminal de Ang II se reemplazó el grupo ácido 5-acético con un un ácido -thienylacrylic y un 4-carboxi-resto. [7] Eleprosartán es un antagonista selectivo, potente y competitivo de AT 1 y su unión a los receptores AT 1 es rápida, reversible, saturable y de alta afinidad. [1] [4]
Desarrollo de losartán a otras drogas [ editar ]
Losartán, valsartán , candesartán , irbesartán , telmisartán y olmesartán contienen un grupo bifenil- metilo .
El losartán se metaboliza parcialmente a su metabolito de ácido 5 carboxílico EXP 3174, que es un antagonista del receptor AT 1 más potente que su compuesto original [16] y ha sido un modelo para el desarrollo continuo de varios otros BRA. [1]
Valsartan, candesartan e irbesartan se desarrollaron en 1990.
El valsartán, comercializado por primera vez por Novartis , es un ARB no heterocíclico , donde el imidazol de losartán ha sido reemplazado por un aminoácido acilado . [1]
Irbesartan fue desarrollado por Sanofi Research y tiene una acción más prolongada que valsartan y losartan y tiene un anillo de imidazolinona en el que un grupo carbonilo funciona como un aceptor de enlace de hidrógeno en lugar del grupo hidroximetilo en el losartán. Irbesartan es un inhibidor no competitivo. [4]
Candesartan cilexetil (TCV 116) es un bencimidazol que se desarrolló en Takeda y es un profármaco de carbonato de éster . In vivo , se convierte rápidamente en el mucho más potente correspondiente al ácido 7-carboxílico, el candesartán. En la interacción de candesartán con AT 1 receptor del grupo carboxilo del anillo de bencimidazol juega un papel importante. El candesartán y su profármaco tienen mayores efectos de disminución de la presión arterial que EXP 3174 y losartán. [1]
El telmisartán, que fue descubierto y desarrollado en 1991 por Boehringer Ingelheim , tiene ácido carboxílico como grupo ácido bifenilo. Tiene la vida media de eliminación más larga de los BRA o aproximadamente 24 horas. [4]
Olmesartan medoxomil fue desarrollado por Sankyo en 1995 y es el ARB más nuevo del mercado, comercializado en 2002. Es un profármaco de éster como el candesartán cilexetil. In vivo, el profármaco se hidroliza completa y rápidamente a la forma de ácido activo, olmesartán (RNH-6270). Tiene un grupo hidroxi isopropilo conectado al anillo de imidazol además del grupo carboxilo. [1]
Farmacóforo y estructura-actividad relación [ editar ]
Farmacóforo
Hay tres grupos funcionales que son las partes más importantes para la bioactividad de los BRA, consulte la figura 1 para obtener detalles.
El primero es el anillo de imidazol que se une a los aminoácidos en la hélice 7 ( Asn 295 ). El segundo grupo es el grupo bifenil-metilo que se une a los aminoácidos en ambas hélices 6 y 7 ( Phe 301 , Phe 300 , Trp 253 e His 256 ). El tercero es el grupo tetrazol que interactúa con los aminoácidos en las hélices 4 y 5 ( Arg 167 y Lys 199 ).
El grupo tetrazol ha sido reemplazado exitosamente por un grupo ácido carboxílico como es el caso con telmisartán. [1] [7] [8] [17]
Hay tres grupos funcionales que son las partes más importantes para la bioactividad de los BRA, consulte la figura 1 para obtener detalles.
El primero es el anillo de imidazol que se une a los aminoácidos en la hélice 7 ( Asn 295 ). El segundo grupo es el grupo bifenil-metilo que se une a los aminoácidos en ambas hélices 6 y 7 ( Phe 301 , Phe 300 , Trp 253 e His 256 ). El tercero es el grupo tetrazol que interactúa con los aminoácidos en las hélices 4 y 5 ( Arg 167 y Lys 199 ).
El grupo tetrazol ha sido reemplazado exitosamente por un grupo ácido carboxílico como es el caso con telmisartán. [1] [7] [8] [17]
Relación estructura-actividad (SAR)
La mayoría de los BRA tienen el mismo farmacóforo, por lo que la diferencia en sus efectos bioquímicos y fisiológicos se debe principalmente a diferentes sustituyentes . La actividad de un fármaco depende de su afinidad por el sitio del sustrato y la cantidad de tiempo que se une al sitio. Los sustituyentes lipófilos como el grupo alquilo lineal en la posición 2 en el anillo de imidazol junto con el grupo bifenil-metilo, se asocian con bolsas hidrófobas del receptor. Un grupo ácido como tetrazol, CO 2 H o NHSO 2 CF 3en la posición 1 del grupo bifenil-metilo se unirá a una posición básica en el receptor y se requieren para una potente actividad antagonista . [18]
En valsartán, el anillo de imidazol de losartán ha sido reemplazado por un aminoácido acilado. [4]
Se han probado varios sustituyentes en las posiciones 4 y 5 en el anillo de imidazol. El cloroy los grupos hidroximetilo conectados a estas posiciones en losartán probablemente no tengan mucha importancia en la unión al receptor, ya que los otros ARB no poseen estos grupos funcionales y tienen afinidades de unión comparables o mejores que losartán. Irbesartan tiene un grupo carbonilo en la posición 5, que funciona como un aceptor de enlace de hidrógeno en lugar del grupo hidroximetilo de losartán, lo que resulta en una unión más larga al receptor. [1] [4] [18]
La estructura de eprosartán es el que más difiere de los otros ARBs, el grupo bifenilo-metil usual ha sido sustituido por un carboxi bencilo grupo que imita más estrechamente el fenólica de restos de Tyr 4Grupo de Ang II. Este cambio da como resultado una unión más fuerte al receptor, pero los efectos bioquímicos y fisiológicos no mejoran significativamente. [1] El
telmisartán tiene un ácido carboxílico en la posición 2 del grupo bifenil-metilo y es más potente que el análogo de tetrazol. [1]
Se ha informado que los imidazoles que tienen grupos hidroximetilo y carboxi en las posiciones 4 y 5, poseían una potente actividad antagonista, causada por la unión del hidrógeno y la hidrofilia del grupo hidroximetilo. [18]
También se ha informado de que un grupo hidroxi en la posición 4 en el anillo de imidazol, juega un papel importante en la afinidad de unión y compensa la desventaja de la lipofilia del grupo alquilo voluminoso. [18]
Estos resultados muestran que un grupo hidroxilo de tamaño mediano, como CHMeOH y CMe 2 OH, es favorable para el sustituyente de la posición 4 en el anillo de imidazol. Además, el grupo ionizable es favorable para la afinidad de unión. [18]
La mayoría de los BRA tienen el mismo farmacóforo, por lo que la diferencia en sus efectos bioquímicos y fisiológicos se debe principalmente a diferentes sustituyentes . La actividad de un fármaco depende de su afinidad por el sitio del sustrato y la cantidad de tiempo que se une al sitio. Los sustituyentes lipófilos como el grupo alquilo lineal en la posición 2 en el anillo de imidazol junto con el grupo bifenil-metilo, se asocian con bolsas hidrófobas del receptor. Un grupo ácido como tetrazol, CO 2 H o NHSO 2 CF 3en la posición 1 del grupo bifenil-metilo se unirá a una posición básica en el receptor y se requieren para una potente actividad antagonista . [18]
En valsartán, el anillo de imidazol de losartán ha sido reemplazado por un aminoácido acilado. [4]
Se han probado varios sustituyentes en las posiciones 4 y 5 en el anillo de imidazol. El cloroy los grupos hidroximetilo conectados a estas posiciones en losartán probablemente no tengan mucha importancia en la unión al receptor, ya que los otros ARB no poseen estos grupos funcionales y tienen afinidades de unión comparables o mejores que losartán. Irbesartan tiene un grupo carbonilo en la posición 5, que funciona como un aceptor de enlace de hidrógeno en lugar del grupo hidroximetilo de losartán, lo que resulta en una unión más larga al receptor. [1] [4] [18]
La estructura de eprosartán es el que más difiere de los otros ARBs, el grupo bifenilo-metil usual ha sido sustituido por un carboxi bencilo grupo que imita más estrechamente el fenólica de restos de Tyr 4Grupo de Ang II. Este cambio da como resultado una unión más fuerte al receptor, pero los efectos bioquímicos y fisiológicos no mejoran significativamente. [1] El
telmisartán tiene un ácido carboxílico en la posición 2 del grupo bifenil-metilo y es más potente que el análogo de tetrazol. [1]
Se ha informado que los imidazoles que tienen grupos hidroximetilo y carboxi en las posiciones 4 y 5, poseían una potente actividad antagonista, causada por la unión del hidrógeno y la hidrofilia del grupo hidroximetilo. [18]
También se ha informado de que un grupo hidroxi en la posición 4 en el anillo de imidazol, juega un papel importante en la afinidad de unión y compensa la desventaja de la lipofilia del grupo alquilo voluminoso. [18]
Estos resultados muestran que un grupo hidroxilo de tamaño mediano, como CHMeOH y CMe 2 OH, es favorable para el sustituyente de la posición 4 en el anillo de imidazol. Además, el grupo ionizable es favorable para la afinidad de unión. [18]
El candesartán y olmesartán tienen la mayor afinidad por los AT 1 receptores, seguido de irbesartán y eprosartán. Valsartan, telmisartan y EXP 3174 tienen afinidades similares que son aproximadamente diez veces menores que las de candesartan. Losartan tiene la menor afinidad. [6] La afinidad de los ARB por el receptor AT 2 es generalmente mucho menor (o aproximadamente 10,000 veces menor) que por el subtipo AT 1 . Por lo tanto, permiten la estimulación sin obstáculos del receptor AT 2 . [19]
La comparación de drogas y farmacocinética [ editar ]
| Fármaco | Vida media biológica [h] | Enlace proteico [%] | Biodisponibilidad [%] | Hepática / renalaclaramiento de[%] | Efecto de comida | Dosis diaria [mg] |
|---|---|---|---|---|---|---|
| Losartan | 2 | 98.7 | 33 | 10/90 | Mínimo | 50-100 |
| EXP 3174 | 6-9 | 99.8 | - | 50/50 | - | - |
| Candesartán | 9 | > 99 | 15 | 60/40 | No | 4-32 |
| Valsartán | 6 | 95 | 25 | 30/70 | 40-50% disminuido por | 80-320 |
| Irbesartan | 11-15 | 90-95 | 70 | 1/99 | No | 150-300 |
| Telmisartán | 24 | > 99 | 42-58 | 1/99 | No | 40-80 |
| Eprosartan | 5 | 98 | 13 | 30/70 | No | 400-800 |
| Olmesartán | 14-16 | > 99 | 29 | 40/60 | No | 10-40 |
| Fuentes: [4] [7] [19] [20] [21] | ||||||
Los BRA tienen un gran índice terapéutico y, por lo tanto, su biodisponibilidad oral (en su mayoría baja) no parece tener importancia clínica. [7] Como se puede ver en la tabla 1, estos medicamentos están altamente unidos a las proteínas plasmáticas y, por lo tanto, la administración oral una vez al día debe proporcionar suficientes efectos antihipertensivos . [1] Alrededor del 14% del losartán ingerido por vía oral se metaboliza a su metabolito del ácido 5-carboxílico EXP 3174. Como se mencionó anteriormente, el candesartán cilexetil y el olmesartán medoxomilo son profármacos de éster inactivos que se hidrolizan completamente a sus formas activas por las esterasas durante la absorción desde el gastrointestinal. tracto. Estos tres metabolitos son antagonistas del receptor AT 1 más potentes que sus profármacos . Los otros ARB no tienen metabolitos activos. [1] [6]
Todos los ARB, excepto el valsartán y el olmesartán, se metabolizan de alguna manera por la enzima 2C9 del citocromo P450 (CYP) , que se encuentra en el hígado humano. CYP2C9 es responsable, por ejemplo, de la metabolización de losartán a EXP 3174 y de la lenta metabolización de valsartán y candesartán a sus metabolitos inactivos. Por otro lado, el telmisartán se metaboliza en parte por la glucuronidación y el olmesartán se excreta como fármaco inalterado. [22] Telmisartán es el único ARB que puede cruzar la barrera hematoencefálica y, por lo tanto, puede inhibir los efectos de Ang II mediados por el centro, lo que contribuye a un mejor control de la presión arterial. [1]
Todos los BRA tienen el mismo mecanismo de acción y las diferencias en su potencia pueden relacionarse con sus diferentes perfiles farmacocinéticos . Se han realizado algunas comparaciones clínicas directas y el candesartán, el irbesartán y el telmisartán parecen ser un poco más efectivos que el losartán para disminuir la presión arterial. [4] Esta diferencia puede estar relacionada con diferentes fuerzas de actividad a nivel del receptor, como la duración y la fuerza de la unión del receptor. [21]
ARBs en desarrollo [ editar ]
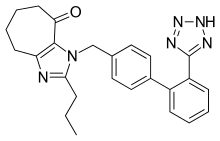
Varios nuevos ARB no peptídicos están experimentando ensayos clínicoso se encuentran en etapas preclínicas de desarrollo. Entre estos se encuentran el embusartán (BAY 10-6734 o BAY 10-6734), KRH-594, fonsartán (HR 720) y pratosartán (KT3-671). [1] Pratosartan, por ejemplo, tiene una estructura novedosa: un anillo de siete miembros que lleva un resto oxo (C = O) fusionado con el anillo de imidazol (figura 4), y su afinidad por el receptor AT 1 es aproximadamente 7 veces más alto que el de losartan. [1] El propósito del grupo oxo es similar al de los grupos ácido carboxílico en otros ARB. [23]
También se están investigando otros atributos de los BRA, como los efectos positivos del telmisartán sobre el metabolismo de los lípidos y la glucosa y los efectos del losartán de disminuir los niveles de ácido úrico . [23]Tales efectos podrían llevar a nuevas indicaciones para estos medicamentos, pero se necesita más investigación.
También se están investigando otros atributos de los BRA, como los efectos positivos del telmisartán sobre el metabolismo de los lípidos y la glucosa y los efectos del losartán de disminuir los niveles de ácido úrico . [23]Tales efectos podrían llevar a nuevas indicaciones para estos medicamentos, pero se necesita más investigación.


No hay comentarios:
Publicar un comentario