El descubrimiento de una vía oral inactivo péptido de veneno de serpiente estableció el importante papel de la enzima convertidora de angiotensina (ACE) inhibidores en la regulación de la presión arterial . Esto condujo al desarrollo de Captopril , el primer inhibidor de la ECA . Cuando los efectos adversos de captopril se hicieron evidentes, se diseñaron nuevos derivados. Luego, después del descubrimiento de dos sitios activos de ACE: dominio N y dominio C, comenzó el desarrollo de inhibidores de la ECA específicos del dominio.
El desarrollo de inhibidores de la ECA primera generación [ editar ]
El desarrollo de la nonapéptido teprotida ( Glu - Trp - Pro - Arg -Pro- Gln - Ile -Pro-Pro), que se aisló originalmente a partir del veneno de la víbora de Brasil Bothrops jararaca , aclaró en gran medida la importancia de la ACE en la hipertensión . Sin embargo, su falta de actividad oral limita su utilidad terapéutica. [3] [4]
El ácido L- bencil succínico ( ácido 2 (R) -bencil-3-carboxipropiónico) se describió como el inhibidor más potentede la carboxipeptidasa A a principios de los años ochenta. Los autores se refirieron a él como un análogo de subproducto y se propuso unirse al sitio activo de la carboxipeptidasa A a través del grupo succinilcarboxilo y un grupo carbonilo . Sus hallazgos establecieron que el ácido L-benzilsuccínico está unido a un solo lugar en el sitio activo de la carboxipeptidasa A. Los autores discutieron pero descartaron la sugerencia de que la función carboxilato podría unirse al zinc catalíticamente funcional Iones presentes en el sitio activo. Más tarde, sin embargo, este fue el caso. [3] [5] [6]
Diseño de fármaco de captopril (sulfhidrilos) [ editar ]
Más de 2000 compuestos se probaron al azar en una prueba de íleon de cobaya y se encontró que la succinil-L-prolina tiene las propiedades de un inhibidor de la ECA específico. Mostró un efecto inhibitorio de la angiotensina I y la bradiquinina sin tener ningún efecto sobre la angiotensina II . Luego, los investigadores comenzaron a buscar un modelo que explicara la inhibición sobre la base de interacciones químicas específicas de los compuestos con el sitio activo de ACE. [5]Estudios previos con sustratos e inhibidores de la ECA sugirieron que era una metaloproteína que contenía zinc y una carboxipeptidasa similar a la pancreática.carboxipeptidasa A. Sin embargo, la ECA libera dipéptidos en lugar de aminoácidos individuales del extremo C de los sustratos peptídicos . Y se asumió que tanto su mecanismo de acción como su sitio activo podrían ser similares. Se pensó que un Arg 145 cargado positivamente en el sitio activo se unía con el grupo carboxilo C-terminal cargado negativamente del sustrato peptídico. También se propuso que la ACE se une mediante enlaces de hidrógeno al enlace peptídico terminal, no escindible, del sustrato. [3]
Pero dado que ACE es una dipéptido carboxipeptidasa, a diferencia de la carboxipeptidasa A, la distancia entre el sitio de unión carboxilo catiónico y el átomo de zinc debería ser mayor, aproximadamente en la longitud de un residuo de aminoácido. La prolina se eligió como el resto de aminoácido debido a su presencia como el residuo de aminoácido carboxi terminal en teprotida y otros inhibidores de la ECA que se encuentran en los venenos de serpientes. Otros 11 aminoácidos fueron probados pero ninguno de ellos fue más inhibitorio. Así que se propuso que el derivado de succinil-aminoácido debería ser un inhibidor de la ECA y se encontró que la succinil-L-prolina es un inhibidor de este tipo. [3] [5] [7]
También se sabía que la naturaleza del penúltimo residuo de aminoácido de un sustrato peptídico para la ECA influye en la unión a la enzima. El grupo acilo del aminoácido carboxialcanoilo se une al ión zinc de la enzima y ocupa la misma posición en el sitio activo de ACE que el penúltimo. Por lo tanto, el sustituyente del grupo acilo también podría influir en la unión a la enzima. Se encontró que un sustituyente 2- metilo con configuración D aumenta la potencia inhibidora en aproximadamente 15 veces la succinil-L-prolina. Entonces comenzó la búsqueda de un mejor grupo de unión a zinc. Sustitución del grupo succinilcarboxilo por funcionalidades que contienen nitrógeno ( amina , amida).o guanidina ) no mejoró la actividad inhibitoria. Sin embargo, se logró un avance de potencia mediante el reemplazo del grupo carboxilo con una función sulfhidrilo ( SH ), un grupo con mayor afinidad por la enzima unida al ión zinc. Esto produjo un potente inhibidor que era 1000 veces más potente que la succinil-L-prolina. [3] [7] La longitud óptima de la cadena de acilo para alcanoílo mercaptose encontró que los derivados de prolina son 3-mercaptopropanoil-L-prolina, 5 veces mayor que la de los derivados de 2-mercaptoalcanoilo y 50 veces mayor que la de los derivados de 4-mercaptoalcanoilo. Entonces, el inhibidor más potente es el D-3-mercapto-2-metilpropanoil-L-prolina o Captopril. Más tarde, los investigadores compararon algunos inhibidores de mercaptoacil aminoácidos y llegaron a la conclusión de que la unión del inhibidor a la enzima implicaba un enlace de hidrógeno entre un sitio donante en la enzima y el oxígeno de la amida carbonilo, como se predijo para los sustratos. [3] [8]
Diseño de medicamentos de otros inhibidores de la ECA de primera generación [ editar ]
Los efectos adversos más comunes del captopril, la erupción cutánea y la pérdida del gusto son los mismos causados por la penicilamina quecontiene mercapto . Por lo tanto, un grupo de investigadores se propuso encontrar inhibidores de la ECA potentes y selectivos que no contendrían una función mercapto (SH) y tendrían una función quelante más débil . Volvieron a trabajar con compuestos carboxílicos y comenzaron a trabajar con N -carboximetil-dipéptidos sustituidos como estructura general (R-CHCOOH-A 1 -A 2 ). De acuerdo con investigaciones anteriores, asumieron que los iminoácidos cíclicosdaría como resultado una buena potencia si se sustituyera en el extremo carboxilo del dipéptido. Por lo tanto, la sustitución de A 2 con prolina dio buenos resultados. También señalaron que, según la especificidad de la enzima, los iminoácidos en la posición próxima al término carboxilo no darían un compuesto potente. También notable es que mediante la sustitución de R y A 1 grupos con hidrófobos y básicas residuos daría un potente compuesto. Al sustituir –NH en la estructura general, se produjo una pérdida de potencia que es consistente con la necesidad de la enzima de un –NH en la posición correspondiente sobre los sustratos. Los resultados fueron 2 inhibidores activos: enalaprilato y lisinopril . Estos compuestos tienen ambosfenilalanina en la posición R que ocupa el surco S 1 en la enzima. El resultado fue, por lo tanto, estos dos nuevos análogos tripeptídicos potentes con el grupo carboxilo coordinador de zinc: Enalaprilato y Lisinopril. [1] [9]
Descubrimiento de 2 sitios activos: dominio C y dominio N [ editar ]
La mayoría de los inhibidores de la ECA en el mercado hoy en día no son selectivos hacia los dos sitios activos de la ECA porque su unión a la enzima se basa principalmente en la fuerte interacción entre el átomo de zinc en la enzima y el fuerte grupo quelante del inhibidor. La resolución de la estructura 3D del ACE germinal, que tiene un solo sitio activo que se corresponde con el dominio C del ACE somático , ofrece un marco estructural para el enfoque de diseño basado en la estructura. Aunque los dominios N y C tienen tasas comparables in vitro de hidrolización de ACE, parece que in vivoEl dominio C es el principal responsable de regular la presión arterial. Esto indica que los inhibidores selectivos del dominio C podrían tener un perfil similar al de los inhibidores no selectivos actuales. La angiotensina I se hidroliza principalmente por el dominio C in vivo, pero la bradicinina se hidroliza por ambos sitios activos. Por lo tanto, desarrollar un inhibidor selectivo del dominio C permitiría cierta degradación de la bradicinina por el dominio N y esta degradación podría ser suficiente para evitar la acumulación del exceso de bradicinina que se ha observado durante los ataques de angioedema . La inhibición selectiva del dominio C podría resultar en un control especializado de la presión arterial con menos vasodilatadorEfectos adversos relacionados. Los inhibidores selectivos del dominio N, por otro lado, ofrecen la posibilidad de abrir nuevas áreas terapéuticas. Aparentemente, el dominio N no tiene un papel importante en el control de la presión arterial, pero parece ser la principal enzima metabolizadora de AcSDKP, una hormonahemoleguladora natural . [1] [10] [11]
Diseño de fármacos de Keto-ACE y sus derivados de cetometileno [ editar ]
Se encontró que otros grupos que contienen carbonilo, como las cetonas, podrían sustituir al enlace amida que une a Phe y Gly en los inhibidores de la ECA. Keto-ACE, descrito por primera vez en 1980, se ha convertido en un potencial compuesto potencial para los inhibidores de la ECA específicos del dominio C. Keto-ACE, un tripéptido análogo de Phe-Gly-Pro, contiene un voluminoso P 1 y P 2 bencil anillo y ha demostrado inhibir la hidrólisis de la angiotensina I y la bradiquinina a través de la C-dominio. La síntesis de los análogos de ceto-ACE con Trp o Phe en la posición P 2 'condujo a un aumento marcado en la selectividad del dominio C , pero la introducción de un P 2 alifáticoGrupo de selectividad de dominio N conferido. La potencia inhibidora puede potenciarse adicionalmente mediante la incorporación de sustituyentes hidrófobos, tales como el grupo fenilo en la posición P 1 '. También se ha demostrado que el sustituyente P 1 'con estereoquímica S posee una potencia inhibitoria mayor que sus contrapartes R. [2] [8] [12] [13]
Se utilizó Keto-ACE como base para el diseño de derivados de cetometileno. Sus análogos contienen una cetometileno isóstero de reemplazo en el enlace escindible que se cree que imitar el tetraedro estado de transición de la proteolítica de reacción en el sitio activo. La atención se centró en un tripéptido simple Phe-Ala-Pro, que en ensayos enzimáticos anteriores ha mostrado actividad de inhibición. El reemplazo de alanina con glicina dio un tripéptido con 1/14 de la actividad de inhibición de Phe-Ala-Pro. El derivado benzoilado de Phe-Gly-Pro, Bz-Phe-Gly-Pro, fue dos veces más activo. Para reducir la naturaleza peptídica de los inhibidores de ketometileno, el P 1 'y el P 2El sustituyente se puede ciclar para formar una lactama , donde existe una correlación entre la potencia inhibitoria y el tamaño del anillo. En 2001 se postuló que una sustitución α por nitrógeno y la fabricación del análogo 3-metil sustituido de A58365A, un ácido piridona aislado del caldo de fermentación de la bacteria Streptomyces chromofuscus con actividad inhibidora de la ECA, podría influir en el nivel de actividad biológica por estérico o efecto hidrofóbico , y / o previniendo reacciones en C3. También se notó durante el trabajo sintético en A58365A que el precursor potencialeran sensibles a la oxidación del anillo de cinco miembros y, por lo tanto, el análogo 3-metilo podría ser más estable a este respecto. [2] [14] [15]
El diseño de fármacos de silanediol [ editar ]
El hecho de que el carbono y la silicona tienen características similares, pero también diferentes, desencadenó el interés en sustituir el carbono con silanediol como grupo central quelante de zinc. La silicona forma un compuesto de dialquilsilanodiol que está suficientemente impedido para que no se forme un polímero de siloxano. Los silanedioles son más estables que los dioles de carbono , por lo que se espera que tengan una vida mediamás larga . También los silanedioles son neutros a pH fisiológico (no ionizan ). Cuatro estereoisomerosde Phe-Ala se comparó silanediol con inhibidores basados en la cetona y se encontró que el silanediol es cuatro veces menos potente que el análogo de la cetona. Esto se debe a que los silanedioles son quelantes de zinc más débiles en comparación con las cetonas. El reemplazo del silanediol con un grupo metilsilano dio poca inhibición de la enzima . Esto confirma que el grupo silanediol interactúa con la ECA como un análogo del estado de transición y la interacción es similar a la de la cetona. [16] [17] Si el grupo bencilo del silanediol se reemplaza por un grupo i- butilo , se obtiene un inhibidor de la ECA más débil. La introducción de un metil fenilo hidrofóbico da un poco más de potencia que un análogo con un grupo terc-butilo en P 1. Eso sugiere que el metilfenilo da un mejor reconocimiento de S1 que un grupo terc-butilo. [2]
Péptidos fosfínicos [ editar ]
Los péptidos fosfínicos son pseudopéptidos en los que un enlace de ácido fosfínico (PO 2 -CH-) ha reemplazado un enlace peptídico en la secuencia de análogos de péptidos. Hasta cierto punto, la estructura química de los péptidos fosfínicos es similar a la de los intermedios que se producen en la hidrólisis de los péptidos mediante enzimas proteolíticas. Se ha establecido la hipótesis de que estos pseudopéptidos imitan la estructura de los sustratos enzimáticos en su estado de transición y la cristalografía de las proteasas de zinc en complejos con péptidos fosfínicos respalda esa hipótesis. [10]
Diseño de drogas de RXP 407 [ editar ]
RXP 407 es el primer péptido fosfínico selectivo del dominio N y se descubrió seleccionando bibliotecas de péptidos fosfínicos. Antes del descubrimiento de RXP 407, durante mucho tiempo se había afirmado que el grupo carboxilato C-terminal libre en la posición P 2 'era esencial para la potencia del inhibidor de la ECA, por lo que se puede razonar que esto ha pospuesto el descubrimiento de los inhibidores de la ECA selectivos del dominio N . Cuando se descubrió RXP 407, los investigadores observaron los péptidos fosfínicos con 3 fórmulas generales diferentes, cada una con 2 aminoácidos no identificados, solo 1 de estas fórmulas generales mostró una potente inhibición (Ac-Yaa-Pheψ (PO 2 -CH 2 ) Ala-Yaa'- NH 2). Se hicieron mezclas de péptidos, sustituyendo a Yaa y Yaa 'con diferentes aminoácidos, tratando de establecer si habría un inhibidor potente que pudiera inhibir el dominio N o el dominio C de la enzima. El resultado fue que el compuesto Ac- Asp (L) -Pheψ (PO 2 -CH 2 ) (L) Ala-Ala-NH 2 inhibió activamente el dominio N y recibió el nombre de RXP 407. La relación estructura-función mostró que el grupo carboxamida C-terminal desempeñó un papel crucial en la selectividad para el dominio N de ACE. Además, el grupo N-acetilo y la cadena lateral aspártica en el P 2Los ayudantes de posición en la selectividad del N-dominio del inhibidor. Estas características hacen que el inhibidor sea inaccesible para el dominio C, pero le da una buena potencia para el dominio N, lo que conduce a una diferencia en la potencia inhibitoria de los sitios activos de tres órdenes de magnitud. Estos resultados también indican que el dominio N posee una selectividad más amplia que el dominio C. Otra diferencia entre los inhibidores de la ECA más antiguos y el RXP 407 es el tamaño molecular del compuesto. La mayoría de los inhibidores de la ECA más antiguos habían estado interactuando con los subsitios S 1 ', S 2 ' y S 1, pero RXP 407 interactúa además con el S 2subsitio Esto también es importante para la selectividad del inhibidor, ya que la cadena lateral aspártica y el grupo N-acetilo están ubicados en la posición P 2 . [18]
Diseño de fármacos de RXPA 380 [ editar ]
RXPA380 fue el primer inhibidor que fue altamente selectivo del dominio C de ACE, tiene la fórmula Phe-Phe-Pro-Trp. [1] El desarrollo de este compuesto se basó en investigaciones que mostraron que algunos péptidos potenciadores de bradiquinina mostraron selectividad por el dominio C y todos tenían varias prolinas en su estructura. Estas observaciones llevan a los investigadores a sintetizar péptidos fosfínicos que contienen un residuo de prolina en la posición P 1 'y la evaluación de estos compuestos condujo al descubrimiento de RXPA380. [19] Para estudiar las funciones de los residuos en RXPA380, los investigadores crearon 7 análogos de RXPA380. Todos los compuestos fabricados se obtuvieron como una mezcla de 2 o 4 diastereoisómeros.pero todos se resolvieron fácilmente y solo uno era potente. Esto es consistente con los estudios de modelado iniciales de RXPA380 que mostraron que solo un diastereómero podría acomodarse en el sitio activo de la ECA germinal. Los análogos en los que se habían sustituido los residuos de pseudo-prolina o triptófano mostraron menos selectividad que el RXPA380. Probablemente esto se deba a que estos dos análogos tienen más potencia hacia el dominio N que RXPA380. Sustituir ambos de estos residuos da una gran potencia pero ninguna selectividad. Esto muestra que los residuos de pseudo-prolina y triptófano se acomodan bien en el dominio C pero no en el dominio N. 2 análogos más con pseudo-prolina y triptófano pero sin el residuo de pseudo-fenilalanina en P 1La posición mostró una potencia baja para el dominio N, similar a RXPA380. Esto apoya el papel significativo de estos dos residuos en la selectividad para el dominio C. Estos dos análogos también tienen menos potencia para el C-dominio que muestra que el C-dominio prefiere grupo pseudo-fenilalanina en P 1posición. El modelado del complejo RXPA380-ACE mostró que el residuo de pseudo-prolina del inhibidor estaba rodeado de aminoácidos similares a los del dominio N, por lo que las interacciones con S 2'dominio puede no ser responsable de la selectividad de RXPA380. 7 de los 12 aminoácidos que rodean el triptófano son los mismos en los dominios C y N, la mayor diferencia es que 2 aminoácidos voluminosos e hidrófobos en el dominio C se reemplazaron con 2 aminoácidos más pequeños y polares en el dominio N. Esto indica que la baja potencia de RXPA380 para el dominio N no se debe a que la cavidad S 2 'no se acomoda a la cadena lateral del triptófano, sino que faltan interacciones importantes entre la cadena lateral del triptófano y los aminoácidos del dominio C. en la proximidad entre la cadena lateral de triptófano y Asp 1029 hay un posible enlace de hidrógeno entre el carboxilato de Asp 1029 y el indol NHsuena en el dominio C, pero esta interacción es mucho más débil en el dominio N.
La anabaseína (3,4,5,6-tetrahidro-2,3'-bipiridina) es una toxina alcaloide producida por las hormigas Nemertines y Aphaenogaster . [1] Es estructuralmente similar a la nicotina y la anabasina . [2] De manera similar, se ha demostrado que actúa como un agonista en la mayoría de los receptores nicotínicos de acetilcolina en el sistema nervioso central y en el sistema nervioso periférico .
Mecanismo de acción [ editar ]
La forma de iminio de la anabaseína se une a la mayoría de los receptores nicotínicos de acetilcolina tanto en el sistema nervioso periférico como en el sistema nervioso central. Pero, existe una mayor afinidad de unión por los receptores en el cerebro con una subunidad α7, así como los receptores de músculo esquelético. [3] La unión causa la despolarización de las neuronas e induce la liberación de dopamina y norepinefrina . [2]
Efectos biológicos [ editar ]
La anabaseína causa parálisis en crustáceos e insectos , pero no en vertebrados , presumiblemente al actuar como agonista en los receptores de acetilcolina nicotínicos neuromusculares periféricos. [2]
Estructura [ editar ]
La molécula de anabaseína consiste en un anillo de tetrahidropiridina no aromático conectado al 3er carbono de un anillo de 3 piridilo . Puede existir en tres formas a pH fisiológico: una estructura de cetona , imina o iminio . [2]Debido a la conjugación entre la imina y el anillo 3-piridilo, la anabaseína existe como una molécula casi coplanar.
Síntesis [ editar ]
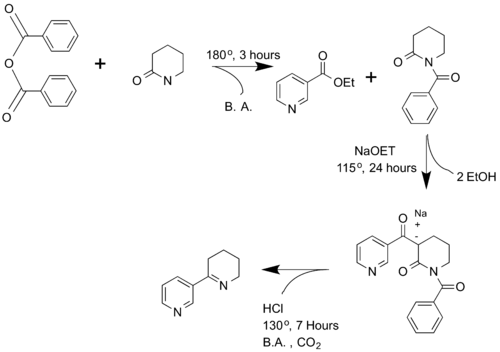
Spath y Mamoli sintetizaron por primera vez la anabaseína en 1936. [4] Los investigadores reaccionaron con anhídrido benzoico con val- valerolactama para producir N -benzoilpiperidona. Luego, la N -benzoilpiperidona se hace reaccionar con el éster etílico del ácido nicotínico para producir α-nicotinoil- N -benzoil-2-piperidona. Este producto luego se descarboxila , sufre un cierre de anillo y se hidroliza la amida para formar anabaseína.
Bloom ha desarrollado estrategias sintéticas adicionales, [5] Zoltewicz, [6] Smith, [7] y Villemin. [8]
Derivados [ editar ]
Debido a la unión bastante inespecífica de la anabaseína a los receptores nicotínicos de acetilcolina, la molécula se descartó en gran medida como una herramienta útil en investigación o medicina. Sin embargo, los derivados de anabaseína se han identificado con un perfil de unión α7 más selectivo. Uno de estos derivados ( GTS-21 , 3- (2,4-dimetoxibencilideno) -anabaseina) se ha estudiado como un fármaco candidato para los déficits cognitivos y de memoria, particularmente asociado con la esquizofrenia ; Se ha estudiado en ensayos clínicos de fase II sin progresión a la fase III. [9] Además, la modificación del núcleo de anabaseina piridina condujo a la obtención de nuevos derivados dotados de unión y selectividad funcional para el subtipo del receptor nicotínico de acetilcolina α3β4.
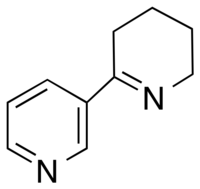 | |
| Los nombres | |
|---|---|
| Otros nombres
3,4,5,6-tetrahidro-2,3'-bipiridina
| |
| Identificadores | |
| CHEBI | |
| ChemSpider | |
| KEGG | |
PubChem CID
| |
| UNII | |
| Propiedades | |
| C 10 H 12 N 2 | |
| Masa molar | 160.220 g · mol −1 |
| Apariencia | Petróleo |
| Olor | Inodoro |
| Punto de ebullición | 110-120 ℃ |
Excepto donde se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa).
| |


No hay comentarios:
Publicar un comentario