Los inhibidores directos de la trombina (DTI, por sus siglas en inglés) son una clase demedicamentosanticoagulantes que se pueden usar para prevenir y tratar las embolias y los coágulos de sangre causados por diversas enfermedades . Inhiben la trombina , una serina proteasa que afecta a lacascada de coagulación de muchas maneras. Los DTI han experimentado un rápido desarrollo desde los años 90. Con los avances tecnológicos en ingeniería genética, la producción de hirudina recombinantefue posible, lo que abrió las puertas a este nuevo grupo de medicamentos. Antes del uso de DTIs la terapia y profilaxis.para la anticoagulación se había mantenido igual durante más de 50 años con el uso de derivados de heparina y warfarina que tienen algunas desventajas bien conocidas. Los DTI aún están en desarrollo, pero el enfoque de la investigación se ha desplazado hacia los inhibidores del factor Xa , o incluso a los inhibidores de la trombina dual y fXa que tienen un mecanismo de acción más amplio al inhibir el factor IIa (trombina) y Xa . Una revisión reciente de las patentes y la literatura sobre los inhibidores de la trombina ha demostrado que el desarrollo de inhibidores alostéricos y de múltiples mecanismos podría abrir el camino hacia un anticoagulante más seguro.
Historia [ editar ]
La terapia de anticoagulación tiene una larga historia. En 1884, John Berry Haycraftdescribió una sustancia encontrada en la saliva de las sanguijuelas, Hirudo medicinalis , que tenía efectos anticoagulantes. Nombró la sustancia ' Hirudine ' del nombre latino. El uso de sanguijuelas medicinales puede remontarse hasta el antiguo Egipto. [2] A principios del siglo XX, Jay McLean, L. Emmet Holt Jr. y William Henry Howell descubrieron la heparinaanticoagulante , que aislaron del hígado (hepar). [3] La heparina sigue siendo uno de los anticoagulantes más efectivos y aún se usa en la actualidad, aunque tiene sus desventajas, como la necesidad de administración intravenosa.Administración y con una curva de dosis-respuesta variable debido a la unión sustancial de proteínas. [4] En la década de 1980 se desarrollaron heparina de bajo peso molecular (HBPM). Se derivan de la heparina por despolimerización enzimática o química y tienen mejores propiedades farmacocinéticas que la heparina. [5] En 1955 se reportó el primer uso clínico de warfarina , un antagonista de la vitamina K. La warfarina se usó originalmente como veneno para ratas en 1948 y se pensó que no era segura para los humanos, pero un intento de suicidio sugirió que era relativamente seguro para los humanos. Los antagonistas de la vitamina K son los anticoagulantes orales más utilizados hoy en día y la warfarina fue el undécimo medicamento más recetado en los Estados Unidos en 1999.[3] y en realidad es el anticoagulante oral más recetado en todo el mundo. [6] Sin embargo, la warfarina tiene sus desventajas, al igual que la heparina, como un índice terapéutico estrechoy múltiples interacciones entre alimentos y medicamentos,y requiere un monitoreo de anticoagulación de rutina y un ajuste de la dosis. [4] [7] Debido a que tanto la heparina como la warfarina tienen sus inconvenientes, la búsqueda de anticoagulantes alternativos ha sido constante y los DTI se están revelando como competidores valiosos. El primer DTI fue en realidad hirudina, que se hizo más fácilmente disponible con la ingeniería genética.. Ahora está disponible en forma recombinante como lepirudina (Refludan) y desirudina (Revasc, Iprivask). El desarrollo de otros DTI siguió con el análogo de hirudina, la bivalirudina y luego los pequeños DTI moleculares. [4] Sin embargo, dichos DTI también tenían efectos secundarios como complicaciones hemorrágicas y toxicidad hepática, y sus efectos a largo plazo estaban en duda.
Mecanismo de acción [ editar ]
Coagulación de la sangre cascada [ editar ]
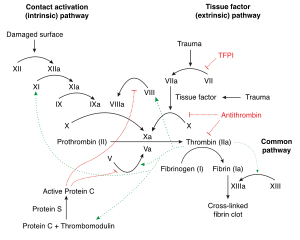
Cuando un vaso sanguíneo se rompe o se lesiona, el factor VII entra en contacto con factores tisulares que inician un proceso llamado cascada de coagulación de la sangre . Su propósito es detener el sangrado y reparar el daño tisular. Cuando este proceso es demasiado activo debido a diversos problemas, aumenta el riesgo de coágulos de sangre o embolias . Como su nombre indica, la cascada es un procedimiento de varios pasos en el que la trombina se fabrica mediante la activación de varias proenzimas(principalmente serina proteasas) en cada paso de la cascada. La trombina tiene múltiples propósitos, pero principalmente convierte el fibrinógeno soluble en un insolublecomplejo de fibrina . [8] Además, activa los factores V , VIII y XI , todos al dividir las secuencias GlyGlyGlyVly Arg-Gly Pro y PhePheSerAla Arg-Gly His, selectivamente entre Arginine (Arg) y Glycine (Gly). [9] Estos factores generan más trombina. La trombina también activa el factor XIII que estabiliza el complejo de fibrina y, por lo tanto, el coágulo y estimula las plaquetas , lo que ayuda a la coagulación. Dada esta amplia acción de la trombina, se erige como un buen objetivo farmacológico.para medicamentos anticoagulantes como la heparina, warfarina y DTI y medicamentos antiplaquetarios como la aspirina. [8] [10] [11]
Sitios de encuadernación [ editar ]
La trombina está en la familia de la serina proteasa . Tiene 3 dominios de unión a los que se unen los fármacos inhibidores de la trombina. Esas proteasas tienen un espacio estrecho y profundo como un sitio de unión activoque consiste en dos subdominios de barril β que forman el espacio de la superficie que se une a los péptidos del sustrato . La superficie en la brecha parece tener un acceso limitado a las moléculas por el impedimento estérico, este sitio de unión consta de 3 aminoácidos, Asp -102, His -57 y Ser- 195. [9] [12] La trombina también tiene dos exositos(1 y 2). La trombina es un poco diferente de otras serina proteasas ya que el exosito 1 se une a los aniones y se une a la fibrina y otros sustratos similares, mientras que el exosito 2 es un dominio de unión a la heparina. [8] [9]
Inhibición DTIs [ editar ]
.
Los DTI inhiben la trombina de dos maneras; los DTI bivalentes bloquean simultáneamente el sitio activo y el sitio 1 y actúan como inhibidores competitivos de la fibrina, [13] mientras que los DTI univalentes bloquean solo el sitio activo y, por lo tanto, pueden inhibir la trombina no unida y la fibrina. En contraste, los fármacos de heparina se unen en el exosito 2 y forman un puente entre la trombina y la antitrombina , un sustrato anticoagulante natural formado en el cuerpo, y cataliza fuertemente su función. Pero la heparina también puede formar un puente entre la trombina y la fibrina que se une al exosito 1 que protege a la trombina de la función inhibidora del complejo heparina-antitrombina y aumenta la afinidad de la trombina con la fibrina. [8]Los DTI que se unen al sitio de unión a aniones han demostrado que inactivan la trombina sin desconectar la trombina de la fibrina, lo que apunta a un sitio de unión separado para la fibrina. [12] Los DTI no dependen de cofactores como la antitrombina para inhibir la trombina, por lo que pueden inhibir tanto la trombina libre / soluble como la trombina unida a la fibrina a diferencia de las heparinas. [10] La inhibición es irreversible o reversible. La inhibición reversible a menudo está relacionada con un menor riesgo de sangrado. Debido a esta acción de los DTI, se pueden usar tanto para la profilaxis como para el tratamiento de embolias / coágulos. [8] [10]
Bolsillos del sitio activo [ editar ]
Los DTI que encajan en el sitio de unión activa tienen que encajar en la bolsa hidrófoba (S1) que contiene un residuo de ácido aspártico en la parte inferior que reconoce la cadena lateral básica. El sitio S2 tiene un bucle alrededor del triptófano que ocluye una bolsa hidrófoba que puede reconocer residuos alifáticos más grandes . El sitio S3 es plano y el sitio S4 es hidrófobo, tiene triptófano revestido por leucina e isoleucina . [9]
Nα- (2-naftil-sulfonil-glicil) -DL-p-amidinofenilalanil-piperidina (NAPAP) se une a la trombina en los bolsillos S1, S2 y S4. El grupo amidina en NAPAP forma un puente salino bidentado con Asp en el bolsillo S1, el grupo de piperidina asume el papel de residuo de prolina y se une en el bolsillo S2, y los anillos de naftilo de la molécula forman una interacción hidrofóbica con Trp en el S4. bolsillo. Las compañías farmacéuticas han utilizado el conocimiento estructural de NAPAP para desarrollar DTI. Dabigatran, al igual que NAPAP, se une a los bolsillos S1, S2 y S4. El grupo de benzamidina en la estructura de dabigatrán se une profundamente en el bolsillo S1, el metilbenzimidazolencaja perfectamente en el bolsillo hidrófobo S2 y la Ile y Leu en la parte inferior del bolsillo S4 se une al grupo aromático de dabigatrán. [9]
Desarrollo de fármacos [ editar ]
Derivados de hirudina [ editar ]
Los derivados de hirudina son todos DTI bivalentes, bloquean tanto el sitio activo como el sitio 1 en un complejo estequiométrico 1: 1 irreversible . [4] El sitio activo es el sitio de unión para el dominio amino-terminal globular y el exosito 1 es el sitio de unión para el dominio carboxi-terminal ácido de la hirudina. [14] La hirudina nativa, un polipéptido de 65 aminoácidos , se produce en las glándulas parafaríngeas de las sanguijuelas medicinales. [15] Hoy en día, las hirudinas se producen mediante biotecnología recombinante con levadura. Estas hirudinas recombinantes carecen de un grupo sulfato en Tyr-63 y, por lo tanto, se llaman desulfatohirudinas. Tienen 10 veces menos.afinidad de unión a la trombina en comparación con la hirudina nativa, pero sigue siendo un inhibidor altamente específico de la trombina y tiene una constante de inhibición para la trombina en el rango picomolar. [14] [15] El aclaramiento renal y la degradación representan en su mayor parte el aclaramiento sistémico de las desulfatohirudinas y existe una acumulación del fármaco en pacientes con insuficiencia renal . Estos medicamentos no deben usarse en pacientes con insuficiencia renal, ya que no hay un antídoto específico disponible para revertir los efectos. [14] Las hirudinas se administran por vía parenteral , generalmente por inyección intravenosa. El 80% de la hirudina se distribuye en el compartimento extravascular.y solo el 20% se encuentra en el plasma . Las desulfatohirudinas más comunes en la actualidad son la lepirudina y la desirudina. [15]
Hirudin [ editar ]
En un metaanálisis de 11 ensayos aleatorios con hirudina y otros DTI versus heparina en el tratamiento del síndrome coronario agudo (SCA), se encontró que la hirudina tiene una incidencia significativamente mayor de hemorragia en comparación con la heparina. Hirudin no se recomienda para el tratamiento de la SCA y actualmente no tiene indicaciones clínicas. [4]
Lepirudina [ editar ]
La lepirudina está aprobada para el tratamiento de la trombocitopenia inducida por heparina (HIT) en los Estados Unidos, Canadá, Europa y Australia. El HIT es un evento adverso muy serio relacionado con la heparina y ocurre tanto con heparina no fraccionada como con HBPM, aunque en menor medida con la última. Es una complicación protrombótica mediada inmune que resulta de una respuesta inmune activadora de plaquetas desencadenada por la interacción de la heparina con el factor 4 plaquetario (PF4). [16] El complejo de heparina PF4 puede activar las plaquetas y puede causar trombosis venosa y arterial. [8] Cuando la lepirudina se une a la trombina, obstaculiza su actividad protrombótica. [16] Tres estudios prospectivos., llamada heparina asociada a trombocitopenia (HAT) 1,2 y 3, se realizaron comparaciones de lepirudina con controles históricos en el tratamiento de HIT. Los tres estudios mostraron que el riesgo de nueva trombosis se redujo con el uso de lepirudina, pero el riesgo de hemorragia mayor aumentó. [15] Se cree que la mayor incidencia de hemorragia mayor es el resultado de un régimen de dosificación aprobado que fue demasiado alto, por lo que la dosis recomendada se redujo a la mitad desde la dosis inicial. [4] A partir de mayo de 2012, Bayer HealthCare , el único fabricante de inyecciones de lepirudina, suspendió su producción. Esperan que los suministros de los mayoristas se agoten a mediados de 2013. [17]
Desirudin [ editar ]
La desirudina está aprobada para el tratamiento del tromboembolismo venoso (TEV) en Europa y actualmente se están realizando múltiples ensayos de fase III en los EE. UU. [4] Se realizaron dos estudios que compararon la desirudina con la enoxaparina (una LMWH) o la heparina no fraccionada. En ambos estudios, se consideró que la desirudina era superior en la prevención del TEV. La desirudina también redujo la tasa de trombosis venosa profunda proximal . Las tasas de sangrado fueron similares con desirudina y heparina. [4] [8]
Bivalirudina [ editar ]
La bivalirudina , un polipéptido de 20 aminoácidos, es un análogosintético de la hirudina. Al igual que las hirudinas, también es un DTI bivalente. Tiene un dominio D-Phe-Pro-Arg-Pro amino-terminal que está vinculado a través de cuatro residuos Gly a un dodecapéptidoAnálogo del terminal carboxi de la hirudina. El dominio amino-terminal se une al sitio activo y el dominio carboxi-terminal se une a exosite 1 en trombina. A diferencia de las hirudinas, una vez que la trombina unida corta el enlace Arg-Pro en el extremo amino de la bivalirudina y, como resultado, restaura las funciones al sitio activo de la enzima. Aunque el dominio carboxi-terminal de la bivalirudina aún está unido al exosito 1 en la trombina, la afinidad del enlace disminuye después de que se libera el terminal amino. Esto permite que los sustratos subestartes compitan con la bivalirudina escindida para acceder al exosito 1 en la trombina. [14]El uso de bivalirudina se ha estudiado principalmente en el contexto del síndrome coronario agudo. Algunos estudios indican que la bivalirudina no es inferior a la heparina y que la bivalirudina se asocia con una menor tasa de sangrado. [4] A diferencia de las hirudinas, la bivalirudina solo se excreta parcialmente (alrededor del 20%) de los riñones, otros sitios como el metabolismo hepático y la proteólisis también contribuyen a su metabolismo, lo que hace que sea más seguro de usar en pacientes con insuficiencia renal; sin embargo, se necesitan ajustes de dosis en la insuficiencia renal grave. [8] [16]
Inhibidores directos de la trombina moleculares pequeños [ editar ]
Los inhibidores de la trombina directa molecular pequeña (smDTI) son moléculas pequeñas no peptídicas que inhiben específica y reversiblemente la trombina tanto unida al coágulo como la unión al sitio activo de la molécula de trombina. Evitan TEV en pacientes sometidos cadera y prótesis de rodilla de la cirugía. [10] Las ventajas de este tipo de DTI son que no necesitan monitoreo, tienen un amplio índice terapéutico y la posibilidad de administración oral . Son teóricamente más convenientes que el antagonista de la vitamina K y la LMWH. Sin embargo, las investigaciones deberán mostrar la indicación del uso y su seguridad. [18]
Los smDTI se obtuvieron utilizando un diseño peptidomimético con un residuo P1 de la propia arginina (por ejemplo, argatroban) o sustratos similares a la arginina, como la benzamidina (por ejemplo, NAPAP). [9]
Argatroban [ editar ]
Argatroban es un pequeño DTI univalente formado por el residuo P1 de la arginina. Se une al sitio activo de la trombina. [10] La estructura cristalina de rayos X muestra que el anillo de piperidina se une en el bolsillo S2 y el grupo guanidina se une con enlaces de hidrógeno con Asp189 en el bolsillo S1. Se administra como un bolo intravenoso porque la guanidina altamente básica con pKa 13 evita que sea absorbida por el tracto gastrointestinal . [19] La vida media plasmática es de aproximadamente 45 minutos. Como argatroban se metaboliza por vía hepática y se excreta principalmente a través del sistema biliar.Los ajustes de dosis son necesarios en pacientes con insuficiencia hepática pero no daño renal. Argatroban ha sido aprobado en los EE. UU. Desde 2000 para el tratamiento de la trombosis en pacientes con HIT y 2002 para la anticoagulación en pacientes con antecedentes de HIT o con riesgo de HIT sometidos a intervenciones coronarias percutáneas (PCI). [10] [19] Fue introducido por primera vez en Japón en 1990 para el tratamiento de trastornos vasculares periféricos. [19]
Ximelagatran [ editar ]
La publicación de la estructura cristalina de NAPAP-fIIa provocó muchas investigaciones sobre los inhibidores de la trombina. NAPAP es un inhibidor de trombina de sitio activo. Llena los bolsillos S3 y S2 con sus grupos naftalina y piperidina . AstraZeneca usó la información para desarrollar melagatran. El compuesto estaba escasamente disponible por vía oral, pero después de la renovación obtuvieron un doble profármaco que fue el primer DTI oral en ensayos clínicos , el ximelagatrán . [9] Ximelagatran estuvo en el mercado europeo durante aproximadamente 20 meses cuando fue suspendido. Los estudios mostraron que el tratamiento durante más de 35 días estaba relacionado con el riesgo de toxicidad hepática. [18] Nunca fue aprobado por la FDA . [20]
Dabigatran etexilate [ editar ]
Los investigadores de Boehringer Ingelheim también utilizaron la información publicada sobre la estructura cristalina de NAPAP-fIIa, comenzando con la estructura de NAPAP que condujo al descubrimiento de dabigatrán , [9] que es un compuesto muy polar y, por lo tanto, no está activo por vía oral. Al enmascarar el resto de amidiniocomo un éster de carbamato y convertir el carboxilato en un éster , fueron capaces de producir un profármaco llamado dabigatran etexilato, [21] un profármaco altamente lipofílico , de absorción gastrointestinal y biodisponible por vía oral, como ximelagatran, con la mitad de plasma. -vidade aproximadamente 12 horas. [9] Dabigatran etexilate se absorbe rápidamente , carece de interacción con las enzimas del citocromo P450 y con otros alimentos y medicamentos, no es necesario realizar un monitoreo de rutina y tiene un índice terapéutico amplio y una administración de dosis fija, lo cual es una seguridad excelente en comparación con warfarina [4] A diferencia del ximelagatrán, un tratamiento a largo plazo del etexilato de dabigatrán no se ha relacionado con la toxicidad hepática, ya que los riñones eliminan el fármaco de forma predominante (> 80%). Dabigatran etexilate fue aprobado en Canadá y Europa en 2008 para la prevención del TEV en pacientes sometidos a cirugía de cadera y rodilla. En octubre de 2010, la FDA de los Estados Unidos aprobó dabigatran etexilate para la prevención deictusen pacientes con fibrilación auricular (FA). [6] [10] Muchas compañías farmacéuticas han intentado desarrollar medicamentos DTI biodisponibles por vía oral, pero el etexilato de dabigatrán es el único que llega al mercado. [9]
En un metaanálisis de 2012, dabigatrán se asoció con un mayor riesgo de infarto de miocardio (IAM) o SCAcuando se probó contra diferentes controles en un amplio espectro de pacientes. [22]
Tabla 1: Resumen de características de DTIs [ editar ]
| Bivalente / Univalente [4] | Ruta de administración [10] | Metabolismo [10] | Enlace al sitio activo y / o exosite 1 [4] | Indicaciones | Limitaciones | Ventajas | |
| Nativahirudin | segundo | (Parenteral) | No tiene indicaciones | ||||
| Lepirudina | segundo | Parenteral (iv / sc) | Renal | Irreversible | Prevención de más trombosis en pacientes con HIT [16] | TI estrecha, sangrado incrementado potencial, anticuerpos antihirudid se forman en el 40% de los pacientes, necesidad de una dosis basada en el peso [10] | |
| Desirudin | segundo | Parenteral (iv / sc) | Renal | Irreversible | Europa: tratamiento del TEV [4] EE . UU .: Prevención de la TVP en pacientes sometidos a cirugía de reemplazo de cadera [23] | Menos necesidad de dosis basadas en el peso y control de rutina en comparación con la lepirudina debido a la administración sc [10] | |
| Bivalirudina | segundo | Parenteral (iv) | Escisión proteolítica, hepática, 20% renal. | Reversible | Prevención de complicaciones isquémicas agudas en pacientes con angina inestable y con HIT o con riesgo de HIT sometidos a PTCA o PCI [24] | Se necesitan ajustes de dosis en la insuficiencia renal grave [16] | Disminución del riesgo de sangrado debido a la unión reversible, [4]mejor perfil de seguridad en comparación con las r-hirudinas, acción de inicio rápido [10] |
| Argatroban | U | Parenteral (iv) | Hepático, en su mayoría biliar. | Reversible | Prevención y tratamiento de la trombosis en pacientes con HIT [10] | No se necesita dosis de bolo[10] | |
| Ximelagatran | U | Oral | Hepático | Reversible | Europa: Prevención del TEV [10]
EE. UU .: la FDA nunca dio su aprobación [20]
| La terapia a largo plazo (›35 días) está asociada a la hepatotoxicidad: se retiró del mercado en Europa [18] | |
| Dabigatran etexilato | U | Oral | Principalmente renal, el resto se conjuga con ácido glucurónico en el hígado. | Reversible | Prevención del accidente cerebrovascular y la embolia en pacientes con FA [25] | Inicio rápido de la acción, falta de interacción con CYP450, alimentos o fármacos, TI amplia, administración de dosis fijas y buen perfil de seguridad, no asociado con hepatotoxicidad para uso a largo plazo [10] |
iv: intravenoso , sc: subcutáneo , HIT: trombocitopenia inducida por heparina , TEV: tromboembolismo venoso , TVP: trombosis venosa profunda , ACTP: angioplastia coronaria transluminal percutánea, ICP: intervención coronaria percutánea , FDA: Administración de fármacos y fármacos , FA: fibrilación auricular , TI: índice terapéutico
Estado 2014 [ editar ]
En 2014, dabigatran sigue siendo el único DTI oral aprobado [9] y, por lo tanto, es la única alternativa DTI a los antagonistas de la vitamina K. Hay, sin embargo, algunos medicamentos anticoagulantes orales nuevos que se encuentran actualmente en etapas tempranas y avanzadas de desarrollo clínico . La mayoría de estos medicamentos pertenecen a la clase de los inhibidores directos del factor Xa , pero existe un DTI llamado AZD0837, [26] que es un compuesto de seguimiento de ximelgatran que está siendo desarrollado por AstraZeneca. Es el profármaco de un potente inhibidor reversible competitivo de la trombina libre y unida a fibrina llamada ARH0637. [18] El desarrollo de AZD 0837 se suspende. Debido a una limitación identificada en la estabilidad a largo plazo del medicamento AZD0837 de liberación prolongada, un estudio de seguimiento de ASSURE sobre prevención de accidentes cerebrovasculares en pacientes con fibrilación auricular no valvular, se cerró prematuramente en 2010 después de 2 años. También hubo una mortalidad numéricamente mayor contra la warfarina. [27] [28] [29] En un ensayo de Fase 2 para la FA, la concentración sérica media de creatinina aumentó en aproximadamente un 10% desde el inicio en pacientes tratados con AZD0837, que regresó al inicio después de la interrupción del tratamiento. [30] El desarrollo de otros DTI orales, como Sofigatran de Mitsubishi Tanabe Pharma, ha sido descontinuado. [26] Otra estrategia para desarrollar fármacos anticoagulantes orales es la de la doble trombina y los inhibidores de la fXa que algunas compañías farmacéuticas, entre ellos Boehringer Ingelheim, han informado. Estos compuestos muestran una actividad anticoagulante favorable in vitro .









No hay comentarios:
Publicar un comentario