Entalpía
energía de disociación de enlace, D0, es una medida de la fuerza de enlace en un enlace químico. Se define como elcambio de entalpía estándar cuando se rompe un enlace por homólisis, con los reactivos y productos de la reacción de homólisis a 0K (cero absoluto). Así, la energía de disociación de enlace de uno de los enlaces C-H en el etano (C2H6) está definido por el proceso:
CH3CH2-H → CH3CH2 + H
D0 = ΔH = 101,1 kcal/mol (423.0 kJ/mol)
La energía de disociación de enlace también se conoce como entalpía de disociación de enlace (o entalpía de enlace), pero estos términos no son estrictamente correctos, puesto que se refieren a la entalpía de la reacción anterior en condiciones estándar, y pueden diferir de D0 en más de 3 kcal/mol (12 kJ/mol).
La energía de disociación de enlace suele ser diferente a la energía de enlace, que es calculada a partir de la suma de las energías de disociación de enlace de todos los enlaces en una molécula.1
Por ejemplo, un enlace O-H de la molécula de agua (H-O-H) tiene una energía de disociación de enlace de 493,4 kJ/mol, y se necesita 424,4 kJ/mol para romper el enlace O-H restante. La energía de enlace de los enlaces O-H en el agua es 458,9 kJ/mol, que es la media de los valores.
En la misma forma, la remoción sucesiva de los átomos de hidrógeno del metano tiene energías de disociación de enlace que son: 104 kcal/mol (435 kJ/mol) para D(CH3-H), 106 kcal/mol (444 kJ/mol) para D(CH2-H), 106 kcal/mol (444 kJ/mol) para D(CH-H) y finalmente 81 kcal/mol (339 kJ/mol) para D(C-H). En consecuencia, la energía de enlace es 99 kcal/mol o 414 kJ/mol (la media de las energías de disociación de enlace).
Obsérvese que si después de la disociación se forman nuevos enlaces a menor entalpía, habrá una pérdida neta de energía, y el proceso global será exotérmico.
La energía de disociación heterolítica de enlace está involucrada en la ruptura de enlaces químicos por heterólisis.
energía libre de Gibbs (energía libre o entalpía libre) es un potencial termodinámico, es decir, una función de estado extensiva con unidades de energía, que da la condición de equilibrio y de espontaneidad para una reacción química (a presión ytemperatura constantes).Se simboliza con la letra G mayúscula.
El segundo principio de la termodinámica postula que una reacción química espontánea hace que la entropía del universo aumente, ΔSuniverso > 0, así mismo ΔSuniverso esta en función de ΔSsistema y ΔSalrededores. Por lo general sólo importa lo que ocurre en el sistema en estudio y; por otro lado el cálculo de ΔSalrededores puede ser complicado.
Por esta razón fue necesaria otra función termodinámica, la energía libre de Gibbs, que sirva para calcular si una reacción ocurre de forma espontánea tomando en cuenta solo las variables del sistema.- ........................................................................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=056595b5a1a9f723a3cc679c6e0488a63c3aeb02&writer=rdf2latex&return_to=Energ%C3%ADa+de+Gibbs
entalpía de solución, entalpía de disolución o calor de disolución es el cambio de entalpía asociado a la disolución de una sustancia en un solvente a presión constante.
El calor de solución es una de las tres dimensiones del análisis de solubilidad. Se expresa más frecuentemente en kJ/mol a temperatura constante. El calor de solución de una sustancia está definido como la suma de la energía absorbida, o energía endotérmica (expresada en kJ/mol "positivos"), y la energía liberada, o energía exotérmica (expresada en kJ/mol "negativos").
Debido a que el calentamiento disminuye la solubilidad de un gas, la disolución de los gases es exotérmica. Consecuentemente, al disolverse un gas en un solvente líquido, la temperatura disminuye, mientras que la solución continúa liberando energía. Éste es un efecto del incremento en el calor o de la energía requerida para atraer a las moléculas de soluto y solvente —en otras palabras, esta energía supera a la energía requerida para separar a las moléculas del solvente. Cuando el gas está disuelto completamente (eso es puramente teórico dado que ninguna sustancia puede disolver infinitamente)— el calor de solución estará al máximo.
El proceso de disolución puede verse, termodinámicamente, como si consistiera en tres etapas:
- Ruptura de las atracciones soluto-soluto (endotérmica), por ejemplo la energía reticular en el caso de las sales.
- Ruptura de las atracciones solvente-solvente (endotérmica), por ejemplo el enlace de hidrógeno en el agua.
- Formación de atracciones solvente-soluto (exotérmica), en la solvatación.
El valor del cambio de entalpía global es la suma de los cambios de entalpía individuales de cada paso. Por ejemplo, al disolver nitrato de amonio en agua descenderá la temperatura del agua (la solvatación no compensa el gasto de energía en romper la estructura cristalina), mientras que el agregar hidróxido de potasio a agua aumentará la temperatura del sistema.
Las soluciones con calores negativos de solución forman enlaces fuertes y tienen presiones de vapor bajas.
| Calor de solución de algunos compuestos seleccionados | ||
| cloruro de hidrógeno | - | 74.84 |
| nitrato de amonio | + | 25.69 |
| amoníaco | - | 30.50 |
| hidróxido de potasio | - | 57.61 |
| hidróxido de cesio | - | 71.55 |
| cloruro de sodio | + | 3.87 |
| clorato de potasio | + | 41.38 |
| nitrato de potasio | + | 34.89 |
| ácido acético | - | 1.51 |
| hidróxido sódico | - | 44.51 |
| Cambio en entalpía ΔH | ||
La entalpía de formación (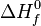 ) de un compuesto químico es la variación de entalpía de la reacción de formación de dicho compuesto a partir de las especies elementales que lo componen, en su forma más abundante. Por ejemplo, la entalpía de formación del agua, formada por hidrógeno y oxígeno, sería equivalente a la entalpía de reacción de hidrógeno diatómico y oxígeno diatómico.
) de un compuesto químico es la variación de entalpía de la reacción de formación de dicho compuesto a partir de las especies elementales que lo componen, en su forma más abundante. Por ejemplo, la entalpía de formación del agua, formada por hidrógeno y oxígeno, sería equivalente a la entalpía de reacción de hidrógeno diatómico y oxígeno diatómico.
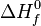 ) de un compuesto químico es la variación de entalpía de la reacción de formación de dicho compuesto a partir de las especies elementales que lo componen, en su forma más abundante. Por ejemplo, la entalpía de formación del agua, formada por hidrógeno y oxígeno, sería equivalente a la entalpía de reacción de hidrógeno diatómico y oxígeno diatómico.
) de un compuesto químico es la variación de entalpía de la reacción de formación de dicho compuesto a partir de las especies elementales que lo componen, en su forma más abundante. Por ejemplo, la entalpía de formación del agua, formada por hidrógeno y oxígeno, sería equivalente a la entalpía de reacción de hidrógeno diatómico y oxígeno diatómico.
Así, la entalpía de formación de un compuesto es la energía necesaria para formar un mol de dicho compuesto a partir sus elementos, medida, normalmente, en unas condiciones de referencia estándar, 1 atm de presión y una temperatura de 298 K (25 °C).
Esta entalpía es negativa cuando se trata de una reacción exotérmica, que desprende calor, mientras que es positiva cuando es endotérmica.
entalpía de vaporización o calor de vaporización es la cantidad de energía necesaria para que la unidad de masa (kilogramo, mol, etc.) de una sustancia que se encuentre en equilibrio con su propio vapor a una presión de una atmósfera pase completamente del estado líquido al estado gaseoso. Se representa por  , por ser una entalpía. El valor disminuye a temperaturas crecientes, lentamente cuando se está lejos del punto crítico, más rápidamente al acercarse, y por encima de la temperatura crítica las fases de líquido y vapor ya no coexisten. Generalmente se determina en el punto de ebullición de la sustancia y se corrige para tabular el valor encondiciones normales.- ................................................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=3912f6cf0b0c9911d4c5a2326d6f6bef9aadcc2f&writer=rdf2latex&return_to=Entalp%C3%ADa+de+vaporizaci%C3%B3n
, por ser una entalpía. El valor disminuye a temperaturas crecientes, lentamente cuando se está lejos del punto crítico, más rápidamente al acercarse, y por encima de la temperatura crítica las fases de líquido y vapor ya no coexisten. Generalmente se determina en el punto de ebullición de la sustancia y se corrige para tabular el valor encondiciones normales.- ................................................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=3912f6cf0b0c9911d4c5a2326d6f6bef9aadcc2f&writer=rdf2latex&return_to=Entalp%C3%ADa+de+vaporizaci%C3%B3n
 , por ser una entalpía. El valor disminuye a temperaturas crecientes, lentamente cuando se está lejos del punto crítico, más rápidamente al acercarse, y por encima de la temperatura crítica las fases de líquido y vapor ya no coexisten. Generalmente se determina en el punto de ebullición de la sustancia y se corrige para tabular el valor encondiciones normales.- ................................................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=3912f6cf0b0c9911d4c5a2326d6f6bef9aadcc2f&writer=rdf2latex&return_to=Entalp%C3%ADa+de+vaporizaci%C3%B3n
, por ser una entalpía. El valor disminuye a temperaturas crecientes, lentamente cuando se está lejos del punto crítico, más rápidamente al acercarse, y por encima de la temperatura crítica las fases de líquido y vapor ya no coexisten. Generalmente se determina en el punto de ebullición de la sustancia y se corrige para tabular el valor encondiciones normales.- ................................................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=3912f6cf0b0c9911d4c5a2326d6f6bef9aadcc2f&writer=rdf2latex&return_to=Entalp%C3%ADa+de+vaporizaci%C3%B3n
No hay comentarios:
Publicar un comentario