| Blástula | |
|---|---|

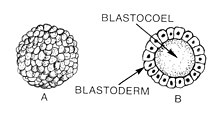
Blastulación: 1 - morula, 2 - blastula.
| |
| Detalles | |
| Dias | 4 4 |
| Precursor | Morula |
| Da lugar a | Gástrula |
| Identificadores | |
| Malla | D036703 |
| Terminologia anatomica | |
La blástula (del griego βλαστός (blastos), que significa " brote ") es una esfera hueca de células , denominada blastómeros , que rodea una cavidad interior llena de líquido llamada blastocoele formado durante una etapa temprana del desarrollo embrionario en animales. [1] El desarrollo del embrión comienza con un espermatozoide que fertiliza un óvulo para convertirse en un cigoto que sufre muchas divisiones para convertirse en una bola de células llamada mórula. Solo cuando se forma el blastocoele el embrión temprano se convierte en una blástula. La blástula precede a la formación de la gastrula en la cual se forman las capas germinales del embrión. [2]
Una característica común de una blástula de vertebrados es que consiste en una capa de blastómeros, conocida como blastodermo , que rodea al blastocele. [3] [4] En los mamíferos, la blástula se conoce como blastocisto . El blastocisto contiene un embrioblasto(o masa celular interna) que eventualmente dará lugar a las estructuras definitivas del feto y al trofoblasto , que continúa formando los tejidos extraembrionarios. [2] [5]
Durante la etapa de desarrollo de la blástula, se produce una cantidad significativa de actividad dentro del embrión temprano para establecer la polaridad celular , la especificación celular , la formación de ejes y regular la expresión génica . [6] En muchos animales como Drosophila y Xenopus , la transición a la mitad de la blástula (MBT) es un paso crucial en el desarrollo durante el cual el ARNm materno se degrada y el control sobre el desarrollo pasa al embrión. [7] Muchas de las interacciones entre blastómeros dependen de la expresión de cadherina , particularmente la cadherina Een mamíferos y EP-cadherina en anfibios. [6]
El estudio de la blástula y de la especificación celular tiene muchas implicaciones en el campo de la investigación con células madre , así como en la mejora continua de los tratamientos de fertilidad . [5] Las células madre embrionarias son un campo que, aunque controvertido, tiene un tremendo potencial para tratar la enfermedad. En Xenopus , los blastómeros se comportan como células madre pluripotentes que pueden migrar por varias vías, dependiendo de la señalización celular . [8] Al manipular las señales celulares durante la etapa de desarrollo de la blástula, se pueden formar varios tejidos. Este potencial puede ser instrumental en la medicina regenerativapara casos de enfermedades y lesiones.La fertilización in vitro implica la implantación de una blástula en el útero de la madre. [9] La implantación de células blásticas podría servir para eliminar la infertilidad .
Desarrollo [ editar ]
La etapa de blastula del desarrollo embrionario temprano comienza con la aparición del blastocoel. Se ha demostrado que el origen del blastocele en Xenopus proviene del primer surco de escisión , que se ensancha y se sella con uniones estrechas para crear una cavidad. [10]
En muchos organismos, el desarrollo del embrión hasta este punto y durante la primera parte de la etapa de la blástula está controlado por el ARNm materno, llamado así porque se produjo en el óvulo antes de la fertilización y, por lo tanto, es exclusivamente de la madre. [11] [12]
Transición a mitad de la blástula [ editar ]
En muchos organismos, incluidos Xenopus y Drosophila , la transición de la mitad de la blástula generalmente ocurre después de un número particular de divisiones celulares para una especie determinada, y se define por la finalización de los ciclos de división celular síncrona del desarrollo temprano de la blástula y el alargamiento de la ciclos celulares mediante la adición de las fases G1 y G2 . Antes de esta transición, la escisión ocurre solo con las fases de síntesis y mitosis del ciclo celular. [12]La adición de las dos fases de crecimiento en el ciclo celular permite que las células aumenten de tamaño, ya que hasta este punto los blastómeros experimentan divisiones reductoras en las que el tamaño total del embrión no aumenta, pero se crean más células. Esta transición comienza el crecimiento en tamaño del organismo. [2]
La transición a mitad de la blástula también se caracteriza por un marcado aumento en la transcripción de nuevos ARNm no maternos transcritos desde el genoma del organismo. En este punto, se destruyen grandes cantidades de ARNm materno, ya sea por proteínas como SMAUG en Drosophila [13] o por microARN . [14] Estos dos procesos cambian el control del embrión del ARNm materno a los núcleos.
Estructura [ editar ]
Una blástula es una esfera de células que rodea a un blastocele. El blastocele es una cavidad llena de líquido que contiene aminoácidos , proteínas , factores de crecimiento , azúcares, iones y otros componentes necesarios para la diferenciación celular . El blastocele también permite que los blastómeros se muevan durante el proceso de gastrulación . [15]
En los embriones de Xenopus , la blástula se compone de tres regiones diferentes. La tapa del animal forma el techo del blastocele y pasa principalmente a formar derivados ectodérmicos . La zona ecuatorial o marginal, que compone las paredes del blastocoel, se diferencia principalmente en tejido mesodérmico . La masa vegetal está compuesta por el piso de blastocoel y se desarrolla principalmente en tejido endodérmico . [6]
En el blastocisto de mamíferos (término para blastula de mamíferos) hay tres linajes que dan lugar al desarrollo posterior de tejidos. El epiblasto da lugar al feto en sí, mientras que el trofoblasto se desarrolla en parte de la placenta y el endodermo primitivo se convierte en el saco vitelino . [5]
En el embrión de ratón, la formación de blastoceles comienza en la etapa de 32 células. Durante este proceso, el agua ingresa al embrión, ayudado por un gradiente osmótico que es el resultado de Na + / K + ATPasas que producen un gradiente alto de Na + en el lado basolateral del trofoectodermo. Este movimiento de agua es facilitado por las aquaporinas . Se crea un sello mediante uniones estrechas de las células epiteliales que recubren el blastocele. [5]
Adhesión celular [ editar ]
Las uniones estrechas son muy importantes en el desarrollo embrionario. En la blástula, estas interacciones celulares mediadas por cadherina son esenciales para el desarrollo del epitelio que son más importantes para el transporte paracelular , el mantenimiento de la polaridad celular y la creación de un sello de permeabilidad para regular la formación de blastocoel. Estas uniones estrechas surgen después de que se establece la polaridad de las células epiteliales, que sienta las bases para un mayor desarrollo y especificación. Dentro de la blástula, los blastómeros internos son generalmente no polares, mientras que las células epiteliales demuestran polaridad. [15]
Los embriones de mamíferos se compactan alrededor de la etapa de 8 células donde se expresan las cadherinas E, así como las cateninas alfa y beta . Este proceso forma una bola de células embrionarias que son capaces de interactuar, en lugar de un grupo de células difusas e indiferenciadas. La adhesión de E-cadherina define el eje apico-basal en el embrión en desarrollo y convierte el embrión de una bola indistinta a un fenotipo más polarizado que prepara el escenario para un mayor desarrollo en un blastocisto completamente formado. [15]
La polaridad de la membrana de Xenopus se establece con la primera escisión celular. La cadherina EP anfibia y la cadherina XB / U desempeñan un papel similar al de la cadherina E en mamíferos, estableciendo la polaridad de los blastómeros y solidificando las interacciones célula-célula que son cruciales para un mayor desarrollo. [15]
Implicaciones clínicas [ editar ]
Tecnologías de fertilización [ editar ]
Los experimentos con implantación en ratones muestran que la inducción hormonal , la superovulación y la inseminación artificial producen con éxito embriones de ratones previos a la implantación. En los ratones, el noventa por ciento de las hembras fueron inducidas por estimulación mecánica para que se embarazaran e implantaran al menos un embrión. [16] Estos resultados demuestran ser alentadores porque proporcionan una base para la implantación potencial en otras especies de mamíferos, como los humanos.
Células madre [ editar ]
Las células en etapa blástula pueden comportarse como células madre pluripotentes en muchas especies. Las células madre pluripotentes son el punto de partida para producir células específicas de órganos que potencialmente pueden ayudar en la reparación y prevención de lesiones y degeneración. La combinación de la expresión de los factores de transcripción y el posicionamiento de localización de las células de la blástula puede conducir al desarrollo de órganos y tejidos funcionales inducidos. Las células pluripotentes de Xenopus , cuando se usaron en una estrategia in vivo, pudieron formar retinas funcionales . Al trasplantarlos al campo ocular en la placa neural , e inducir varias expresiones erróneas de los factores de transcripción, las células se comprometieron con el linaje de la retina y pudieron guiar el comportamiento basado en la visión en el Xenopus.
Las proteínas morfogenéticas óseas ( BMP ) son un grupo de factores de crecimiento también conocidos como citocinas y metabológenos . [1] Originalmente descubierto por su capacidad para inducir la formación de hueso y cartílago , ahora se considera que las BMP constituyen un grupo de señales morfogenéticas fundamentales, que orquestan la arquitectura del tejido en todo el cuerpo. [2]El importante funcionamiento de las señales de BMP en fisiología se enfatiza por la multitud de roles para la señalización de BMP desregulada en procesos patológicos. La enfermedad cancerosa a menudo implica una mala regulación del sistema de señalización BMP. La ausencia de señalización de BMP es, por ejemplo, un factor importante en la progresión del cáncer de colon, [3] y por el contrario, la sobreactivación de la señalización de BMP después de la esofagitisinducida por reflujo provoca el esófago de Barrett y, por lo tanto, es instrumental en el desarrollo de adenocarcinoma en la porción proximal. del tracto gastrointestinal . [4]
Las BMP humanas recombinantes (rhBMP) se utilizan en aplicaciones ortopédicas , como fusiones espinales , no uniones y cirugía oral. rhBMP-2 y rhBMP-7 están aprobados por la Administración de Alimentos y Medicamentos(FDA) para algunos usos. rhBMP-2 causa más hueso cubierto que cualquier otra BMP y se usa ampliamente fuera de etiqueta .
Usos médicos [ editar ]
Las BMP para uso clínico se producen utilizando tecnología de ADN recombinante (BMP humanas recombinantes; rhBMP). Los BMP-2 y BMP-7 recombinantes están actualmente aprobados para uso humano. [5]
Las rhBMP se usan en cirugías orales. [6] [7] [8] BMP-7 también ha encontrado recientemente uso en el tratamiento de la enfermedad renal crónica (ERC). Se ha demostrado que BMP-7 en modelos animales murinos revierte la pérdida de glomérulos debido a la esclerosis .
Uso fuera de etiqueta [ editar ]
Aunque rhBMP-2 y rhBMP-7 se usan en el tratamiento de una variedad de afecciones relacionadas con los huesos, incluidas las fusiones espinales y las no uniones , no se comprenden los riesgos de este tratamiento no indicado. [9] Si bien las rhBMP están aprobadas para aplicaciones específicas (fusiones lumbares espinales con abordaje anterior y no uniones de tibia), hasta el 85% de todo el uso de BMP está fuera de etiqueta . [9] rhBMP-2 se usa ampliamente en otras técnicas de fusión espinal lumbar (p. Ej., Utilizando un abordaje posterior, fusiones cervicales anteriores o posteriores [9] ).
Alternativa al autoinjerto en huesos no largos [ editar ]
En 2001, la Administración de Alimentos y Medicamentos (FDA) aprobó rhBMP-7 (también conocido como OP-1 ; Stryker Biotech ) para una exención de dispositivos humanitarios como una alternativa al autoinjerto en las uniones de huesos largos. [9] En 2004, la exención de dispositivos humanitarios se extendió como una alternativa al autoinjerto para fusión posterolateral. [9] En 2002, rhBMP-2 (Infuse; Medtronic ) fue aprobado para fusiones intercorporales lumbares anteriores (ALIF) con un dispositivo de fusión lumbar. [9] En 2008 se aprobó para reparar lumbar posterolateral pseudoartrosis , abierta de tibiaFracturas del eje con fijación intramedular del clavo. [9] En estos productos, las BMP se envían al sitio de la fractura al incorporarse a un implante óseo y se liberan gradualmente para permitir la formación de hueso, ya que la estimulación del crecimiento por BMP debe localizarse y mantenerse durante algunas semanas. Las BMP se eluyen a través de una matriz de colágenopurificada que se implanta en el sitio de la fractura. [5] rhBMP-2 ayuda a que el hueso crezca mejor que cualquier otro rhBMP, por lo que es mucho más utilizado clínicamente. [5] Hay "poco debate o controversia" sobre la efectividad de rhBMP-2 para hacer crecer el hueso para lograr fusiones espinales, [5] y Medtronic genera $ 700 millones en ventas anuales de su producto.[10]
Contraindicaciones [ editar ]
La proteína morfogenética ósea (rhBMP) no debe usarse de manera rutinaria en ningún tipo de fusión de la columna cervical anterior, como con la discectomía cervical anterior y la fusión . [11] Hay informes de que esta terapia causa inflamación del tejido blando que a su vez puede causar complicaciones potencialmente mortales debido a la dificultadpara tragar y la presión en el tracto respiratorio . [11]
Función [ editar ]
Las BMP interactúan con receptores específicos en la superficie celular, conocidos como receptores de proteínas morfogenéticas óseas (BMPR).
La transducción de señales a través de BMPR da como resultado la movilización de miembros de la familia de proteínas SMAD . Las vías de señalización que involucran BMP, BMPR y SMAD son importantes en el desarrollo del corazón, el sistema nervioso central y el cartílago, así como en el desarrollo óseo postnatal.
Tienen un papel importante durante el desarrollo embrionario en el patrón embrionario y la formación esquelética temprana. Como tal, la interrupción de la señalización de BMP puede afectar el plan corporal del embrión en desarrollo. Por ejemplo, BMP4 y sus inhibidores noggin y cordin ayudan a regular la polaridad del embrión (es decir, patrones de atrás hacia adelante). Específicamente, BMP-4 y sus inhibidores juegan un papel importante en la neurulación y el desarrollo de la placa neural . BMP-4 indica a las células de ectodermo que se desarrollen en células de la piel, pero la secreción de inhibidores por el mesodermo subyacente bloquea la acción de BMP-4 para permitir que el ectodermo continúe en su curso normal de desarrollo de células neurales.
Como miembro de la superfamilia beta del factor de crecimiento transformante, la señalización BMP regula una variedad de patrones embrionarios durante el desarrollo fetal y embrionario. Por ejemplo, la señalización BMP controla la formación temprana del conducto de Muller (MD), que es una estructura tubular en la etapa de desarrollo embrionario temprano y, finalmente, se convierte en tractos reproductivos femeninos. La inhibición química de las señales de BMP en el embrión de pollo causó una interrupción de la invaginación de MD y bloqueó el engrosamiento epitelial de la región de formación de MD, lo que indica que las señales de BMP juegan un papel en el desarrollo temprano de MD. [12] Además, la señalización de BMP está involucrada en la formación del intestino anterior y posterior, [13]patrón de vellosidades intestinales y diferenciación endocárdica. Las vellosidades contribuyen a aumentar la absorción efectiva de nutrientes al extender el área de superficie en el intestino delgado. Ganar o perder la función de la señalización de BMP alteró el patrón de los grupos y la aparición de vellosidades en el modelo intestinal del ratón. [14] La señal BMP derivada del miocardio también participa en la diferenciación endocárdica durante el desarrollo del corazón. La señal inhibida de BMP en el modelo embrionario de pez cebra causó una fuerte reducción de la diferenciación endocárdica, pero solo tuvo poco efecto en el desarrollo del miocardio. [15] Además, se requiere la diafonía de Notch-Wnt-Bmp para el diseño radial durante el desarrollo de la cóclea del ratón de manera antagonista. [dieciséis]
Las mutaciones en las BMP y sus inhibidores están asociadas con una serie de trastornos humanos que afectan el esqueleto.
Varias BMP también se denominan 'proteínas morfogenéticas derivadas de cartílago' (CDMP), mientras que otras se denominan ' factores de diferenciación del crecimiento ' (GDF).
Las BMP también están involucradas en la adipogénesis y la regulación funcional del tejido adiposo. [17] BMP4 favorece la adipogénesis blanca, mientras que BMP7 activa la funcionalidad grasa marrón; Los inhibidores de BMP también están involucrados en esta regulación [17]
Tipos [ editar ]
Originalmente, se descubrieron siete de esas proteínas. De estos, seis (BMP2 a BMP7) pertenecen a la superfamilia beta de proteínas del factor de crecimiento transformante . BMP1 es una metaloproteasa . Desde entonces, se han descubierto trece BMP más, todos los cuales están en la familia TGF-beta, lo que lleva el total a veinte. [5] La nomenclatura actual solo reconoce 13, ya que muchos otros están bajo el nombre de factor de diferenciación de crecimiento.
| BMP | Funciones conocidas | Gene Locus |
|---|---|---|
| BMP1 | * BMP1 no pertenece a la familia de proteínas TGF-β . Es una metaloproteasa que actúa sobre el procolágeno I, II y III. Está involucrado en el desarrollo del cartílago. | Cromosoma: 8 ; Ubicación: 8p21 |
| BMP2 | Actúa como un homodímero unido por disulfuro e induce la formación de hueso y cartílago. Es candidato como mediador de retinoides . Desempeña un papel clave enla diferenciación de osteoblastos . | Cromosoma: 20 ;Ubicación: 20p12 |
| BMP3 | Induce la formación de hueso. | Cromosoma: 14 ;Ubicación: 14p22 |
| BMP4 | Regula la formación de dientes, extremidades y huesos a partir del mesodermo .También juega un papel en la reparación de fracturas, la formación de epidermis, la formación del eje dorsal-ventral y el desarrollo bíblico ovárico. | Cromosoma: 14 ;Ubicación: 14q22-q23 |
| BMP5 | Realiza funciones en el desarrollo del cartílago. | Cromosoma: 6 ; Ubicación: 6p12.1 |
| BMP6 | Desempeña un papel en la integridad de las articulaciones en adultos. Controla la homeostasis del hierro mediante la regulación de la hepcidina . | Cromosoma: 6 ; Ubicación: 6p12.1 |
| BMP7 | Desempeña un papel clave en la diferenciación de osteoblastos . También induce la producción de SMAD1 . También clave en el desarrollo y reparación renal. | Cromosoma: 20 ;Ubicación: 20q13 |
| BMP8a | Participa en el desarrollo de huesos y cartílagos. | Cromosoma: 1 ; Ubicación: 1p35 – p32 |
| BMP8b | Expresado en el hipocampo . | Cromosoma: 1 ; Ubicación: 1p35 – p32 |
| BMP10 | Puede desempeñar un papel en la trabeculación del corazón embrionario. | Cromosoma: 2 ; Ubicación: 2p14 |
| BMP11 | Controla el patrón anterior-posterior. | Cromosoma: 12 ;Ubicación: 12p |
| BMP15 | Puede desempeñar un papel en el desarrollo de ovocitos y folículos . | Cromosoma: X ; Ubicación: Xp11.2 |
Historia [ editar ]
Desde la época de Hipócrates se sabe que el hueso tiene un potencial considerable para la regeneración y reparación. Nicholas Senn, cirujano del Rush Medical College de Chicago, describió la utilidad de los implantes óseos descalcificados antisépticos en el tratamiento de la osteomielitis y ciertas deformidades óseas. [19] Pierre Lacroix propuso que podría haber una sustancia hipotética, la osteogenina, que podría iniciar el crecimiento óseo. [20]
Marshall R. Urist demostró la base biológica de la morfogénesis ósea . Urist hizo el descubrimiento clave de que segmentos de hueso desmineralizados y liofilizados inducían la formación de hueso nuevo cuando se implantaban en bolsas musculares en conejos. Este descubrimiento fue publicado en 1965 por Urist in Science . [21] Urist propuso el nombre de "proteína morfogenética ósea" en la literatura científica en el Journal of Dental Research en 1971. [22]
La inducción ósea es una cascada secuencial de varios pasos. Los pasos clave en esta cascada son la quimiotaxis , la mitosis y la diferenciación . Los primeros estudios de Hari Reddi revelaron la secuencia de eventos involucrados en la morfogénesis ósea inducida por la matriz ósea. [23] Sobre la base del trabajo anterior, parecía probable que los morfógenos estuvieran presentes en la matriz ósea. Utilizando una batería de bioensayos para la formación de hueso, se realizó un estudio sistemático para aislar y purificar proteínas morfogenéticas óseas putativas.
Un obstáculo importante para la purificación fue la insolubilidad de la matriz ósea desmineralizada. Para superar este obstáculo, Hari Reddi y Kuber Sampath utilizaron extractores disociativos, como guanidina HCL 4 M , urea 8M o SDS al 1% . [24] El extracto soluble solo o los residuos insolubles solos fueron incapaces de nueva inducción ósea. Este trabajo sugirió que la actividad osteogénica óptima requiere una sinergia entre el extracto soluble y el sustrato colágeno insoluble. No solo representó un avance significativo hacia la purificación final de las proteínas morfogenéticas óseas por el laboratorio de Reddi, [25] [26]pero finalmente también permitió la clonación de BMP por John Wozney y sus colegas en el Instituto de Genética. [27]
Sociedad [ editar ]
Los ejemplos y la perspectiva en este artículo tratan principalmente con los Estados Unidos y no representan una visión mundial del tema . ( Marzo de 2019 ) ( Aprenda cómo y cuándo eliminar este mensaje de plantilla )
|
Costos [ editar ]
En un rango de entre US $ 6000 y $ 10,000 para un tratamiento típico, las BMP pueden ser costosas en comparación con otras técnicas como el injerto óseo . Sin embargo, este costo es a menudo mucho menor que los costos requeridos con la revisión ortopédica en múltiples cirugías.
Si bien hay poco debate acerca de que las rhBMP tienen éxito clínicamente, [5] existe controversia sobre su uso. Es común que a los cirujanos ortopédicos se les pague por su contribución al desarrollo de un nuevo producto, [28] [29] pero algunos de los cirujanos responsables de los estudios originales respaldados por Medtronic sobre la eficacia de rhBMP-2 han sido acusados de sesgo y conflicto de intereses. [30] Por ejemplo, un cirujano, autor principal de cuatro de estos trabajos de investigación, no reveló ningún vínculo financiero mientras estuvo con la compañía en tres de los trabajos; [31] Medtronic le pagó más de $ 4 millones. [31]En otro estudio, el autor principal no reveló ningún vínculo financiero con Medtronic; la compañía le pagó al menos $ 11 millones. [31] En una serie de 12 publicaciones, las medianas de los vínculos financieros de los autores a Medtronic eran $ 12-16 millones. [32] En aquellos estudios que tenían más de 20 y 100 pacientes, uno o más autores tenían vínculos financieros de $ 1 millón y $ 10 millones, respectivamente. [32] Los primeros ensayos clínicos con rhBMP-2 informaron eventos adversos asociados con el tratamiento. En las 13 publicaciones originales patrocinadas por la industria relacionadas con la seguridad, no hubo eventos adversos en 780 pacientes. [32]Desde entonces, se ha revelado que pueden surgir complicaciones potenciales del uso, incluidos el desplazamiento del implante, el hundimiento, la infección , los eventos urogenitales y la eyaculación retrógrada . [31] [32]
Según un estudio realizado por el Departamento de Medicina Familiar de la Universidad de Ciencias y Salud de Oregón, el uso de BMP aumentó rápidamente, del 5,5% de los casos de fusión en 2003 al 28,1% de los casos de fusión en 2008. El uso de BMP fue mayor entre los pacientes con antecedentes cirugía y entre aquellos que tienen procedimientos de fusión complejos (abordaje anterior y posterior combinado, o más de 2 niveles de disco). Las principales complicaciones médicas, complicaciones de la herida y tasas de rehospitalización de 30 días fueron casi idénticas con o sin BMP. Las tasas de reintervención también fueron muy similares, incluso después de estratificar por cirugía previa o complejidad quirúrgica, y después de ajustar las características demográficas y clínicas. En promedio, los cargos hospitalarios ajustados por operaciones que involucran BMP fueron aproximadamente $ 15,000 más que los cargos hospitalarios por fusiones sin BMP, aunque el reembolso bajo el sistema de grupo relacionado con el diagnóstico de Medicare promedió solo alrededor de $ 850 más. Significativamente menos pacientes que recibieron BMP fueron dados de alta a un centro de enfermería especializada.