Dinámica química
La Constante de disociación o Kd es definida en termodinámica química como la relación matemática que se establece a partir de las concentraciones de los compuestos químicos que se forman en una reacción de disociación al alcanzar su punto de equilibrio.
Si un compuesto de fórmula AxBy se disocia según la reacción:
la constante de disociación Kd se expresa mediante la siguiente relación de concentraciones (en moles por litro):
A menudo, la constante de disociación también se formula por pKd siendo
- pKd = -log(Kd).
- Un ejemplo ilustrativo es el de la disociación espontánea del agua. La constante de disociación del agua, expresada por Kw, es la constante de reacción asociada a lareacción química de autoprotolisis:Los productos de esta reacción son los iones oxonio (o iones hidronio) y loshidroxilos. En el estado de equilibrio químico, y en el caso de disoluciones diluidas, el Kw corresponde al producto de las concentraciones en iones, que en el caso de una temperatura de 25 °C, cumplen la relación: [H3O+]×[OH-] = 10-14
- y
- pKw = -log(Kw) = 14
Esta reacción del agua ocurre de manera natural y espontánea, de manera que en el agua a presión atmosférica se encuentran tanto moléculas de agua como iones en una relación de concentraciones acorde con la Kw específica a cada temperatura. -
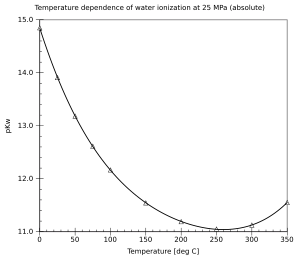
Dependencia de la temperatura de la constante de ionización del agua a 25 MPa.
- Una constante de disociación ácida, Ka, (también conocida como constante de acidez, o constante de ionización ácida) es una medida cuantitativa de la fuerza de un ácido en solución. Es la constante de equilibrio de una reacción conocida como disociación en el contexto de las reacciones ácido-base. El equilibrio puede escribirse simbólicamente como:
- HA
 A- + H+
A- + H+
donde HA es un ácido genérico que se disocia dividiéndose en A-, conocida comobase conjugada del ácido, y el ion hidrógeno o protón, H+, que, en el caso de soluciones acuosas, existe como un ion hidronio solvatado. En el ejemplo que se muestra en la figura, HA representa el ácido acético, y A- el ion acetato. Las especies químicas HA, A- y H+ se dice que están en equilibrio cuando sus concentraciones no cambian con el paso del tiempo. La constante de disociación se escribe normalmente como un cociente de las concentraciones de equilibrio (en mol/L), representado por[HA], [A-] y [H+]:Debido a los muchos órdenes de magnitud que pueden abarcar los valores de K a, en la práctica se suele expresar la constante de acidez mediante una medida logarítmica de la constante de acidez, el pKa, que es igual al -log10, y que también suele ser denominada constante de disociación ácida:A mayor valor de pKa, la extensión de la disociación es menor. Un ácido débil tiene un valor de pKa en un rango aproximado de −2 a 12 en agua. Los ácidos con valores de pKa menores que aproximadamente −2 se dice que son ácidos fuertes; un ácido fuerte está casi completamente disociado en solución acuosa, en la medida en que la concentración del ácido no disociado es indetectable. Los valores de pKa para los ácidos fuertes, pueden ser estimados por medios teóricos o por extrapolación de medidas en medios no acuosos, en los que la constante de disociación es menor, tales como acetonitrilo y dimetilsulfóxido.- .............................................................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=afa9ca4b7f83ce3f85941795f503f72e3db24fff&writer=rdf2latex&return_to=Constante+de+disociaci%C3%B3n+%C3%A1cida - HA
Cuando un ácido fuerte se disuelve en agua, se disocia casi completamente, es decir, en prácticamente de todas sus moléculas se separa un protón, que se libera al medio. Cuando el ácido es débil, el ácido no se disocia completamente al disolverse en agua, sino que sólo algunas moléculas liberan un protón, mientras que otras no lo hacen. La forma disociada y sin disociar del ácido débil permanecen en equilibrio químico en el medio acuoso. La constante de disociación ácida K se puede definir como una relación entre las concentraciones de ácido disociado y sin disociar.En los ácidos fuertes Kadquiere mayor valor, dado que las concentraciones de A y B serán altas y la concentración AB (ácido sin disociar) será baja. Si el valor de K para un ácido es bajo, esto significa que es un ácido débil, se disocia escasamente, por lo tanto las concentraciones de A y B serán bajas, y la concentración de AB será elevada.Por lo tanto, podemos decir que la constante de disociación ácida K,es una medida cuantitativa de la fuerza de un ácido. También se le llama constante de disociación ácida al pKa, que es el resultado de -log10 Ka.De esta manera, para los ácidos fuertes, con valor elevado de Ka, el pKa es pequeño, mientras que en ácidos débiles, con Ka de poco valor, es pKa es elevado.Según la definición de Arrhenius, un ácido es una sustancia que presenta disociación en solución acuosa, liberando un protón al medio. Sin embargo, como este protón liberado tiende a unirse a la molécula de agua, formando el ión hidronio (también denominado oxonio), Arrhenius indicó que la reacción de disociación de un ácido debería ser escrita como una reacción ácido-base, como vemos a continuación:HB + H2O → B− + H3O+Tomemos por ejemplo el ácido acético. Cuando se encuentra en solución acuosa, este ácido puede perder el protón de su grupo carboxilo, para dar lugar a su base conjugada (acetato). Su pKaa 25°C es de 4.8, lo que significa que en un medio con pH 4,8, más o menos la mitad de sus moléculas se encontrarán disociadas. Es un ácido débil, y su constante de disociación Ka a 20 grados Celsius es 1,75·10 -5.En la siguiente tabla podemos observar una lista de algunos ácidos orgánicos con su respectiva constante de acidez:Nombre K pK Acido fórmico 1.86 x10-4 3.732 Acido ciánico 3.54×10-4 3.451 Acido cianhídrico 5.85×10-10 9.233 Acido cloroacético 1.36 x 10-3 2.866 Acido dicloroacético 5.68×10-2 1.246 Acido benzoico 6.31 x 10-5 4.200 Acido láctico 1.37×10-4 3.863 Acido hidrazoico 2.37×10-5 4.625

![K_{d} = \frac{[A]^x \times [B]^y}{[A_x B_y]}](https://upload.wikimedia.org/math/f/a/7/fa734f7c67752b156fc481a917e07f30.png)
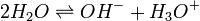
![K_{\mathrm a} = \mathrm{\frac{[A^-] [H^+]}{[HA]}}](https://upload.wikimedia.org/math/9/2/5/92593d3f8ab692bf55d05e13fee7de98.png)

No hay comentarios:
Publicar un comentario