Polímeros
ionómeros son una familia de polímeros que se caracterizan por tener unidades repetitivas no balanceadas eléctricamente, y por lo tanto presentar carga neta, tanto negativa en los aniómeros, como positiva en los catiómeros. Algunos polímeros como las proteínaspueden presentar tanto aminoácidos cargados positivamente como negativamente. Los ionómeros pueden tener un origen natural, como los alginatos, o sintético, como los poliestirenos sulfonatados.Entre los ionómeros naturales cabe destacar algunas proteínas o algunos polisacáridos como los alginatos (aniomérico, Alg-COO-) o losquitosanos (catioméros, Quit-NH3+).Caben destacar el poli(etilen-co-ácido metacrílico)1 o el poliestireno sulfonatado, ambos anioméros. Se pueden también sintetizarpoliuretanos con unidades que tomen carga eléctrica, tanto negativa como positiva según la formulación. Algunos ejemplos de estos son los poliuretanos catioméricos con aminas terciarias como extendedores de cadena, que son dispersables en medios acuosos en medios ligeramente ácidos.
Los ionómeros de vidrio mejor conocidos como polialquenoatos de vidrio se han difundido en los últimos tiempos como materiales de obturación y como liners, dadas sus características adhesivas y la liberación lenta de fluor, lo que lo convierte en un material anticariogénico. Mucho se ha discutido sobre las ventajas y desventajas de este material, ya que presenta adhesión al tejido dentario pero a su vez no presenta muy buenas características mecánicas si es comparado con otros materiales de obturación, como la resina o la amalgama. El propósito de esta revisión es analizar la utilización de este material como obturador coronal temporal después del tratamiento endodóntico, revisando sus propiedades, las ventajas y desventajas que ofrece para ésta situación clínica.
Los ionómeros de vidrio fueron introducidos por Wilson y Kent en 1974 y guardaron relación con los sistemas basados en los polielectrolitos ácidos como el cemento de policarboxilato de zinc, que dieron lugar a los poliácidos que remplazaron al ácido fosfórico de los silicatos. Como ha sido establecido como McLean un término más exacto para éste material es cemento de polialquenoato de vidrio, debido a que estos cementos químicamente no son verdaderos ionómeros.
Composición química: originalmente han sido soluciones de ácido poliacrílico entre el 30 y el 50% con otros aditivos como el ácido itacónico para potenciar algunas propiedades o copolímeros de líquidos acrílicos. Algunos contienen ácido tartárico o maléico, que actúan como agentes aceleradores o endurecedores y/o ácido vinil fosfónico. Estos poliácidos de alto peso molecular muestran buena afinidad con el órganos dentino pulpar. (1)
El líquido, aunque no es una evidencia demostrada, tiene la capacidad de mostrar enlaces de hidrógeno con el colágeno y con el calcio. El polvo, es un vidrio de alumino-silicato y otros componentes que mejoran sus características, con una fórmula de vidrio de fluoruro-alumino-silicato de calcio.
Reacción química: cuando el polvo y el líquido son mezclados el vidrio de fluoruoaluminosilicato (FAS) es atacado –permeado por los iones de hidrógeno del ácido polialquenóico, libera iones de aluminio, calcio, sodio y flúor. Una capa de gel de sílice es formada lentamente sobre la superficie del polvo sin reaccionar con pérdida progresiva de iones metálicos. Cuando los iones libres de aluminio y calcio alcanzan la saturación dentro del gel de Sailina ellos se difunden dentro del líquido y forman una cadena cruzada con 2 o 3 grupos carboxílicos ionizados (COO-) del poliácido para formar un gel. Cuando la estructura de la cadena cruzada aumenta a través de los iones de aluminio y el gel es suficientemente hidratado, la sal de poliacrilato encadenada comienza a precipitar hasta que el cemento esta rígido
Propiedades físicas: El módulo flexural es similar a la dentina al igual que el coeficiente de expansión térmica que es comparable al de la estructura del diente. La resistencia compresiva aumenta con el envejecimiento de la restauración debido a la incorporación de iones dentro de la matriz y de la cadena cruzada de estas. A pesar que la resistencia de un ion a la dentina (2 a 3 Mpa), es mucho mas baja que las resinas, los estudios clínicos han demostrado que su retención en áreas de erosión cervical es considerablemente mejor que las resinas. Sus ventajas mas sobresalientes son:
Los ionómeros de vidrio fueron introducidos por Wilson y Kent en 1974 y guardaron relación con los sistemas basados en los polielectrolitos ácidos como el cemento de policarboxilato de zinc, que dieron lugar a los poliácidos que remplazaron al ácido fosfórico de los silicatos. Como ha sido establecido como McLean un término más exacto para éste material es cemento de polialquenoato de vidrio, debido a que estos cementos químicamente no son verdaderos ionómeros.
Composición química: originalmente han sido soluciones de ácido poliacrílico entre el 30 y el 50% con otros aditivos como el ácido itacónico para potenciar algunas propiedades o copolímeros de líquidos acrílicos. Algunos contienen ácido tartárico o maléico, que actúan como agentes aceleradores o endurecedores y/o ácido vinil fosfónico. Estos poliácidos de alto peso molecular muestran buena afinidad con el órganos dentino pulpar. (1)
El líquido, aunque no es una evidencia demostrada, tiene la capacidad de mostrar enlaces de hidrógeno con el colágeno y con el calcio. El polvo, es un vidrio de alumino-silicato y otros componentes que mejoran sus características, con una fórmula de vidrio de fluoruro-alumino-silicato de calcio.
Reacción química: cuando el polvo y el líquido son mezclados el vidrio de fluoruoaluminosilicato (FAS) es atacado –permeado por los iones de hidrógeno del ácido polialquenóico, libera iones de aluminio, calcio, sodio y flúor. Una capa de gel de sílice es formada lentamente sobre la superficie del polvo sin reaccionar con pérdida progresiva de iones metálicos. Cuando los iones libres de aluminio y calcio alcanzan la saturación dentro del gel de Sailina ellos se difunden dentro del líquido y forman una cadena cruzada con 2 o 3 grupos carboxílicos ionizados (COO-) del poliácido para formar un gel. Cuando la estructura de la cadena cruzada aumenta a través de los iones de aluminio y el gel es suficientemente hidratado, la sal de poliacrilato encadenada comienza a precipitar hasta que el cemento esta rígido
Propiedades físicas: El módulo flexural es similar a la dentina al igual que el coeficiente de expansión térmica que es comparable al de la estructura del diente. La resistencia compresiva aumenta con el envejecimiento de la restauración debido a la incorporación de iones dentro de la matriz y de la cadena cruzada de estas. A pesar que la resistencia de un ion a la dentina (2 a 3 Mpa), es mucho mas baja que las resinas, los estudios clínicos han demostrado que su retención en áreas de erosión cervical es considerablemente mejor que las resinas. Sus ventajas mas sobresalientes son:
- Liberación de flúor
- Efecto anticariogenico
- Afinidad con el sustrato dentinario
- Mayor adhesión potencial a los tejidos dentarios
Durante la reacción química el material puede sufrir una contracción; en presencia de una humedad relativa de mas de un 85% el material se expande pero si es mas baja el material se deseca. El resultado neto es una ligera expansión cuando existe un buen balance de agua y una baja sorción de agua proporciona restauraciones de colores estables libres de pigmentaciones. (1)
Tipos de Ionómeros de Vidrio:
Tipos de Ionómeros de Vidrio:
- Tipo I: para cementación
- Tipo II: materiales restaurativos
- Tipo III: para bases de alta resistencia y base intermedia delgada (liners).1
Uno de los principales problemas de los materiales temporales y definitivos es la microfiltración marginal que se define como el paso de fluidos, bacterias , moléculas o iones y aún aire, entre el material restaurador y las paredes de un diente. (2)
Torabinejad y col. (1990) considera algunas situaciones que permiten que los conductos obturados se puedan contaminar tales como: un tratamiento endodóntico al cual nunca se le colocó la restauración permanente, cuando se ha perdido estructura dental o del material de obturación o cuando el material de obturación permanece mas de ocho días. Todo lo anterior conlleva a que el sistema de conductos este expuesto a la flora oral permitiendo la microfiltración de bacterias y endotoxinas que causan la inflamación de los tejidos periapicales. (3)
Otra técnica para medir la microfiltración fue introducida por Derkson y col. Estas técnicas usan líquidos que contienen tintes que son forzados bajo presión a través de la dentina y alrededor de las restauraciones colocadas en los dientes extraídos, aunque esta técnica fue usada para medir la microfiltración de los materiales restaurativos permanente, una adaptación efectiva de esta técnica cuantitativa de la microfiltración sirve para medir los materiales de restauración temporal en endodoncia. (4)
Bobotis y col (1989) evaluó el Cavit, Cavit G, TERM, ionómero de virio, fosfato de zinc, policarboxilato e IRM utilizando una prueba de filtración de fluidos en dientes humanos extraídos y observó que el Cavit, Cavit G, TERM y ionómero de vidrio daban un buen selle durante las 8 semanas del periodo evaluado. Mientras que se presento filtración en los dientes restaurados con cemento de oxido de zinc. El IRM y policarboxilato fueron los menos efectivos en la prevención de la microfiltración. (5)
Se han realizado estudios comparando la microfiltración de varios materiales de obturación temporal dentro de los cuales han evaluado el Cavit, Cavit G, TERM, fosfato de zinc, policarboxilato, IRM y ionómero de virio, utilizando una técnica de filtración de fluidos, encontrando que los valores de microfiltración para el Cavit, Cavit G, el IRM, el TERM y los cementos de ionómero de vidrio todos dan un excelente selle contra la microfiltración. (6)
Recientemente algunas investigaciones han sido dirigidas hacia el selle coronal del diente Swanson y Madison mostraron la capacidad de la saliva para penetrar en la obturación radicular en una corona sin selle en un estudio in vitro7 Torabinejad y col. Mostraron que el stafilococus epidermidis y el proteus vulgaris pasaron a lo largo de obturaciones experimentales en un periodo de tiempo de 5 a 73 días de la superficie coronal al ápice.3Khayat y Lee usaron saliva humana para demostrar que las obturaciones radiculares fueron completamente penetradas por los microorganismos de la saliva en 48 días 8, por lo tanto los materiales de obturación radicular tienen que ser observados como una barrera adicional al paso de los microorganismos, y ellos no pueden ser solamente considerados como un selle hermético.
Barthel y col. (1999) compararon in vitro la microfiltración para determinar la penetración bacteriana en una dirección corono-apical de varios cementos de obturación temporal como el Cavit, IRM, cemento ionómero de vidrio , Cavit combinado con ionómero de vidrio o el IRM combinado con ionómero de vidrio. Encontrando que el ionómero de vidrio cuando se utiliza solo o combinado con el IRM puede prevenir la penetración bacteriana en el periápice mas o menos en un periodo de un mes. (9).
Torabinejad y col. (1990) considera algunas situaciones que permiten que los conductos obturados se puedan contaminar tales como: un tratamiento endodóntico al cual nunca se le colocó la restauración permanente, cuando se ha perdido estructura dental o del material de obturación o cuando el material de obturación permanece mas de ocho días. Todo lo anterior conlleva a que el sistema de conductos este expuesto a la flora oral permitiendo la microfiltración de bacterias y endotoxinas que causan la inflamación de los tejidos periapicales. (3)
Otra técnica para medir la microfiltración fue introducida por Derkson y col. Estas técnicas usan líquidos que contienen tintes que son forzados bajo presión a través de la dentina y alrededor de las restauraciones colocadas en los dientes extraídos, aunque esta técnica fue usada para medir la microfiltración de los materiales restaurativos permanente, una adaptación efectiva de esta técnica cuantitativa de la microfiltración sirve para medir los materiales de restauración temporal en endodoncia. (4)
Bobotis y col (1989) evaluó el Cavit, Cavit G, TERM, ionómero de virio, fosfato de zinc, policarboxilato e IRM utilizando una prueba de filtración de fluidos en dientes humanos extraídos y observó que el Cavit, Cavit G, TERM y ionómero de vidrio daban un buen selle durante las 8 semanas del periodo evaluado. Mientras que se presento filtración en los dientes restaurados con cemento de oxido de zinc. El IRM y policarboxilato fueron los menos efectivos en la prevención de la microfiltración. (5)
Se han realizado estudios comparando la microfiltración de varios materiales de obturación temporal dentro de los cuales han evaluado el Cavit, Cavit G, TERM, fosfato de zinc, policarboxilato, IRM y ionómero de virio, utilizando una técnica de filtración de fluidos, encontrando que los valores de microfiltración para el Cavit, Cavit G, el IRM, el TERM y los cementos de ionómero de vidrio todos dan un excelente selle contra la microfiltración. (6)
Recientemente algunas investigaciones han sido dirigidas hacia el selle coronal del diente Swanson y Madison mostraron la capacidad de la saliva para penetrar en la obturación radicular en una corona sin selle en un estudio in vitro7 Torabinejad y col. Mostraron que el stafilococus epidermidis y el proteus vulgaris pasaron a lo largo de obturaciones experimentales en un periodo de tiempo de 5 a 73 días de la superficie coronal al ápice.3Khayat y Lee usaron saliva humana para demostrar que las obturaciones radiculares fueron completamente penetradas por los microorganismos de la saliva en 48 días 8, por lo tanto los materiales de obturación radicular tienen que ser observados como una barrera adicional al paso de los microorganismos, y ellos no pueden ser solamente considerados como un selle hermético.
Barthel y col. (1999) compararon in vitro la microfiltración para determinar la penetración bacteriana en una dirección corono-apical de varios cementos de obturación temporal como el Cavit, IRM, cemento ionómero de vidrio , Cavit combinado con ionómero de vidrio o el IRM combinado con ionómero de vidrio. Encontrando que el ionómero de vidrio cuando se utiliza solo o combinado con el IRM puede prevenir la penetración bacteriana en el periápice mas o menos en un periodo de un mes. (9).
Alcaligenes eutrophus es una especie de bacteria perteneciente al género Alcaligenes.
A. eutrophus produce de manera natural polihidroxialcanoatos (PHA). Los PHAs son un amplio grupo de polímeros biodegradables que pueden emplearse en la fabricación deplásticos biodegradables. Específicamente, A. eutrophus produce Polihidroxibutirato(PHB), que la bacteria emplea como manera de almacenar carbono cuando se encuentra en un ambiente en el que este elemento es abundante, pero donde escasean otros nutrientes esenciales como el nitrógeno o el fósforo. El gen de A. eutrophus para la producción de PHB ha sido clonado en plantas mediante técnicas de ingeniería genética.
La denominación Alcaligenes eutrophus actualmente no se usa. Después de ser modificada a Ralstonia eutrophus y más tarde a Wausteria eutrophus, su denominación es ahora Ralstonia metallidurans.
Por. Ángel Mogie
General
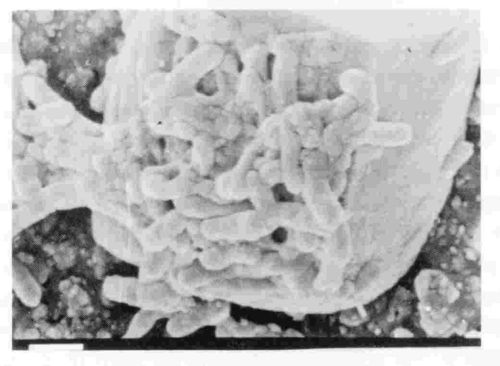
Alcaligenes eutrophus (a veces conocido como Ralstonia metallidurans, Figura 1) es un bacilo gram negativo, con una temperatura óptima de crecimiento de 30 C [1]. Se trata de una formación no espora, obliga bacteria aeróbica, y facultativamente chemolithoautothropic que pueden prosperar en ambientes que contengan concentraciones milimolares de algunos metales pesados tóxicos como el zinc, cadmio, cobalto, plomo, mercurio, níquel y cromo [2]. En presencia de nitrato, A. eutrhopus puede crecer anaeróbicamente. Como es natural, sintetiza polihidroxibutirato (PHB), un tipo específico de polihidroxialcanoatos (PHA) que se utiliza en la fabricación de plástico biodegradable.
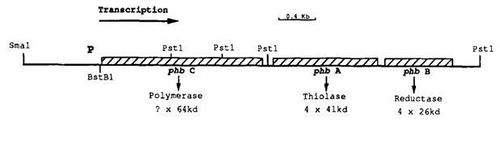
Los genes que codifican las enzimas: phbC-phbA-phbB
Hay tres enzimas reguladoras implicadas en la bioproducción de PHB en Alcaligenes eutrophus: 3-cetotiolasa, acetoacetil-CoA reductasa, y PHA sintasa, codificadas por los genes phbA, phbB y phbC respectivamente. Los genética molecular y cartografía de estas enzimas se realizaron en E. coli usando el A. eutrophus cepas de H16, 11599, 1159981, PHB 2, PHB3, PHB19 [3]. En 1989, Sinskey y Pueblos identifican la ubicación de los genes phbA y phbB en el plásmido, un ADN de doble hebra de bucle único hélice que puede replicarse independientemente del ADN cromosómico, pAeT29 de E. coli y se encontró que sus expresiones estaban bajo el control de Alcaligenes eutrophus promotor. Más tarde en el mismo año, los dos investigadores asignan la ubicación de phbC- gen phbC se encuentra aguas arriba de phbA-phbB (Figura 2). Además, también se observó reducción de las actividades, tanto en tiolasa y reeducar. Sus resultados sugieren que en las cepas PHB2 y PHB3, los tres genes se expresan a partir del mismo promotor localizado aguas arriba de phbC
Por otra parte, Sinskey y de los Pueblos también propuso que Alcaligenes eutrophus tenía al menos dos P-cetotiolasa y acetoace- enzimas reductasa-tyl CoA. Tiolasa y reductasa enzimas, cuando interactúan con cualquiera enoil-CoA hidratasa o epimerasa o ambos, pueden conducir a la formación de D (-) - 3-hidroxibutiril-CoA. En E. coli la expresión de phbC resultados por sí solos en una cantidad menor de la síntesis de PHB y una tasa insignificante de la actividad de la polimerasa PHB. La ausencia de ambos genes phbA y PHB de A. eutrophus conduce a la síntesis de NO de D (-) - 3-hidroxibutiril-CoA. Sólo cuando los tres A. eutrophus genes, phbC-phbA-phbB, estuvieron presentes en E. coli, se observó entonces mayor que 50% de la producción de PHB. Ellos también pensaron que la producción de PHB fue inhibida por la presencia de nitrógeno. Por otra parte, propusieron que la interacción de tiolasa y / o reductasa con la polimerasa era necesario para la polimerasa funcione.
Metales pesados Resistencia
Entre las muchas bacterias oxidantes de hidrógeno, los Alcaligenes se caracterizan por su capacidad en la formación de dos hidrogenasas: una hidrogenasa NAD-reducción se encuentra en el citoplasma y una hidrogenasa unido a la membrana [2]. El rasgo de hidrógeno-oxidante de A. eutrophus está codificada por un plásmido 450 kb, que se identificó a través de una transferencia de plásmido a Hox- células que carecen de plásmido. Dos genes que codifican la resistencia de metales pesados se encuentran dentro de los dos (megaplasmids pMOL28 = 180 kbp y pMOL30 = 240 KBP). Estos dos megaplasmids también llevan genes que expresan bombas de eflujo de cationes para ambas membranas interna y externa bacterianas.
PHB
Descubrimiento
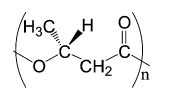
Maurice Lemoigne (mediados de 1920) fue la primera persona que descubrió monopolyester de poli identificado (3-hidroxibutirato) o PHB (Figura 3) [4]. Me tomó un tiempo hasta que se hizo el descubrimiento conocido para el público porque fue escrito originalmente en francés. Más tarde, PHB fue identificado químicamente por Staudinger (1920). Sin embargo, PHB no consiguió el mismo nivel de atención del público y los científicos como termoplástico biodegradable prototípico hasta treinta años más tarde. El Imperial Chemical Industries Ltd. (1980) fue el primero en hacer estudios intensivos de PHB en múltiples áreas de investigación, incluyendo la ingeniería genética, la biotecnología, y las enzimas responsables de la biosíntesis y la biodegradación. PHB es un polímero inverso encontrado en bacterias y puede producir tanto el monómero y el polímero de la [R] -3 hidroxibutírico
Síntesis de Alcaligenes eutrophus
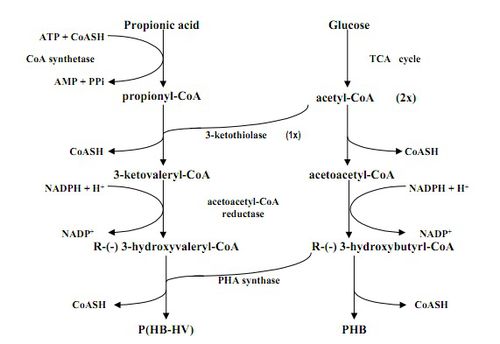
En A. eutrophus, la síntesis de PHB implica la glucosa como fuente de carbono y tres enzimas: 3-cetotiolasa, acetoacetil-CoA reductasa, y PHA sintasa [5]. La primera enzima, 3-cetotiolasa, es responsable de llevar la reacción de condensación de la acetil-CoA en acetoacetil-CoA. Entonces, acetoacetil-CoA reductasa reduce acetoacetil-CoA en R (-) - 3-hydroxybutynl-CoA, con NADPH que sirve como agente reductor. R (-) - 3-hydroxybutynl-CoA se polimeriza entonces en PHB con la ayuda de PHA sintasa (Figura 4). A. eutrophus puede producir una cantidad de PHB igual al 80% de su peso corporal seco cuando se cultiva en rico en azúcar, pero / medios de comunicación privados-fosfato de nitrógeno. Alcaligenes eutrophus sintetiza diferentes tipos de polímeros a base de la fuente de carbono se expone a en los medios. Por ejemplo, tener ácido propiónico en lugar de glucosa como fuente de carbono principal conduce a la producción de un polímero que contiene un 3-hidroxibutirato (3HB) y 3-hidroxivalerato (3HV) en lugar de PHB (Fig. 4). Por otro lado, la glucosa completamente sustituyendo con ácido valérico conduce a una mayor producción de polímero en A. eutrophus - euqal a 90% del peso corporal seco.
Características físicas: Ventajas y desventajas
PHB es un homopolímero rígido y es un termoplástico frágil. Tiene 100% estereoespecificidad con el D asimétrica (-) molécula y por lo tanto es altamente cristalino [4]. A diferencia de muchos otros polímeros biodegradables, PHB es resistente a la humedad, impermeable al oxígeno, e insoluble en agua, lo que hace particularmente beneficiosa para la industria del envasado de alimentos. Sin embargo, el punto de fusión del PHB (175 C) está muy cerca de su temperatura degradantes (185 C), que es por eso que es tan frágil y por lo tanto difícil de molde [5]. La fragilidad de PHB se puede bajar mediante la integración de co-monómero de 3-hidroxivalerato o mezclar con el polímero PHB más elástica. El copolímero PHB que contiene 3-hidroxivalerato unidad de P (3HB-co-3HV) es una de las formas desarrolladas de PHB con mejores funciones mecánicas: la unidad más 3-hidroxivalerato hace PHB más dura, más elástica, aumenta su alargamiento a la rotura, y disminuye su punto de fusión, pero no cambia su temperatura degradantes. Por lo tanto, las propiedades físicas de PHB se pueden controlar por la cantidad de 3-hidroxivalerato integrado durante la fermentación.
¿Cómo es PHB biodegradable?
Alcaligenes eutrophus formas PHB como una forma de fijación de carbono y como una forma de almacenamiento intercelular [4]. Cuando la bacteria se queda sin carbono extracelular, PHB se descompone con eficacia y rapidez en compuestos orgánicos para ser reutilizado. De hecho, A. eutrophus no es la única bacteria que degrada PHB. Lemoigne (1923-27) descubierto que B. comunicados megaterium [R] -3-hidroxibutírico en un entorno acuoso. Wilkinson et al. (1958) también estudió B. megaterium y descubrió que esta bacteria degrada PHB y libera ambas ácido acetoacético y ácido acético como subproductos. En 1962, Merrick et al., Trabajó en B. rubrum y se encontró que la bacteria auto-cataboliza sus gránulos "nativos" a través de hidrólisis con la ayuda de la despolimerasa enzima (a veces referido como hidrolasa). Esto fue seguido por Williamson et al., En 1967, que descubrió una deshidrogenasa específica que convertes [R] -3-hidroxibutírico a acetoacéticos ácido. Otra enzima que lleva a la síntesis de ácido acético a partir de ácido acetoacético fue clasificado por Dawes y su equipo en 1973. Base en esos descubrimientos anteriores, la biodegradación de PHB en compuestos orgánicos simples puede hacerse a través de cualquiera de estas posibles maneras: • PHB puede ser desglosado a través de hidrólisis con la ayuda de una enzima despolimerasa-secretada por muchas bacterias y hongos. En 1965, Delafield, Doudoroff y sus colaboradores identificaron algunos pseudomonas que tratan PHB como su energía y fuente de carbono. • Muchos microorganismos tienen la capacidad tanto de PHB catabolizar y metabolizan [R] -3-hidroxibutírico. • despolimerasas están asociados con larga alquilo encadenados clases PHA. • despolimerasas poliéster se encuentran en muchos organismos diferentes y sus características y estructura han sido bien estudiados.
También, como se argumenta Lee (1996), plasma sanguíneo humano tiene la capacidad de catabolizar PHB y una concentración bastante alta del subproducto de degradación se ha detectado. Por lo tanto, es fuertemente concebible que PHB no es venenosa a cualquiera de las plantas, mamíferos, o el medio ambiente.
Ambientalmente vs. plásticos económicamente amigables
Con el fin de ser rentable, es crucial para producir polímeros utilizando métodos que darán de alta productividad, así como un menor costo. Entre los muchos polímeros biodegradables, PHB, poli (3-hidroxibutirato-co-3-hidroxivalerato) y poli (3-hidroxihexanoato-co-3-hidroxioctanoato) son los que han sido producidos con alta productividad [6]. Con el fin de reducir el costo de producción, una transferencia de genes de A. eutrhopus a la planta Arabidopsis thaliana (Figura 5) se puede hacer a través de la ingeniería genética.
Desde A. eutrhopus pertenece al reino de los procariotas, su ADN no está rodeado por un núcleo, y por lo tanto su información genética, como un único plásmido de hebra, se pueden transferir a otros organismos [7]. Los tres genes de A. eutrhopus, que son responsables de la expresión de enzimas que implican en la fabricación de polímero, puede ser insertado en el ADN de A. thaliana a través de una técnica llamada gen de corte y empalme. Polímeros de plástico se encuentran en el citoplasma, núcleo, y vacuola de la planta y se recogieron a través de extracciones de cloroformo de múltiples pasos para separar el polímero a partir de materiales vegetales. La extracción de polímero directamente de A. eutrhopuspodría costar $ 4 por libra, mientras que la cosecha de este plástico de A. thaliana sería sólo cuesta alrededor de $ 1.50 por libra. Sin embargo, aunque es menos costoso de producir polímero por planta transgénica, A. thaliana sólo se produce polímero igual a aproximadamente 14% de su peso en seco. Se necesitan más estudios sobre cómo mejorar la productividad con el fin de que sea económicamente significativa a la producción de polímeros biodegradables [6]. Sin embargo, ni el A. eutrhopus ni el A. thaliana mediante costos de polímeros cosecha casi tan poco como la producción de plásticos a base de petróleo "normal", que sólo cuesta unos 50 centavos de dólar por libra [7]. Por año, se producen aproximadamente 600 toneladas de plástico biodegradable, mientras que una fábrica produce 100.000 toneladas en promedio de plástico no biodegradable. Las papas son también otro candidato a la ingeniería genética con el objetivo de ser para reemplazar la producción de almidón con la producción de polímero. Otro grupo de candidatos polímero de productores de plantas de semillas oleaginosas son cultivos. Sin embargo, son sin duda necesitan más estudios sobre cómo desarrollar la síntesis de polímeros en las plantas [8].
Ambiental y económicamente amigable: recombinante E. coli en PHB Producción
Una de las principales desventajas de plástico biodegradable es su costo mucho más caro de la producción en comparación con la fabricación de plástico mucho más bajo a base de petróleo-presupuesto. A pesar de que es más saludable para la Tierra, la PHA debe ser fabricado de una manera más costo-amigable con el fin de ser más comercial que el "malo" de plástico. Una de las alternativas en la reducción del coste de producción de PHB es a través de reacción de fermentación que implica bacterias distintas de A. eutrophus. Hay varias razones por las PHB recolección de A. eutrophus costaría más que si se extrae de otras bacterias, por ejemplo, el laboratorio amigable E. coli. Hay tres aspectos principales que determinan la eficiencia de [9] la producción de PHB: 1) síntesis por la base productor de la fuente de carbono 2) la producción y la acumulación de PHB tasa. 3) el porcentaje de recuperación y el nivel de pureza El tercer factor, porcentaje de recuperación y la pureza, suele ser la fuerza impulsora que determina cuán grande es el costo de producción es. Bajo el mismo tratamiento, más PHB se recupera a partir recombinante E. coli en comparación con A. eutrophus. Además, PHB recombinante producida por E. coli tiene 95% de pureza y el 96% recuperación: alrededor del 16% más alto que el 80% de recuperación de A. eutrophus PHB -producido [10]. La recuperación de PHB en E.coli puede ser hecho por tener uno de sus cepas, XL1-Blue, la acogida de forma recombinante los genes de A. eutrophus necesario en la biosíntesis de PHB (pSYL 104) [10]. En la parte superior de la mayor recuperación y pureza, PHB se recuperó de E. coli tiene gránulos con un diámetro notablemente mayor, 1,13 a 1,25 um, que los gránulos de PHB extraídos de A. eutrophus que sólo son 0,1 a 0,8 um. E.coli también puede utilizar una gama más amplia de susbtrates por ejemplo, lactosa, sacarosa, xilosa, etc. tiempo de producción es mucho más corto en E. coli (24 horas) en comparación con A.eutrophus (tres días). Además, en recombinante E. coli, plydispersity se puede controlar mediante la manipulación de la actividad de sintasa. Sin embargo, A. eutrophus produjo PHB es más moldeable que el producido por E. coli con su morfología altamente cristalino.
Pureza
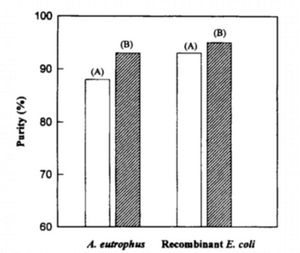
Además de su alta estabilidad contra el catabolismo molecular, recombinante E. coli PHB también es más digerible por su tratamiento de recuperación de PHB, hipoclorito, de A. eutrophus PHB [10]. Estas dos características son las principales razones de la alta pureza de recombinanteE. coli PHB. Recuperación PHB utilizando 20% de resultados hipoclorito de sodio en 88% de pureza de A. eutrophus PHB y 93% de pureza de E.coli PHB (Figura 6). PHB a partir recombinante E. coli no consigue hidroliza durante o después de la fermentación debido a su falta de despolimerasa PHB intracelular. Esta es otra característica ventajosa de E. coli PHB que está ausente en A. eutrophus PHB. En la etapa de recuperación implica SDS como tratamiento, las condiciones tienen que ser calentado a 80 C o superior para las células para ser digerida y para evitar la suspensión de ácido nucleico. Si la temperatura no es lo suficientemente alta durante la recuperación, PHB no puede ser recolectada de las A. eutrophus desde el lisado se rigurosamente agregarse. En E. coli, no se necesita tratamiento de calor debido a las características especiales que se mencionan anteriormente. Esto también conduce a un mayor porcentaje de pureza PHB. La diferencia en la información genética podría ser la base de la diferencia entre las actuaciones en la pureza de PHB en A. eutrophus desde entonces y E. coli. Algunos fenómenos observados que explican la alta recuperación de E. coli PHB son: 1) algunos gránulos de PHB son lo suficientemente grandes y por lo tanto aumenta la estabilidad, y 2) los más los gránulos de PHB, más débil es la E. coli pared celular y por lo tanto se convierte en el organismo huésped es más fácil de degradar.
Recuperación
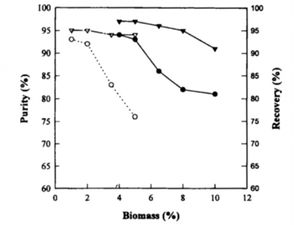
La recuperación es el paso crucial de la producción de PHB, ya que podría hacer que la producción sea económicamente eficiente o ineficiente. Uno de los tratamientos de recuperación comúnmente utilizado es el hipoclorito de sodio [10]. Recuperación PHB utilizando hipoclorito de sodio resultados del tratamiento en la recuperación del 95% en recombinante E. coli. En la etapa de recuperación, mayor será la concentración de la biomasa, mejor será la recuperación es. Sin embargo, la pureza disminuye a medida que aumenta la concentración de biomasa. PHB recuperó utilizando 20% el rendimiento de hipoclorito de sodio 3,5% concentración de biomasa máxima y 83% de pureza (Figura 7). Debido a la incompatibilidad entre la concentración de biomasa y la pureza de PHB, el tratamiento de hipoclorito de sodio no satisface los criterios necesarios para que la producción de PHB más rentable.
Otro tratamiento para la recuperación PHB es SDS que ha sido probado para ser fácil de realizar y cuesta mucho más bajo que el tratamiento de hipoclorito de sodio. SDS puede dar lugar a tan alta como 93% PHB cuando se usa la biomasa de 5% de concentración (Figura 7). Sin embargo, el porcentaje de recuperación disminuye a medida que la concentración de biomasa sube debido a la cantidad mayor de ácido nucleico de ser liberado, lo que conduce a la formación de la suspensión, así como un aumento de la viscosidad.
Temperatura y tiempo
El tiempo de tratamiento óptimo para la recuperación PHB en SDS es de 60 minutos a 30 C [10].
Mezcla de sustratos
Una forma de mejorar la tasa de productividad PHB es mediante el uso de más de una fuente de carbono. Mediante el uso de una mezcla de acetato y la glucosa, en lugar de sólo el acetato o solamente la glucosa, la eficiencia de la conversión de carbono sube aproximadamente 82% [9]. La adición de formiato de metanol también muestra la retroalimentación positiva en la productividad; aumenta la eficiencia de 22,3 a 36,7%. Al tener diferentes fuentes de carbono, la vía de la síntesis de PHB podría evitar una posible vía sin salida. Además, dado que el equilibrio redox de la biosíntesis de PHB no es energéticamente neutral, la mezcla de sustratos altamente energéticas y poco energéticas puede superar este problema. Por ejemplo, una mezcla de glucosa y acetato como sustratos para la biosíntesis de PHB es eficaz en superar el problema mencionado anteriormente porque la glucosa es altamente energético y el acetato es el opuesto de la glucosa. Parte de acetato debe ser utilizado en la reacción redox para volver a generar energía. En presencia de glucosa, acetato no tiene que someterse al proceso de degradación. En su lugar, la realización de PHB a partir de glucosa libera una suma de la energía que puede ser utilizada para asimilar de etilo.
Otros roles y Desventajas
Otros papeles de Alcaligenes eutrophus
Agente Biorremediación
Alcaligenes eutrophus han desarrollado resistencia a iones de metales pesados a través de mutaciones y por lo tanto puede crecer en presencia aquellos iones de otro modo letales [13]. De hecho, esta bacteria puede disminuir drásticamente la concentración de Cd2 + en un cultivo de 200 ppm a 2 ppm, así como Zn2 + concentración de 600 ppm a 10 ppm. Por lo tanto, A. eutrophus es particularmente útil en el tratamiento de aguas residuales industriales. Por otra parte, A. eutrophus también puede biorremediar suelos contaminados. Sin embargo, se necesita más investigación con el fin de obtener una comprensión completa de cómo puede funcionar eficazmente como agente de biorremediación de suelos.
El nitrato reductasa
La cepa H16 de Alcaligenes eutrophus puede reducir el nitrato altamente tóxico [14]. Muchas bacterias utilizan nitrato como su principal fuente de nitrógeno. Para el nitrógeno al ser metabolizado, que tiene que ser convertido primero en nitrito y luego a amoníaco. El metabolismo de nitrato puede ser anaeróbica y aeróbica. En muchos tipos de bacterias, tales como Alcaligenes eutrophus H16, de dinitrógeno es el producto de la respiración, con nitrógeno que sirve como aceptor final de electrones.
Algunos inconvenientes
Aunque los plásticos biodegradables pueden parecer una alternativa ecológica a los plásticos no biodegradables, hay algunas desventajas. La degradación de plástico biodegradable a base de aceite puede resultar en la liberación de dióxido de carbono, un gas de efecto invernadero perjudiciales que participa en el calentamiento global. La degradación de los plásticos biodegradables a base de almidón puede no tener subproductos nocivos tales como CO 2 gas. Sin embargo, tienen el potencial de contaminar el suelo y el agua [11]. La bolsa de plástico oxo-biodegradables es otro tipo de polímero biodegradable que provoca una serie de preocupaciones con respecto a los desechos de metal [12]. Este tipo de plástico contiene algunas sales de metales, tales como cobalto, hierro o manganeso, y se degrada en presencia de luz solar y el oxígeno. A pesar de que su proceso de degradación toma un tiempo mucho más corto que el plástico a base de petróleo (que puede tardar hasta cientos de años), todavía hay posibilidades de que algunos de los metales no se degrada. Esto es porque la degradación completa de plástico biodegradable oxo es altamente dependiente de la microorganismo en el medio ambiente.También, ya que necesita oxígeno y la luz solar, la posibilidad de que a partir de degradar gotas a casi cero cuando está enterrado en el suelo o en otros residuos. Oxo plástico biodegradable también probablemente no degradarse durante el invierno ya que su tasa de catabolismo disminuye a medida que la temperatura baja y la humedad sube.
No hay comentarios:
Publicar un comentario