Arabidopsis lyrata es una especie de planta con flores en la familia Brassicaceae , estrechamente relacionada con el organismo modelo Arabidopsis thaliana .
Arabidopsis lyrata son plantas diploides que tienen una vida útil de dos o más años, pequeñas flores blancas y hojas basales muy distintas con una altura de 10 a 40 centímetros (4 a 16 pulgadas). [1] Las hojas del tallo están dispuestas alternativamente, con márgenes lineales y ligeramente curvados que son lisos y tienen una base cónica. [1] Las hojas de Arabidopsis lyrata tienen glucosinolatos y tricomas como mecanismos de defensa contra los herbívoros de insectos y cualquier otra amenaza potencial, como incendios y actividad humana. [1]
"Las flores de esta especie son bastante pequeñas, con un tamaño de 3 a 8 mm, son de color blanco puro con cuatro lóbulos, y nacen en pedicelos que se elevan, que varían de 7 a 12 mm de longitud". [1] Estas plantas son polinizadas por insectos y tienden a florecer entre los meses de mayo hasta junio y producen frutos a principios de agosto. [1] El fruto de Arabidopsis lyrata mide aproximadamente 2–4.5 milímetros (0.08–0.18 pulg.) De largo, alargado y parecido al papel, mientras que las semillas tienen 1 mm (0.04 pulg.) De largo y están dispuestas en fila. [1]
Hábitat y rango [ editar ]
Arabidopsis lyrata se encuentra principalmente en ambientes subárticos o subalpinos con suelos delgados, como rocas , eskers y taludes , o zonas costeras expuestas. [1] Las plantas individuales pueden formar rosetas solitarias y pueden reproducirse asexualmente a través de parches clonales. [1] Por último, Arabidopsis no sobrevive en agroecosistemas en los que las malas hierbas son rampantes; funciona mejor bajo poca competencia y, por lo tanto, tiene un ciclo de vida que depende de la germinación, el crecimiento y el establecimiento de semillas en un período de tiempo muy corto antes de que otras especies de plantas puedan evitar el acceso a la luz. [2]
Arabidopsis lyrata tiene una distribución circumpolar , lo que significa que se encuentra en el norte y centro de Europa, Asia y América del Norte. [3] En el estado de Virginia, EE. UU., Se puede encontrar creciendo en bosques rocosos, páramos y grietas o repisas de tierra delgada en afloramientos de piedra caliza, dolomita, limolita, metasiltstone, anfibolita, metabasalt, diabase y otros máficos y felsicos. rocas ígneas y metamórficas. [4] También se encuentra en áreas del este de los Estados Unidos donde generalmente se limita a barras de arena . [5] En Europa se ha encontrado en el sur de Alemania y en áreas restringidas de Suecia. [5]
Conservación [ editar ]
Arabidopsis lyrata tiene un amplio rango geográfico, pero a menudo se limita a poblaciones pequeñas y aisladas, lo que lleva a un estado de conservación que varía según las jurisdicciones. [6] Se considera escaso pero no amenazado en el Reino Unido; su distribución está muy dispersa en toda Escocia con poblaciones únicas en Gales y Shetland . [6] Está en peligro o amenazado en varios estados de los Estados Unidos, que incluyen Ohio, Vermont y Massachusetts. [6] Sin embargo, Arabidopsis lyrata no está incluida en la Lista Roja de la UICN . [5]
Fisiología [ editar ]
Poblaciones geográficamente aisladas, dentro de Europa, de Arabidopsis lyrata ssp. Petraea ha demostrado ser metabólicamente diferentes entre sí. [7] [8] Estas poblaciones también tienen un metabolismo distinto cuando se exponen a temperaturas frías en condiciones experimentales. [9]
Reproducción [ editar ]
Poblaciones norteamericanas de Arabidopsis lyrata ssp. Los lyrata generalmente se cruzan en el centro de la distribución, pero exhiben un cambio hacia el selfing en los márgenes del rango. [10]
Importancia para los humanos [ editar ]
Las especies de Arabidopsis proporcionan la capacidad de responder preguntas en la investigación de especiación debido a que tienen un ciclo reproductivo relativamente corto y son fáciles de mantener. "Además, Arabidopsis lyrata varía considerablemente en cuanto a la preferencia del hábito, la adaptación al entorno local, las estrategias de historia de vida, la estructura del genoma, el sistema de apareamiento y el número de cromosomas". [11] Ha sido particularmente útil para comprender cómo divergen las poblaciones y cómo surgen las barreras reproductivas. [11] Las especies de Arabidopsis también han sido comidas por los pueblos indígenas de Alaska , que comen las hojas cocinándolas como vegetales o las usan crudas en ensaladas.

Arabidopsis thaliana , el berro de thale , berro de oreja de ratón o arabidopsis , es una pequeña planta con flores nativa de Eurasia y África . [2] [3] [4] [5] [6] [7] A. thaliana se considera una maleza; Se encuentra al costado de las carreteras y en tierras perturbadas.
Una anual de invierno con un ciclo de vida relativamente corto, A. thaliana es un organismo modelo popular en biología y genética de plantas . Para un eucariota multicelular complejo , A. thaliana tiene un genoma relativamente pequeño de aproximadamente 135 pares de megabase (Mbp). [8] Fue la primera planta en secuenciar su genoma, y es una herramienta popular para comprender la biología molecular de muchos rasgos de la planta, incluido el desarrollo de flores y la detección de luz .

Descripción [ editar ]
Arabidopsis thaliana es una planta anual (rara vez bienal ), que suele crecer hasta 20-25 cm de altura. [6] Las hojas forman una roseta en la base de la planta, con algunas hojas también en el tallo floreciente. Las hojas basales son de color verde a ligeramente púrpura, de 1.5–5 cm de largo y 2–10 mm de ancho, con un margen entero a aserrado; las hojas del tallo son más pequeñas y sin tallos, generalmente con un margen completo. Las hojas están cubiertas de pequeños pelos unicelulares llamados tricomas . Las flores tienen 3 mm de diámetro, dispuestas en un corimbo ; su estructura es la de las típicas Brassicaceae . El fruto es unsiliqua de 5–20 mm de largo, que contiene 20–30 semillas . [9] [10] [11] [12] Las raíces tienen una estructura simple, con una única raíz primaria que crece verticalmente hacia abajo, produciendo más tarde raíces laterales más pequeñas. Estas raíces forman interacciones con bacterias rizosféricas como Bacillus megaterium . [13]
A. thaliana puede completar todo su ciclo de vida en seis semanas. El tallo central que produce flores crece después de aproximadamente tres semanas, y las flores se autopolinizan naturalmente. En el laboratorio, A. thaliana puede cultivarse en placas de Petri, macetas o hidroponía, bajo luces fluorescentes o en un invernadero. [14]
Taxonomía [ editar ]
La planta fue descrita por primera vez en 1577 en las montañas de Harz por Johannes Thal (1542-1583), un médico de Nordhausen , Thüringen , Alemania, que la llamó Pilosella siliquosa . En 1753, Carl Linnaeus renombró la planta Arabis thaliana en honor de Thal. En 1842, el botánico alemán Gustav Heynhold erigió el nuevo género Arabidopsis y colocó la planta en ese género. El nombre del género, Arabidopsis , proviene del griego , que significa "parecido a Arabis"(el género en el que Linneo lo había colocado inicialmente).
Se han recolectado miles de accesiones endogámicas naturales de A. thaliana de toda su área de distribución natural e introducida. [15] Estas accesiones exhiben una considerable variación genética y fenotípica que se puede utilizar para estudiar la adaptación de esta especie a diferentes ambientes. [15]
Distribución y hábitat [ editar ]
A. thaliana es originaria de Europa , Asia , África , y las observaciones humanas indican que su distribución geográfica es bastante continua desde el Mediterráneo a Escandinavia y de España a Grecia . [16] También parece ser nativo en ecosistemas alpinos tropicales en África y quizás en Sudáfrica. [17] [18] Se ha introducido y naturalizado en todo el mundo, [19] incluso en América del Norte ca. el siglo 17 [20]
A. thaliana crece fácilmente y a menudo es pionera en suelos rocosos, arenosos y calcáreos. Generalmente se considera una maleza, debido a su distribución generalizada en campos agrícolas, carreteras, líneas de ferrocarril, terrenos baldíos y otros hábitats perturbados, [19] [21] pero debido a su capacidad competitiva limitada y su pequeño tamaño no se clasifica como un hierba nociva [22] Como la mayoría de las especies de Brassicaceae, A. thaliana es comestible para los humanos como ensalada o cocinada, pero no goza de un uso generalizado como vegetal de primavera. [19]
Usar como organismo modelo [ editar ]
Los botánicos y biólogos comenzaron a investigar A. thaliana a principios del siglo XX, y la primera descripción sistemática de mutantes se realizó alrededor de 1945. [23] A. thaliana ahora se usa ampliamente para estudiar ciencias de las plantas , incluida la genética , la evolución , la genética de poblaciones y desarrollo de plantas. [24] [25] [26] Aunque A. thaliana tiene poca importancia directa para la agricultura, tiene varios rasgos que lo convierten en un modelo útil para comprender la biología genética, celular y molecular de las plantas con flores.
El primer mutante en A. thaliana fue documentado en 1873 por Alexander Braun , describiendo un fenotipo de doble flor (el gen mutado era probablemente ágamo , clonado y caracterizado en 1990). [27] Sin embargo, no fue hasta 1943 que Friedrich Laibach (quien había publicado el número de cromosoma en 1907) propuso A. thaliana como organismo modelo. [28] Su estudiante, Erna Reinholz, publicó su tesis sobre A. thaliana en 1945, describiendo la primera colección de mutantes de A. thaliana que generaron mediante mutagénesis de rayos X . Laibach continuó sus importantes contribuciones a la investigación de A. thaliana mediante la recopilación de una gran cantidad de accesiones (a menudo referidas como " ecotipos "). Con la ayuda de Albert Kranz, se organizaron en una gran colección de 750 accesiones naturales de A. thaliana de todo el mundo.
En las décadas de 1950 y 1960, John Langridge y George Rédei jugaron un papel importante en el establecimiento de A. thaliana como un organismo útil para experimentos de laboratorio biológico. Rédei escribió varias revisiones académicas instrumentales para presentar el modelo a la comunidad científica. El inicio de la comunidad de investigación de A. thaliana data de un boletín llamado Servicio de Información de Arabidopsis (AIS), establecido en 1964. La primera Conferencia Internacional de Arabidopsis se celebró en 1965, en Gotinga , Alemania.
En la década de 1980, A. thaliana comenzó a ser ampliamente utilizada en laboratorios de investigación de plantas en todo el mundo. Fue uno de varios candidatos que incluyeron maíz , petunia y tabaco . [28] Los dos últimos eran atractivos, ya que eran fácilmente transformables con las tecnologías actuales, mientras que el maíz era un modelo genético bien establecido para la biología de las plantas. 1986 fue un año decisivo para A. thaliana como planta modelo, en la que se describió la transformación mediada por T-DNA y el primer gen clonado de A. thaliana . [29] [30]
Genómica [ editar ]
Genoma nuclear [ editar ]
El pequeño tamaño de su genoma y el hecho de que es diploide hace que Arabidopsis thaliana sea útil para el mapeo genético y la secuenciación , con aproximadamente 135 mega pares de bases [33] y cinco cromosomas , A. thaliana tiene uno de los genomas más pequeños entre las plantas. [8] Durante mucho tiempo se pensó que tenía el genoma más pequeño de todas las plantas con flores, [34] pero ahora se considera que ese título pertenece a las plantas del género Genlisea , orden Lamiales , con Genlisea tuberosa , una planta carnívora, que muestra un tamaño del genoma de aproximadamente 61 Mbp.[35] Fue el primer genoma vegetal secuenciado, completado en 2000 por la Iniciativa del Genoma Arabidopsis. [36] La versión más actualizada delgenoma de A. thaliana es mantenida por el Arabidopsis Information Resource (TAIR). [37] Se ha trabajado mucho para asignar funciones a sus 27,000 genes y las 35,000 proteínas que codifican. [38] La investigación postgenómica, como la metabolómica, también ha proporcionado información útil sobre el metabolismo de esta especie y cómo las perturbaciones ambientales [39] pueden afectar los procesos metabólicos. [40]
Genoma del cloroplasto [ editar ]
El plastoma de Arabidopsis thaliana es una molécula de ADN de 154,478 pares de bases de largo, [31] un tamaño que se encuentra típicamente en la mayoría de las plantas con flores (ver la lista de plastomas secuenciados ). Comprende 136 genes que codifican proteínas ribosómicas de subunidades pequeñas ( rps , en amarillo: ver figura), proteínas ribosómicas de subunidades grandes ( rpl , naranja), proteínas hipotéticas de marco abierto de lectura de cloroplastos ( ycf , limón), proteínas involucradas en reacciones fotosintéticas (verde) o en otras funciones (rojo), ARN ribosómico ( rrn , azul) y ARN de transferencia ( trn , negro). [32]
Genoma mitocondrial [ editar ]
El genoma mitocondrial de Arabidopsis thaliana tiene 367,808 pares de bases de largo y contiene 57 genes. [41] Hay muchas regiones repetidas en el genoma mitocondrial de Arabidopsis . Las repeticiones más grandes se recombinan regularmente e isomerizan el genoma. [42] Como la mayoría de los genomas mitocondriales de las plantas, el genoma mitocondrial de Arabidopsis existe como una disposición compleja de superposición de moléculas ramificadas y lineales in vivo . [43]
Genética [ editar ]
La transformación genética de A. thaliana es rutinaria, utilizando Agrobacterium tumefaciens para transferir ADN al genoma de la planta. El protocolo actual, denominado "inmersión floral", implica simplemente sumergir las flores en una solución que contiene Agrobacterium que lleva un plásmido de interés y un detergente. [44] [45] Este método evita la necesidad de cultivo de tejidos o regeneración de plantas.
Las colecciones de genes inactivados de A. thaliana son un recurso único para la biología vegetal que es posible gracias a la disponibilidad de transformación de alto rendimiento y la financiación de recursos genómicos. El sitio de inserciones de T-DNA se ha determinado para más de 300,000 líneas transgénicas independientes, con la información y las semillas accesibles a través de bases de datos en línea de T-DNA . A través de estas colecciones, los mutantes de inserción están disponibles para la mayoría de los genes en A. thaliana .
Las accesiones caracterizadas y las líneas mutantes de A. thaliana sirven como material experimental en estudios de laboratorio. Las líneas de fondo más utilizadas son L er (Landsberg erecta ) y Col o Columbia. [46] Otras líneas de fondo que se citan con menos frecuencia en la literatura científica son Ws, o Wassilewskija, C24, Cvi, o las islas de Cabo Verde, Nossen, etc. (ver el ej. [47] ) Conjuntos de accesiones estrechamente relacionadas llamadas Col- 0, Col-1, etc., se han obtenido y caracterizado; en general, las líneas mutantes están disponibles a través de centros de existencias, de los cuales los más conocidos son el Nottingham Arabidopsis Stock Center-NASC [46] y el Arabidopsis Biological Resource Center-ABRC en Ohio, EE. UU. [48] La adhesión Col-0 fue seleccionada por Rédei dentro de una población (no irradiada) de semillas denominada 'Landsberg' que recibió de Laibach. [49] Columbia (llamada así por la ubicación de la antigua institución de Rédei, la Universidad de Missouri en Columbia ) fue la adhesión de referencia secuenciada en la Iniciativa del Genoma de Arabidopsis . La línea L er (Landsberg erecta ) fue seleccionada por Rédei (debido a su baja estatura) de una población de Landsberg que había mutagenizado con rayos X. Como la colección L er de mutantes se deriva de esta línea inicial, L er -0 no corresponde a las accesiones de Landsberg, que designaron La-0, La-1, etc.
La formación de tricomas es iniciada por la proteína GLABROUS1. Knockouts del gen correspondiente conducen a plantas glabras . Este fenotipo ya se ha utilizado en experimentos de edición de genes y podría ser de interés como marcador visual para la investigación de plantas para mejorar los métodos de edición de genes como CRISPR / Cas9. [50] [51]
Controversia de herencia no mendeliana [ editar ]
En 2005, los científicos de la Universidad de Purdue propusieron que A. thaliana poseía una alternativa a los mecanismos previamente conocidos de reparación del ADN , produciendo un patrón inusual de herencia . Sin embargo, el fenómeno observado (reversión de copias mutantes del gen HOTHEAD a un estado de tipo salvaje) se sugirió más tarde como un artefacto porque los mutantes muestran un aumento de cruzamiento debido a la fusión de órganos. [52] [53] [54]
Ciclo de vida [ editar ]
El pequeño tamaño de la planta y su rápido ciclo de vida también son ventajosos para la investigación. Habiéndose especializado como un efímero de primavera , se ha utilizado para encontrar varias cepas de laboratorio que tardan aproximadamente seis semanas desde la germinación hasta la semilla madura. El pequeño tamaño de la planta es conveniente para el cultivo en un espacio pequeño, y produce muchas semillas. Además, la naturaleza selfing de esta planta ayuda a los experimentos genéticos. Además, como planta individual puede producir varios miles de semillas; cada uno de los criterios anteriores lleva a A. thaliana a ser valorada como un organismo modelo genético.
Desarrollo [ editar ]
Desarrollo de flores [ editar ]
A. thaliana ha sido ampliamente estudiada como modelo para el desarrollo de flores. La flor en desarrollo tiene cuatro órganos básicos: sépalos , pétalos , estambres y carpelos (que forman pistilos ). Estos órganos están dispuestos en una serie de espirales: cuatro sépalos en el espiral exterior, seguidos por cuatro pétalos dentro de este, seis estambres y una región central del carpelo. Las mutaciones homeóticas en A. thaliana dan como resultado el cambio de un órgano a otro; en el caso de la mutación ágama , por ejemplo, los estambres se convierten en pétalos y los carpelos se reemplazan con una nueva flor, lo que resulta en un patrón de pétalo de pétalo de sépalo repetidamente recursivo. .
Las observaciones de mutaciones homeóticas llevaron a la formulación del modelo ABC de desarrollo de flores por E. Coen y E. Meyerowitz . [55] Según este modelo, los genes de identidad de los órganos florales se dividen en tres clases: genes de clase A (que afectan a sépalos y pétalos), genes de clase B (que afectan a pétalos y estambres) y genes de clase C (que afectan a estambres y carpelos ) Estos genes codifican los factores de transcripción que se combinan para causar la especificación del tejido en sus respectivas regiones durante el desarrollo. Aunque desarrollado a través del estudio de las flores de A. thaliana , este modelo es generalmente aplicable a otras plantas con flores .
Desarrollo de la hoja [ editar ]
Los estudios de A. thaliana han proporcionado importantes conocimientos con respecto a la genética de la morfogénesis de las hojas, particularmente en plantas de tipo dicotiledóneo . [56] [57] Gran parte de la comprensión proviene del análisis de mutantes en el desarrollo de las hojas, algunos de los cuales se identificaron en la década de 1960, pero no se analizaron con técnicas genéticas y moleculares hasta mediados de la década de 1990. Las hojas de A. thaliana se adaptan bien a los estudios del desarrollo de las hojas porque son relativamente simples y estables.
Usando A. thaliana , la genética detrás del desarrollo de la forma de la hoja se ha vuelto más clara y se ha dividido en tres etapas: el inicio del primordio de la hoja , el establecimiento de la dorsiventralidad y el desarrollo de un meristemo marginal . Los primordios foliares se inician mediante la supresión de los genes y las proteínas de la familia KNOX de clase I (como SHOOT APICAL MERISTEMLESS ). Estas proteínas KNOX de clase I suprimen directamente la biosíntesis de giberelina en el primordio de la hoja. Se descubrió que muchos factores genéticos están involucrados en la supresión de estos genes KNOX de clase I en los primordios foliares (como las HOJAS ASIMÉTRICAS1, HOJA EN PETIOLE1 , SAWTOOTH1 , etc.). Por lo tanto, con esta supresión, los niveles de giberelina aumentan y el primordio foliar inicia el crecimiento.
El establecimiento de la dorsiventralidad de la hoja es importante ya que la superficie dorsal (adaxial) de la hoja es diferente de la superficie ventral (abaxial). [58]
Microscopía [ editar ]
A. thaliana es muy adecuada para el análisis de microscopía óptica . Las plántulas jóvenes en general, y sus raíces en particular, son relativamente translúcidas. Esto, junto con su pequeño tamaño, facilita la obtención de imágenes de células vivas utilizando microscopía de escaneo láser fluorescente y confocal . [59] Mediante el montaje húmedo de plántulas en agua o en medios de cultivo, las plantas pueden tomar imágenes de manera no invasiva, lo que evita la necesidad de fijación y seccionamiento y permite mediciones de lapso de tiempo . [60] Las construcciones de proteínas fluorescentes se pueden introducir a través de la transformación . El desarrolloLa etapa de cada célula se puede inferir de su ubicación en la planta o mediante el uso de marcadores de proteínas fluorescentes , lo que permite un análisis detallado del desarrollo .
Fisiología [ editar ]
Detección de luz, emisión de luz y biología circadiana [ editar ]
Los fotorreceptores fitocromos A, B, C, D y E median la respuesta fototrópica basada en la luz roja. Comprender la función de estos receptores ha ayudado a los biólogos de plantas a comprender las cascadas de señalización que regulan el fotoperiodismo , la germinación , la desaceleración y la evitación de sombra en las plantas.
A. thaliana se utilizó ampliamente en el estudio de las bases genéticas del fototropismo , la alineación del cloroplasto y la apertura estomática y otros procesos influenciados por la luz azul. [61] Estos rasgos responden a la luz azul, que es percibida por los receptores de fototropina . Arabidopsis también ha sido importante para comprender las funciones de otro receptor de luz azul, el criptocromo , que es especialmente importante para el arrastre de luz para controlar los ritmos circadianos de las plantas . [62] Cuando el inicio de la oscuridad es inusualmente temprano, A. thalianareduce su metabolismo de almidón en una cantidad que efectivamente requiere división . [63]
Incluso se encontraron respuestas a la luz en las raíces, que anteriormente se consideraba insensibles a la luz. Si bien la respuesta gravitrópica de los órganos de la raíz de A. thaliana es su respuesta tropical predominante, las muestras tratadas con mutágenos y seleccionadas por la ausencia de acción gravitrópica mostraron una respuesta fototrópica negativa a la luz azul o blanca, y una respuesta positiva a la luz roja, lo que indica que las raíces también Mostrar fototropismo positivo. [64]
En 2000, la Dra. Janet Braam de la Universidad de Rice diseñó genéticamente A. thaliana para brillar en la oscuridad cuando la tocaban. El efecto era visible para las cámaras ultrasensibles. [sesenta y cinco]
Múltiples esfuerzos, incluido el proyecto Glowing Plant , han tratado de utilizar A. thaliana para aumentar la intensidad de luminiscencia de la planta hacia niveles comercialmente viables.
En la luna [ editar ]
A partir del 2 de enero de 2019, el módulo de aterrizaje Chang'e-4 de China trajo a A. thaliana a la luna. [66] Un pequeño 'estaño' de microcosmos en el módulo de aterrizaje contenía A. thaliana , semillas de papas y huevos de gusanos de seda . Como las plantas soportarían los gusanos de seda con oxígeno, y los gusanos de seda proporcionarían a las plantas el dióxido de carbono y los nutrientes necesarios a través de sus desechos, [67] los investigadores evaluarán si las plantas realizan con éxito la fotosíntesis y si crecen y florecen en el entorno lunar. [66]
Interacciones planta-patógeno [ editar ]
Es importante comprender cómo las plantas logran resistencia para proteger la producción mundial de alimentos, así como la industria agrícola. Se han desarrollado muchos sistemas modelo para comprender mejor las interacciones entre las plantas y los patógenos bacterianos , fúngicos , oomicetos , virales y nematodos . Arabidopsis thaliana ha sido una herramienta poderosa para el estudio de la subdiciplina de la patología de las plantas , es decir, la interacción entre las plantas y los patógenos causantes de enfermedades .
| Tipo de patógeno | Ejemplo en Arabidopsis thaliana |
|---|---|
| Las bacterias | Pseudomonas syringae , Xanthomonas campestris |
| Hongos | Colletotrichum destructivum , Botrytis cinerea , Golovinomyces orontii |
| Oomiceto | Hyaloperonospora arabidopsidis |
| Viral | Virus del mosaico de la coliflor (CaMV) , virus del mosaico del tomate (TMV) |
| Nematodo | Meloidogyne incognita , Heterodera schachtii |
El uso de A. thaliana ha llevado a muchos avances en el avance del conocimiento de cómo las plantas manifiestan resistencia a las enfermedades de las plantas . La razón por la cual la mayoría de las plantas son resistentes a la mayoría de los patógenos es a través de la resistencia no host. Esto es, no todos los patógenos infectarán a todas las plantas. Un ejemplo en el que se usó A. thaliana para determinar los genes responsables de la resistencia no hostil es Blumeria graminis , el agente causal del mildiu polvoriento de los pastos. Los mutantes de A. thaliana se desarrollaron usando el metanosulfonato de etilo mutagénico y se seleccionaron para identificar mutantes con infección aumentada por B. graminis . [68] [69] [70]Los mutantes con tasas de infección más altas se denominan mutantes PEN debido a la capacidad de B. graminis para penetrar en A. thaliana para comenzar el proceso de la enfermedad. Los genes PEN se mapearon más tarde para identificar los genes responsables de la resistencia no hostil a B. graminis .
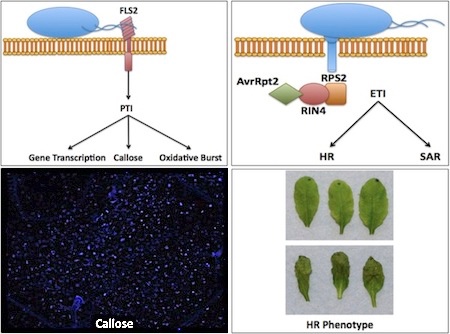
En general, cuando una planta se expone a un patógeno o microbio no patógeno , hay una respuesta inicial, conocida como inmunidad activada por PAMP (PTI), porque la planta detecta motivos conservados conocidos como patrones moleculares asociados a patógenos (PAMP). [71] Estos PAMP son detectados por receptores especializados en el huésped conocido como receptores de reconocimiento de patrones (PRR) en la superficie celular de la planta.
La PRR mejor caracterizada en A. thaliana es FLS2 (Flagellin-Sensing2), que reconoce la flagelina bacteriana , [72] [73] un orgánulo especializado utilizado por microorganismos con fines de movilidad, así como el ligando flg22, que comprende el 22 aminoácidos reconocidos por FLS2. El descubrimiento de FLS2 se facilitó mediante la identificación de un ecotipo de A. thaliana , Ws-0, que no pudo detectar flg22, lo que condujo a la identificación del gen que codifica FLS2. FLS2 muestra una sorprendente similitud con el arroz XA21, el primer PRR aislado en 1995
Un segundo PRR, el receptor EF-Tu (EFR), identificado en A. thaliana , reconoce la proteína bacteriana EF-Tu , el factor de alargamiento procariota utilizado en la síntesis de proteínas , así como el ligando elf18 utilizado en laboratorio. [74] Utilizando la transformación mediada por Agrobacterium , una técnica que aprovecha el proceso natural mediante el cual Agrobacterium transfiere genes a las plantas huésped, el gen EFR se transformó en Nicotiana benthamiana , una planta de tabaco que no reconoce EF-Tu, lo que permite el reconocimiento de bacteriana EF-Tu [75] confirmando así EFR como el receptor de EF-Tu.
Tanto FLS2 como EFR utilizan rutas de transducción de señal similares para iniciar PTI. A. thaliana ha sido instrumental en la disección de estas vías para comprender mejor la regulación de las respuestas inmunes, la más notable es la cascada de la proteína quinasa activada por mitógeno (MAP quinasa). Las respuestas posteriores de PTI incluyen el depósito de callosa , el estallido oxidativo y la transcripción de genes relacionados con la defensa. [76]
PTI es capaz de combatir los patógenos de manera inespecífica. Una respuesta más fuerte y más específica en las plantas es la de la inmunidad activada por efectores (ETI). La ETI depende del reconocimiento de los efectores patógenos, proteínas secretadas por el patógeno que altera las funciones en el huésped, por los genes de resistencia de las plantas (genes R) , a menudo descritos como una relación de gen por gen . Este reconocimiento puede ocurrir directa o indirectamente a través de una proteína guardee en una hipótesis conocida como la hipótesis de la guarda . El primer gen R clonado en A. thaliana fue RPS2 (resistencia a Pseudomonas syringae 2), que es responsable del reconocimiento del efector avrRpt2. [77] El efector bacteriano avrRpt2 se entrega enA. thaliana a través del sistema de secreción Tipo III de P. syringae pv cepa de tomate DC3000 . El reconocimiento de avrRpt2 por RPS2 se produce a través de la proteína guardee RIN4, que se escinde. El reconocimiento de un efector patógeno conduce a una respuesta inmune dramática conocida como la respuesta hipersensible , en la que las células vegetales infectadas sufren la muerte celular para evitar la propagación del patógeno. [78]
La resistencia adquirida sistémica (SAR) es otro ejemplo de resistencia que se entiende mejor en las plantas debido a la investigación realizada en A. thaliana . El benzotiadiazol (BTH), un análogo del ácido salicílico (SA), se ha utilizado históricamente como un compuesto antifúngico en plantas de cultivo. Se ha demostrado que BTH, así como SA, inducen SAR en las plantas. La iniciación de la vía SAR se demostró por primera vez en A. thaliana en la que los niveles no aumentados de SA son reconocidos por ninguno de los genes PR 1 (NPR1) [79] debido al cambio redox en el citosol, lo que resulta en la reducción de NPR1. NPR1, que generalmente existe en un estado multiplex (oligomérico), se vuelve monomérico (una sola unidad) tras la reducción. [80]Cuando NPR1 se vuelve monomérico, se transloca al núcleo, donde interactúa con muchos factores de transcripción de TGA , y es capaz de inducir genes relacionados con patógenos como PR1. [81] Otro ejemplo de SAR sería la investigación realizada con plantas de tabaco transgénicas, que expresan la salicilato hidroxilasa bacteriana, gen nahG, requiere la acumulación de SA para su expresión [82]
Aspecto evolutivo de la resistencia a patógenos de plantas [ editar ]
Las plantas se ven afectadas por múltiples patógenos a lo largo de su vida. En respuesta a la presencia de patógenos, las plantas han desarrollado receptores en la superficie celular para detectar y responder a los patógenos. [83] Arabidopsis Thaliana es un organismo modelo utilizado para determinar los mecanismos de defensa específicos de la resistencia a los patógenos de las plantas. [84] Estas plantas tienen receptores especiales en sus superficies celulares que permiten la detección de patógenos e inician mecanismos para inhibir el crecimiento de patógenos. [84] Contienen dos receptores, FLS2 (receptor de flagelina bacteriana) y EF-Tu (proteína bacteriana EF-Tu), que utilizan vías de transducción de señales para iniciar la vía de respuesta a la enfermedad. [84]La vía conduce al reconocimiento del patógeno causando que las células infectadas experimenten la muerte celular para detener la propagación del patógeno. [84] Las plantas con receptores FLS2 y EF-Tu han demostrado tener una mayor aptitud en la población. [82] Esto ha llevado a creer que la resistencia a los patógenos de las plantas es un mecanismo evolutivo que se ha acumulado durante generaciones para responder a entornos dinámicos, como el aumento de la depredación y las temperaturas extremas. [82]
A. thaliana también se ha utilizado para estudiar la resistencia adquirida sistémica (SAR). [85] Esta vía utiliza Benzothiadiazol, un inductor químico, para inducir factores de transcripción, ARNm, de genes SAR. Esta acumulación de factores de transcripción conduce a la inhibición de genes relacionados con patógenos. [85]
Las interacciones planta-patógeno son importantes para comprender cómo las plantas han evolucionado para combatir los diferentes tipos de agentes patógenos que pueden afectarlos. [82] La variación en la resistencia de las plantas a través de las poblaciones se debe a la variación en los factores ambientales. Las plantas que han desarrollado resistencia, ya sea la variación general o la variación SAR, han podido vivir más tiempo y evitar la necrosis de sus tejidos (muerte prematura de células), lo que conduce a una mejor adaptación y aptitud para las poblaciones que se encuentran rápidamente ambientes cambiantes.





No hay comentarios:
Publicar un comentario