Equilibrio químico
base fuerte son electrones fuertes que se ionizan completamente en soluciones acuosas, en condiciones de presión y temperatura constantes. Además fundamentalmente son capaces de aceptar protones H+. Una reacción de este tipo viene dada por:
para bases hidroxílicas, y
para bases no hidroxílicas.
Ejemplos de Bases Fuertes:
- NaOH, Hidróxido de sodio
- LiOH, Hidróxido de litio
- KOH, Hidróxido de potasio
Hay otras bases fuertes no hidroxílicas, cuya fuerza se entiende según la segunda reacción mostrada antes. Algunos ejemplos notables son:
- n-BuLi, n-butil-litio
- C6H14LiN, diisopropilamida de litio o LDA
- NaNH2, amiduro de sodio
- NaH, hidruro de sodio
cociente de reacción Qr es una función del grado de reacción: ξ, la proporción relativa de productos y reactivos presentes en la mezcla de reacción en un momento dado. La expresión del Cociente de Reacción (Q)de una reacción tiene la misma ecuación que la expresión de constante de equilibrio para dicha reacción. Sin embargo, el cociente de reacción se calcula utilizando las concentraciones o presiones en un instante dado, y no las concentraciones de equilibrio.
Para una mezcla química con una cierta concentración inicial de reactivos y productos, es útil conocer si la reacción evolucionará "hacia la derecha/en sentido de avance" (aumentando las concentraciones de los productos) o si evolucionará "hacia la izquierda/en sentido inverso" (aumentando las concentraciones de los reactivos). Considerando una expresión general de equilibrio como:
- kA + mB …
 nC + pD ...
nC + pD ...
donde A, B, C, y D son las especies químicas involucradas en esta reacción y k, m, n, y p son los coeficientes estequiométricos para la reacción, el cociente de reacción, Qr, se define como:1
donde { At } indica la actividad instantánea.2 De la especie A en un cierto instante de tiempo (t) y así para las demás especies. El cociente de reacción se da en un instante particular de tiempo, no necesariamente en el momento en que se alcanza el equilibrio. El cociente de reacción está directamente relacionado con el principio de Le Châtelier. Para una reacción en equilibrio químico, la constante de equilibrio, K, puede definirse como:
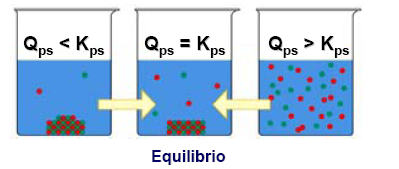
donde {Aeq} es la actividad de la especie A cuando la mezcla está en el equilibrio, etc. Comparando los valores de Qr y K, se puede determinar si la reacción se desplazará a la derecha, a la izquierda, o si la concentración seguirá siendo la misma (equilibrio).
- Si Qr < K : la reacción se desplazará hacia la derecha (es decir, en la dirección de avance, y se formarán más productos)
- Si Qr > K : La reacción se desplazará a la izquierda (es decir, en la dirección inversa, y así se formarán más reactivos)
- Si Qr = K : la reacción está en el equilibrio
La relación del cociente de reacción Qr con la derivada instantánea de la energía libre de Gibbs (ΔG) y la variación de la energía libre estándar de Gibbs (ΔG0) viene dada por:
- ΔG = ΔG0 + RT ln Qr






No hay comentarios:
Publicar un comentario