Dinámica química
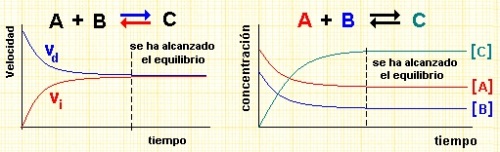
el equilibrio químico es el estado en el que las actividades químicas o las concentraciones de los reactivos y los productos no tienen ningún cambio neto en el tiempo. Normalmente, este sería el estado que se produce cuando una reacción reversible evoluciona hacia adelante en la misma proporción que su reacción inversa. La velocidad de reacción de las reacciones directa e inversa por lo general no son cero, pero, si ambas son iguales, no hay cambios netos en cualquiera de las concentraciones de los reactivos o productos. Este proceso se denomina equilibrio dinámico.- ..............................:https://es.wikipedia.org/w/index.php?title=Especial:Libro&bookcmd=download&collection_id=318f447c8c6d2cf90fde032508a0fb301344cd69&writer=rdf2latex&return_to=Equilibrio+qu%C3%ADmico
EQUILIBRIO QUIMICO
Cuando estamos en presencia de una reacción química, los reactivos se combinan para formar productos a una determinada velocidad. Sin embargo, los productos también se combinan para formar reactivos. Es decir, la reacción toma el sentido inverso. Este doble sentido en las reacciones que es muy común en química, llega a un punto de equilibrio dinámico cuando ambas velocidades se igualan. No hablamos de un equilibrio estático en el que las moléculas cesan en su movimiento, sino que las sustancias siguen combinándose formando tanto productos como reactivos. A este equilibrio lo llamamos equilibrio químico.
El equilibrio químico se representa a través de una expresión matemática llamada constante de equilibrio.
En una reacción hipotética:
aA + bB<——–> cC + dD
La constante de equilibrio esta dado por:
K = ( [D]d . [C]c ) / ( [A]a . [B]b ) (Las minúsculas estan elevadas como potencia).
La constante de equilibrio químico es igual al producto de las concentraciones de los productos elevados a sus coeficientes estequiométricos (c y d) dividido por el producto de las concentraciones de los reactivos elevados a sus coeficientes estequiométricos (a y b). Recordemos que estos coeficientes son los números que equilibran a las reacciones químicas. La constante no varía, por eso es constante. Solo depende de la temperatura. A cada temperatura distinta habrá valoresdiferentes de constantes para la misma reacción. Con respecto a las unidades de K, estas dependerán de la expresión matemática que quede en cada caso particular.
Según el valor que tenga la K de equilibrio, tendremos una idea certera de lo completa que puede llegar a ser una reacción. Si estamos en presencia de una K grande, mucho mayor que 1, la reacción tiende a completarse bastante a favor de los productos. Caso contrario sucede si la K es muy pequeña.
En el caso de aquellas reacciones donde figuren compuestos en estado gaseoso, la constante se denomina Kp en lugar de Kc como normalmente se usa en las reacciones. Kp hace alusión a la presión en lugar de la concentración molar.
Kp = Kc.(R.T)∆ng
R = Constante universal de los gases.
T = Temperatura absoluta.
∆ng = Variación del numero de moles gaseosos.
Principio de Le Chatelier:
Cuando hablamos de equilibrio aplicado a sistemas químicos o físicos, siempre se hace hincapié en el Principio de Le Chatelier. Este principio sostiene que un sistema siempre reaccionará en contra del cambio inducido. Por ejemplo, si una reacción gaseosa aumenta el volumen al formar productos, al aplicarle una presión tendera a formar reactivos, es decir, invertirá su sentido con la finalidad de disminuir esa presión. Otro ejemplo lo tenemos en las reacciones exotérmicas o endotérmicas, las que generan calor o absorben respectivamente. Si a una reacción exotérmica le damos calor, el sistema para disminuir la temperatura, irá hacia la formación de reactivos. De esta manera generara menos calor para atenuar el cambio. Y si es endotérmica formara más productos, y así, absorberá más calor evitando el ascenso térmico.
Cociente de reacción (Q):
Volviendo al tema de la constante de equilibrio, ahora explicaremos el concepto de Cociente de reacción. Matemáticamente es igual a la expresión de K, pero el significado es diferente.
El valor de Q nos indicará hacia donde tendera la reacción, es decir, no se refiere al punto de equilibrio como la K ya que es calculada en un momento distinto al equilibrio. Ahora si calculando Q nos arroja el valor de K concluimos que la reacción se encuentra en el equilibrio.
El valor de Q nos indicará hacia donde tendera la reacción, es decir, no se refiere al punto de equilibrio como la K ya que es calculada en un momento distinto al equilibrio. Ahora si calculando Q nos arroja el valor de K concluimos que la reacción se encuentra en el equilibrio.
Si Q es mayor que K, las concentraciones o presiones parciales de los productos son mucho mayores, entonces la reacción tiende a formar reactivos, es decir, hacia la derecha. Si Q es menor que K, la reacción ira hacia la derecha, es decir, hacia el sentido de la formación de los productos.
PROBLEMAS:
1. Según la siguiente reacción:
A + 2 B <———> C K = 45
Si tenemos en un comienzo de reacción 0,2 moles de A, 0,4 moles de B y 0,6 moles de C en un volumen de 4 litros. Averiguar hacia donde se direcciona la reacción.
Para esto debemos calcular el cociente de reacción (Qc):
Qc = [C] / ( [A] . [B]2 )
Primero calculamos las molaridades de cada especie:
[C] = 0,6moles/4lts. = 0,15M
[B] = 0,4moles/4lts. = 0,10M
[A] = 0,2moles/4lts- = 0,05M
Qc = 0,15 M / [0,05 M . (0,10 M)2]
Qc = 300
Concluimos que este valor es muy superior a la Kc. Por lo tanto la reacción tenderá fuertemente hacia la izquierda. O sea, hacia la foramación de los reactivos.
2. En una determinada reacción se mezclan concentraciones iguales de [HI], [H2] y [I2] = 0.03M. La K a 783°C es de 46. Averiguar qué sentido tomara.
H2(g) + I2(g) <——–> 2 HI(g)
Qc = [IH]2 / ( [H2] . [I2] )
Qc = [0,03 M] 2 / ( [0,03 M] . [0,03 M] ) = 1
Vemos que Q es mucho menor que K. Por lo tanto la reacción conducirá a la formación de productos.
3. Para la siguiente reacción:
H2(g) + Br2(g) <———> 2 HBr(g) Kc es 2,18.106
Averiguar las concentraciones molares de las tres especies en el equilibrio si partimos con una [HBr] de 0.4M.
Debemos plantear la condición de inicio y de equilibrio para establecer los cambios y calcular las concentraciones de las distintas especies en el equilibrio.
Reacción: H2(g) + Br2(g) <———> 2 HBr(g)
Inicio 0 + 0 <———-> 0,4M
Equilibrio x + x <———-> 0,4 – 2x
En el inicio las concentraciones de H2 y de Br2 son cero, porque aún no se han formado nada de estas especies. Pero a medida que transcurre el tiempo se generaran cantidades desconocidas de ambas a expensas de la concentración de HBr. Estas cantidades desconocidas llamadas “x” serán iguales entre si estequiometricamente ya que según la reacción, a partir de 2 moles de HBr se forman un mol de cada especie de la izquierda. Por esta misma razón en el equilibrio a la concentración de HBr habrá que restarle una cantidad “2x”.
Ahora con estas nuevas expresiones de equilibrio iremos a la expresión de la K de equilibrio para calcular la cantidad “x”.
K = [ 0,4 M – 2X ] 2 / [X]2
La resolución de esta ecuación es cuadrática. Despejamos X y desarrollamos el cuadrado de binomio que aparece en el numerador.
K.[X]2 = [0,4M – 2X]2
K.[X]2 = (0,4)2 + 2.(0,4).(-2X) + (-2X)2
K.[X]2 = 0,16 – 1,6x + 4X2
2,18.106 X2 = 0,16 – 1,6x + 4X2
Reordenamos términos e igualamos a cero quedando una ecuación cuadrática. El termino 4X2 pasa a la izquierda para ser restado a 2,18.106 X2. Obviamente es muy pequeño como para producirle una modificación. Por ende la ecuación quedara:
2,18.106 X2 + 1,6 X – 0,16 = 0
La resolución de esta ecuación de segundo grado nos da:
X1 = 2,7.10-4
X2 = – 2,7.10-4
Elegiremos al valor positivo ya que no existen concentraciones negativas. Por lo tanto las concentraciones de las especies son:
[Br2] = 2,7.10-4 M
[H2] = 2,7.10-4M
[HBr] = 0,4M – 2. (2,7.10-4M)
[HBr] = 0,399M
4. En un reactor con capacidad de 10 litros, se añadió 2000 grs. de H2 y carbón solido. Después de cierto tiempo, al alcanzar el equilibrio se detecto que había 0,22 grs. de metano. Calcular la Kc para la reacción.
C (s) + 2 H2 (g) ———> CH4 (g)
Este caso se trata de un equilibrio heterogéneo, ya que se encuentran dos estados de materia distintos, solido y gaseoso. Los sólidos no afectan al equilibrio, se los considera de molaridad igual a 1. Por lo tanto la Kc queda de la siguiente manera:
K = [ CH4] / [H2]2
Debemos pasar los 0,22 gramos de metano y los 2000 gramos de Hidrogeno a moles:
2000
grs . 1 mol/ 2
grs = 1000 moles H2
0,22
grs . 1 mol/ 16
grs = 0,0137 moles CH4
Ahora dividimos ambas cantidades por 10 litros.
[CH4] = 1,37.10-3M
[H2] = 100 M
Kc = [ 1,37.10-3 M] / [ 100M]2
Kc = 1,37.10-7 l/mol
5. Teniendo en cuenta la síntesis de amoniaco. Calcular las concentraciones de todas las especies en el equilibrio partiendo de una concentración inicial de NH3 de 0,5M. K = 4,34.10-3 a 300°C
Reacción N2 + 3 H2 <———> 2 NH3
Reacción N2 + 3 H2 <———> 2 NH3
Inicio 0 + 0 <———-> 0,5M
Equilibrio x + 3x <———> 0,5M – 2x
Kc = [ NH3 ]2 / [N2] . [H2]3
Kc = [ 0,5 – 2x ]2 / x . (3x)3
Kc = [ 0,5 – 2x ]2 / 27 x4
De aquí despejamos x y nos quedaremos con el valor positivo que haga posible las concentraciones.
6. Calcula la constante de equilibrio de la siguiente reacción teniendo en cuenta que se combinan 7.94 moles de hidrógeno con 5.30 moles de Iodo al principio. En el equilibrio se encuentra que hay 9.52 moles de Ioduro de hidrógeno.
H2 + I2 <——–> 2 HI
Para encontrar la constante de equilibrio debemos focalizarnos en el punto de equilibrio. Al inicio no hay nada de HI y en el equilibrio hay 9.52 moles. Esto significa que se consumió parte de los dos reactivos, que como marca la estequiometria son iguales en cantidad de moles. Llamando x a estas cantidades correspondería la cantidad de 2x para el HI. El problema tampoco nos dice el volumen del reactor. Pero no influirá para sacar la molaridad, ya que es el mismo para todas las especies. Por lo tanto podemos trabajar directamente en moles sin cometer errores en los resultados. Volvemos a plantear la reacción al inicio y en el estado de equilibrio:
Reacción: H2 + I2 <———> 2 HI
Inicio 7.94 mol + 5.30 mol<———> 0 mol
Equil 7.94-x 5.30-x <———> 2x
Como vemos 2x es una cantidad que ya tenemos, puesto que corresponde a los 9.52 moles formados en el equilibrio de HI. Por lo tanto x es igual a la mitad de esta cantidad.
X = 9.52/2 = 4.76 moles.
Keq = [(2x)2 ] / [(7.94 – x) . (5.30 – x)]
Keq = (9.52) 2 / [(7.94 – 4.76) . ( 5.30 – 4.76)]
Las unidades de moles se cancelan.
Keq =52.78
A continuación daremos un ejemplo de otro tipo de equilibrio muy visto en los cursos de química. Cuando dos iones de distinta carga se asocian a veces pueden formar precipitados. Esta nueva sal tiene una constante de equilibrio llamada Kps (Constante del producto de solubilidad). Cuando este valor es superado para cada compuesto en particular se formará un precipitado. Cada sal o hidróxido que precipita, tiene su Kps propia y establecida generalmente a 25°C. En la expresión de los Kps solo figuran las concentraciones molares de cada ión en el numerador, no figurando nada en el denominador. Las concentraciones de cada ión tienen que estar en molaridad para establecer el Kps de cada compuesto.
Se mezcla 30 ml de una solución de Sulfato de Sodio 0,0100 M con 10 ml de Cloruro de Bario 0,0050 M. Calcular si se formará precipitado de Sulfato de Bario o no. Kps BaSO4 = 1.08 x 10-10.
La reacción del equilibrio de solubilidad para el Sulfato de Bario es:
BaSO4 ↔ Ba++ + SO4=
Sabemos que el Kps está dado por:
Kps = [Ba++] x [SO4=]
El Cloruro de Bario y el Sulfato de Sodio en solución acuosa aportan los siguientes iones:
BaCl2 → Ba++ + 2 Cl –
Na2SO4 → 2 Na+ + SO4=
Observamos que los iones Ba++ y SO4= justamente son los que se unirán para formar el supuesto precipitado de Sulfato de Bario. Sin embargo deberán alcanzar cierta concentración molar para que esto suceda, de lo contrario no se formará el precipitado.
Calcularemos las concentraciones de estos 2 iones una vez que se mezclen ambas soluciones.
Al mezclar ambas soluciones el volumen final será de 40 mililitros. Entonces debemos calcular las nuevas concentraciones de los iones Ba++ y SO4=.
Lo haremos con la fórmula M1 x V1 = M2 x V2
Para el Ba++: La molaridad de este ion será la misma que la de su sal ya que vemos que en la reacción 1 mol genera un ión de Ba++.
M1 = 0,0050 M, V1 = 10 ml y V2 = 40 ml.
M2 = M1 x V1 / V2
M2 = 0,0050M x 10 ml / 40 ml = 0,00125 M
Para el ion SO4=: La molaridad inicial de este ión será la misma que la de su sal ya que 1 mol de su sal genera 1 mol de este ión.
M1 = 0,0100M, V1 = 30 ml y V2 = 40 ml
M2 = M1 x V1 / V2
M2 = 0,0100M x 30 ml / 40 ml
M2 = 0,0075M
Ahora calcularemos el producto de solubilidad (Qps) en un punto como este, es decir, que no esta en el equilibrio (Kps).
Qps = [Ba++] x [SO4=]
Qps = 0,00125M x 0,0075M
Qps = 9,37 x 10 -6
Vemos que este producto es mucho mayor que el Kps (1,08 x 10-10). Por lo tanto, si aparecerá precipitado.
No hay comentarios:
Publicar un comentario