Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno. Los hidrocarburos son los compuestos básicos que estudia la química orgánica. Las cadenas de átomos de carbono pueden ser lineales o ramificadas, y abiertas o cerradas. Los que tienen en su molécula otros elementos químicos (heteroátomos) se llaman hidrocarburos sustituidos.
La mayoría de los hidrocarburos que se encuentran en nuestro planeta ocurren naturalmente en el petróleo crudo, donde la materia orgánicadescompuesta proporcionó una abundancia de carbono e hidrógeno, los que pudieron catenarse para formar cadenas aparentemente ilimitadas. Los hidrocarburos pueden encontrarse también en algunos planetas sin necesidad de que haya habido vida para generar petróleo, como en Júpiter, Saturno, Titán y Neptuno, compuestos parcialmente por hidrocarburos como el metano o el etano.
Clasificación[editar]
Los hidrocarburos se pueden clasificar en dos tipos: alifáticos y aromáticos. Los alifáticos, a su vez se pueden clasificar en alcanos, alquenos y alquinos según los tipos de enlace que unen entre sí los átomos de carbono. Las fórmulas generales de los alcanos, alquenos y alquinos son CnH2n+2, CnH2n y CnH2n-2, respectivamente.
Hidrocarburos saturados o alcanos: Son compuestos formados por carbono e hidrógeno, presentan enlaces sencillos (SP3). Presenta una fórmula general (CnH2n+2), donde n es el número de carbonos del compuesto y el sufijo o y su terminación es ano.
CH4→ Metano
C2H6→Etano
C3H8→Propano
C4H10→Butano
C5H12→Pentano
C6H14→ Hexano
C7H16→Heptano
C8H18→Octano
C9H20→Nonano
C10H22→Decano.
De acuerdo al tipo de estructuras que pueden formar, los hidrocarburos se pueden clasificar en:
- Hidrocarburos acíclicos, los cuales presentan sus cadenas abiertas. A su vez se clasifican en:
- Hidrocarburos lineales a los que carecen de cadenas laterales
- Hidrocarburos ramificados, los cuales presentan cadenas laterales.
- Hidrocarburos cíclicos o cicloalcanos, que se definen como hidrocarburos de cadena cerrada. Estos a su vez se clasifican como:
- Monocíclicos, que tienen una sola operación de ciclización.
- Policíclicos, que contienen varias operaciones de ciclización.
Los sistemas policíclicos se pueden clasificar por su complejidad en:
- Fusionados, cuando al menos dos ciclos comparten un enlace covalente.
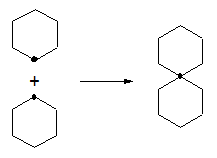
- Espiroalcanos, cuando al menos dos ciclos tienen un solo carbono en común.
- Puentes Estructuras de von Baeyer, cuando una cadena lateral de un ciclo se conecta en un carbono cualquiera. Si se conectara en el carbono de unión del ciclo con la cadena, se tendría un compuesto espiro. Si la conexión fuera sobre el carbono vecinal de unión del ciclo con la cadena, se tendría un compuesto fusionado. Una conexión en otro carbono distinto a los anteriores genera un puente.
- Agrupaciones, cuando dos ciclos independientes se conectan por medio de un enlace covalente.
- Ciclofanos, cuando a partir de un ciclo dos cadenas se conectan con otro ciclo.
Según los enlaces entre los átomos de carbono, los hidrocarburos se clasifican en:
- Hidrocarburos alifáticos, los cuales carecen de un anillo aromático, que a su vez se clasifican en:
- Hidrocarburos saturados, (alcanos o parafinas), en la que todos sus carbonos tienen cuatro enlaces simples (o más técnicamente, con hibridación sp3).
- Hidrocarburos no saturados o insaturados, que presentan al menos un enlace doble (alquenos u olefinas) o triple (alquino o acetilénico) en sus enlaces de carbono.
- Hidrocarburos aromáticos, los cuales presentan al menos una estructura que cumple la regla de Hückel(Estructura cíclica, que todos sus carbonos sean de hibridación sp2 y que el número de electrones en resonancia sea par no divisible entre 4).
Los hidrocarburos extraídos directamente de formaciones geológicas en estado líquido se conocen comúnmente con el nombre de petróleo, mientras que los que se encuentran en estado gaseoso se les conoce como gas natural.
La explotación comercial de los hidrocarburos constituye una actividad económica de primera importancia, pues forman parte de los principales combustibles fósiles (petróleo y gas natural), así como de todo tipo de plásticos, ceras y lubricantes.
Según los grados API, se clasifican en:
Si es:
- > 40 - condensado
- 30-39,9 - liviano
- 22-29,9 - mediano
- 10-21,9 - pesado
- < 9,9 - extrapesado
Hidrocarburos sustituidos[editar]
Los hidrocarburos sustituidos son compuestos que tienen la misma estructura que un hidrocarburo, pero que contienen átomos de otros elementos distintos al hidrógeno y el carbono en lugar de una parte del hidrocarburo. La parte de la molécula que tiene un ordenamiento específico de átomos, que es el responsable del comportamiento químico de la molécula base, recibe el nombre de grupo funcional.
Por ejemplo:
Los compuestos halogenados tienen como grupo funcional los átomos de halógenos. Tienen una alta densidad. Se utilizan en refrigerantes, disolventes, pesticidas, repelentes de polillas, en algunos plásticos y en funciones biológicas: hormonas tiroideas. Por ejemplo: cloroformo, diclorometano, tiroxina, Freón, DDT, PCBs, PVC. La estructura de los compuestos halogenados es: R-X, en donde X es flúor (F), cloro (Cl), bromo (Br) y yodo (I), y R es un radical de hidrocarburo.
Véase también: Compuesto organohalogenado
Toxicología[editar]
Las intoxicaciones por hidrocarburos tienden a causar cuadros respiratorios relativamente severos. La gasolina, el queroseno y los aceites y/o barnices para el tratamiento de muebles, que contienen hidrocarburos, son los agentes más comúnmente implicados en las intoxicaciones. El tratamiento a menudo requiere intubación y ventilación mecánica. Inducir el vómito en estos sujetos está contraindicado porque puede causar más daño esofágico.
Microorganismos que degradan los hidrocarburos[editar]
Los microorganismos se consideran como seres capaces de adaptarse y adaptar su metabolismo en función de las condiciones ambientales en las que se desarrollen y los parámetros físico-químicos que presenten, lo que les permite también desarrollarse en lugares donde están presentes los hidrocarburos.
Existen alrededor de 160 géneros de microorganismos que degradan los hidrocarburos, entre los principales se encuentran:
- Acinetobacter
- Flavobacterium
- Corynebacterium
- Bacillus
- Achromobacter
- Rhodococcus
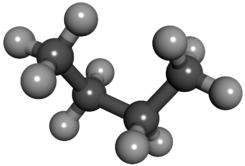
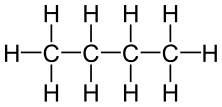
El butano, también llamado n-butano, es un hidrocarburosaturado, parafínico o alifático, inflamable, gaseoso que se licúa a presión atmosférica a -0,5 °C, formado por cuatro átomos de carbono y por diez de hidrógeno, cuya fórmula química es C4H10.4También puede denominarse con el mismo nombre a un isómero de este gas: el isobutano o metilpropano.
El butano comercial es un gas licuado, obtenido por destilación del petróleo, compuesto principalmente por butano normal (60%), propano (9%), isobutano (30%) y etano (1%).
Como es un gas incoloro e inodoro, en su elaboración se le añade un odorizante (generalmente un mercaptano) que le confiere olor desagradable. Esto permite que se detecte en caso de fugas, porque al ser muy volátil puede acumularse en un recinto y provocar una explosión.
Para extinguir un fuego originado por gas butano se emplean distintos métodos, como dióxido de carbono (CO2), polvo químico o niebla de agua.
| Butano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| butano | ||
| General | ||
| Fórmula semidesarrollada | CH3CH2CH2CH3 | |
| Fórmula estructural | ||
| Fórmula molecular | C4H10 | |
| Identificadores | ||
| Número CAS | 106-97-81 | |
| Número RTECS | EJ4200000 | |
| ChEBI | 37808 | |
| ChemSpider | 7555 | |
| PubChem | 7843 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 2,52 kg/m3; 0,00252 g/cm3 | |
| Masa molar | 58,08 g/mol | |
| Punto de fusión | 134,9 K (-138 °C) | |
| Punto de ebullición | 272,7 K (-0 °C) | |
| Temperatura crítica | 425 K (152 °C) | |
| Viscosidad | 0.0074 cP (20 ºC) | |
| Índice de refracción (nD) | 1.3326 (20 ºC) | |
| Propiedades químicas | ||
| Solubilidad en agua | 6,1 mg/100 mL H2O | |
| Termoquímica | ||
| ΔfH0gas | -124.9 kJ/mol | |
| S0líquido, 1 bar | 231.0 J·mol-1·K-1 | |
| Peligrosidad | ||
| SGA |  | |
| Punto de inflamabilidad | 213 K (-60 °C) | |
| NFPA 704 | 
4
1
0
| |
| Temperatura de autoignición | 638 K (365 °C) | |
| Frases R | R12 | |
| Frases S | S2, S9, S16 | |
| Límites de explosividad | 1.8%-8.4%2 | |
| Riesgos | ||
| Inhalación | Somnolencia. Pérdida del conocimiento. Sensación de Bienestar. Alucinaciones.3 | |
| Piel | En contacto con líquido: congelación. Agua y limón | |
| Ojos | En contacto con líquido: congelación y sobre evaporación | |
| Compuestos relacionados | ||
| Alcanos | Propano, Pentano, Metilpropano | |
| Otros | Clorobutano | |
Aplicaciones[editar]
La principal aplicación del gas butano (C4H10) es como combustible en hogares para la cocina y agua caliente, y en los encendedores de gas. No suele consumirse en grandes cantidades debido a sus limitaciones de transporte y almacenaje. Aunque también se emplea como combustible para encendedores de bolsillo.
En España[editar]
En España el gas butano se transporta en la típica bombona o garrafa de butano, que es un envase cilíndrico, que se dilata cuando la temperatura del butano aumenta en exceso, de paredes de acero, normalmente de color naranja (también llamado por ello "color butano"), y que contiene 12,5 kg de butano. También existen nuevas bombonas de butano más ligeras, fabricadas con acero inoxidable en lugar de hierro fundido.
Su regulación aparece en el Real Decreto 1085/1992 de 11 de septiembre por el que se aprueba el Reglamento de la actividad de distribución de Gases Licuados del Petróleo. En su artículo 22, determina las obligaciones de los titulares de los contratos de dicho suministro. Entre ellas, se encuentra la revisión de la instalación cada cinco años por una empresa instaladora legalmente habilitada para ello.5Similares medidas se han tomado en otros países.
Propiedades físico-químicas[editar]
Su fórmula estructural es:
- Color: incoloro.
- Olor: sustancia inodora cuando es pura, por lo que se le añade otra sustancia (normalmente el metil mercaptano) de olor característico con motivo de evitar accidentes.
- Densidad relativa de vapor (aire=1): 2.1
- Solubilidad en agua: 3.25 ml/100 ml a 20 °C
- Punto de ebullición: -1 °C
- Punto de fusión: -138 °C
- Masa molar: 58 g/mol
- Poder calorífico superior: 49 608 kJ/kg aprox.
- Entalpía de combustión: -2 880 kJ/mol.







No hay comentarios:
Publicar un comentario