ensayo de dilución se usa generalmente para designar un tipo especial de bioensayo en el que una o más preparaciones (por ejemplo, un medicamento) se administran a unidades experimentales a diferentes niveles de dosis que induce una respuesta biológica medible. Los niveles de dosis se preparan por dilución en un diluyente que es inerte con respecto a la respuesta. Las unidades experimentales pueden ser, por ejemplo, cultivos celulares, tejidos, órganos o animales vivos. La respuesta biológica puede ser cuantitativa (por ejemplo, positiva / negativa) o cuantitativa (por ejemplo, crecimiento). El objetivo es relacionar la respuesta con la dosis, generalmente mediante técnicas de interpolación , y en muchos casos expresar la potencia / actividad de la (s) preparación (es) de prueba en relación con un estándar de potencia / actividad conocida.
Los ensayos de dilución pueden ser directos o indirectos. En un ensayo de dilución directa, se mide la cantidad de dosis necesaria para producir una respuesta específica (fija), de modo que la dosis es una variable estocástica que define la distribución de tolerancia . A la inversa, en un ensayo de dilución indirecta, los niveles de dosis se administran a niveles de dosis fijos, de modo que la respuesta es una variable estocástica.
Los modelos estadísticos [ editar ]
Para una definición matemática de un ensayo de dilución un espacio de observación Se define y una función. para que las respuestas Se asignan al conjunto de números reales. Ahora se asume que una función Existe lo que relaciona la dosis. a la respuesta
en el cual es un término de error con expectativa 0. Se suele suponer que es continuo y monótono . En situaciones donde se incluye una preparación estándar, se supone además que la preparación de la prueba Se comporta como una dilución (o concentración) del estándar.
- , para todos
dónde es la potencia relativa de . Este es el supuesto fundamental de la similitud de las curvas de dosis-respuesta que es necesario para una definición significativa y no ambigua de la potencia relativa. En muchos casos es conveniente aplicar una transformación de potencia. con o una transformación logarítmica . Este último puede ser mostrado como un caso límite de Así que si se escribe para la transformación del registro la ecuación anterior se puede redefinir como
- , para todos .
Estimados de usualmente están restringidos a ser miembros de una familia paramétrica de funciones bien definidas , por ejemplo, la familia de funciones lineales caracterizadas por una intersección y una pendiente. Se pueden utilizar técnicas estadísticas, como la optimización por máxima probabilidad, para calcular estimaciones de los parámetros. De notable importancia a este respecto es la teoría de los modelos lineales generalizados con los que se puede modelar una amplia gama de ensayos de dilución. Estimaciones de puede describir satisfactoriamente en el rango de dosis probado, pero no necesariamente tienen que describirse más allá de ese rango. Sin embargo, esto no significa que las curvas diferentes puedan restringirse a un intervalo en el que sean similares.
En la práctica, en sí rara vez es de interés. Más de interés es una estimación deo una estimación de la dosis que induce una respuesta específica. Estas estimaciones implican tomar proporciones de estimaciones de parámetros estadísticamente dependientes. El teorema de Fieller se puede usar para calcular los intervalos de confianza de estas razones.
Algunos casos especiales merecen una mención especial debido a su uso generalizado: Si es lineal y Esto se conoce como un modelo de relación de pendiente . Si es lineal y Esto se conoce como un modelo de línea paralela . Otro modelo comúnmente aplicado es el modelo probit dondees la función de distribución normal acumulativa , y Sigue una distribución binomial .
Ejemplo: Ensayo microbiológico de antibióticos [ editar ]
Un estándar antibiótico (mostrado en rojo) y una preparación de prueba (mostrado en azul) se aplican en tres niveles de dosis a microorganismos sensibles en una capa de agar en placas de Petri . Cuanto más fuerte es la dosis, mayor es la zona de inhibición del crecimiento de los microorganismos. La respuesta biologica Es en este caso la zona de inhibición y el diámetro de esta zona. Puede ser utilizado como la respuesta medible. Las dosis se transforman a logaritmos y el método de mínimos cuadrados se utiliza para ajustar dos líneas paralelas a los datos. La distancia horizontal entre las dos líneas (mostradas en verde) sirve como una estimación de la potencia de la preparación de la prueba en relación con el estándar.
Software [ editar ]
Los principales paquetes de software estadístico no cubren los ensayos de dilución, aunque un estadístico no debería tener dificultades para escribir scripts o macros adecuados para ese fin. Existen varios paquetes de software de propósito especial para ensayos de dilución.
Los inhibidores de la dipeptidil peptidasa-4 ( inhibidores de la DPP-4) son inhibidores de la enzima que inhiben la enzima dipeptidil peptidasa-4 (DPP-4). Se utilizan en el tratamiento de la diabetes mellitus tipo 2 . La inhibición de la enzima DPP-4 prolonga y aumenta la actividad de las incretinas que juegan un papel importante en lasecreción de insulina y la regulación del control de la glucosa en la sangre . [1] La diabetes mellitus tipo 2 es una enfermedad metabólica crónica que resulta de la incapacidad de las células β en el páncreas para secretar cantidades suficientes de insulina para satisfacer las necesidades del cuerpo. Resistencia a la insulina y aumento.La producción de glucosa hepática también puede desempeñar un papel al aumentar la demanda de insulina del cuerpo. Los tratamientos actuales , aparte de la suplementación con insulina, a veces no son suficientes para lograr el control y pueden causar efectos secundarios no deseados , como el aumento de peso y la hipoglucemia . En los últimos años, se han desarrollado nuevos medicamentos basados en la investigación continua sobre el mecanismo de producción de insulina y la regulación del metabolismo del azúcar en el cuerpo. Se ha encontrado que la enzima DPP-4 juega un papel importante.
Historia [ editar ]
Desde su descubrimiento en 1967, la serina proteasa DPP-4 ha sido un tema popular de investigación. [2] Losinhibidores de la DPP-4 han sido buscados durante mucho tiempo como herramientas para dilucidar la importancia funcional de la enzima . Los primeros inhibidores se caracterizaron a fines de los años 80 y 90. Cada inhibidor fue importante para establecer una relación de actividad de estructura temprana (SAR) para una investigación posterior. Cabe señalar que los inhibidores se dividen en dos clases principales, los que interactúan covalentemente con DPP-4 y los que no lo hacen. [3] DPP-4 es una dipeptidasa que se une selectivamente a los sustratos que contienen prolinaen la posición P1, por lo tanto, muchos inhibidores de la DPP-4 tienen anillos heterocíclicos de 5 miembros que imitan a la prolina , por ejemplo , pirrolidina , cianopirrolidina, tiazolidina y cianotiazolidina. [4] [5] Estos compuestos comúnmente forman enlaces covalentes al residuo catalítico Ser630. [5]
En 1994, investigadores de Zeria Pharmaceuticals descubrieron cianopirrolidinas con un grupo de función nitriloque se suponía que formaba un imidato con la serina catalítica . Al mismo tiempo, se publicaron otros inhibidores de la DPP-4 sin un grupo nitrilo , pero contenían otros motivos que interactúan con la serina, por ejemplo , ácidos borónicos , fosfonatos o diacil hidroxilaminas . Estos compuestos no eran tan potentes debido a la similitud de DPP-4 y proliloligopeptidasa (PEP) y también sufrían de inestabilidad química . Ferring productos farmacéuticospresentaron una solicitud de patente sobre dos inhibidores de la cianopirrolidina DPP-4, que publicaron en 1995. Estos compuestos tenían una potencia excelente y una estabilidad química mejorada.
En 1995, Edwin B. Villhauer en Novartis comenzó a explorar glicinil-cianopirrolidinas N-sustituidas basándose en el hecho de que DPP-4 identifica N-metilglicina como un aminoácido N-terminal . Este grupo de nuevas cianopirrolidinas se convirtió en un campo de investigación extremadamente popular en los años siguientes. Se han representado algunos ensayos con inhibidores duales de la DPP-4 y la vasopeptidasa, ya que se cree que la inhibición de la vasopeptidasa aumenta el efecto antidiabético de la inhibición de la DPP-4 al estimular lasecreción de insulina . El motivo que inhibe la vasopeptidasa está conectado al inhibidor de la DPP-4 en el N-sustituyente. [3] [6]
Mecanismo DPP-4 [ editar ]
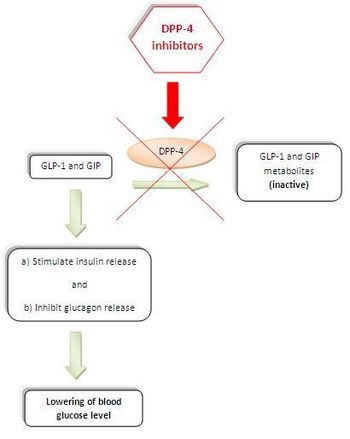
Fig.1: Durante una comida , las incretinas péptido similar al glucagón 1 (GLP-1) y dependiente de la glucosa polipéptido inhibidor gástrico (GIP) son liberados por el intestino delgado en el torrente sanguíneo. Estas hormonas regulan la secreción de insulina de una manera dependiente de la glucosa. (El GLP-1 tiene muchas funciones en el cuerpo humano . Estimula la biosíntesis de la insulina, inhibe la secreción de glucagón, frena el vaciamiento gástrico, reduce el apetito y estimula la regeneración de las células β de los islotes ).
GLP-1 y GIP tienen vidas medias en plasma extremadamente cortas debido a una inactivación muy rápida, catalizada por la enzima DPP-4. La inhibición de la DPP-4 ralentiza su inactivación, lo que potencia su acción, lo que lleva a niveles más bajos de glucosa en plasma, por lo tanto, su utilidad en el tratamiento de la diabetes tipo 2. ( Figura 1 ). [2] [7]
Distribución y función de DPP-4 [ editar ]
La DPP-4 está unida a la membrana plasmática del endotelio de casi todos los órganos del cuerpo . Los tejidos que expresan fuertemente DPP-4 incluyen el páncreas exocrino , glándulas sudoríparas , salivales y glándulas mamarias , timo , ganglios linfáticos , tracto biliar , riñón , hígado , placenta , útero , próstata , piel , y el lecho capilar del intestino mucosa(donde la mayoría de GLP-1 se desactiva localmente). También está presente, en forma soluble, en fluidos corporales , como el plasma sanguíneo y el líquido cefalorraquídeo . (También sucede que DPP-4 es el antígeno activador de células T CD26 ).
DPP-4 escinde selectivamente dos aminoácidos de los péptidos , como GLP-1 y GIP, que tienen prolina o alanina en la segunda posición ( Figura 2 ). En el sitio activo donde DPP-4 tiene su efecto, hay una disposición característica de tres aminoácidos , Asp-His-Ser. Dado que la alanina y la prolina son cruciales para la actividad biológica de la GPL-1 y la GIP, se inactivan al separar estos aminoácidos . Por lo tanto, prevenir la degradación de las hormonas incretinas GLP-1 y GIP por inhibición de DPP-4 tiene potencial comoEstrategia terapéutica en el tratamiento de la diabetes tipo 2. [1] [8]
Características de la DPP-4 [ editar ]
Dado que la DPP-4 es una proteasa , no es inesperado que los inhibidores tengan una naturaleza peptídica y este tema se haya mantenido en la investigación contemporánea. [3]
Estructura [ editar ]
Las estructuras de rayos X de DPP-4 que se han publicado desde 2003 brindan información bastante detallada sobre las características estructurales del sitio de unión . Se han descubierto muchos inhibidores de la DPP-4estructuralmente diversos y no es tan sorprendente teniendo en cuenta las propiedades del sitio de unión: [9]
1. Un bolsillo lipofílico profundo combinado con varias cadenas laterales aromáticas expuestas para lograr la unión de moléculas pequeñas de alta afinidad.
2. Un acceso significativo a los disolventes que permite ajustar las propiedades físico-químicas de los inhibidores que conducen a un mejor comportamiento farmacocinético .
DPP-4 es una glicoproteína transmembrana de 766 aminoácidos que pertenece a la familia de las proliloligopeptidasas . Se compone de tres partes; Una cola citoplasmática , una región transmembrana y una parte extracelular . La parte extracelular se divide en un dominio catalítico y un dominio de hélice β de ocho palas. Este último contribuye al sitio de unión del inhibidor. El dominio catalítico muestra un pliegue de α / β-hidrolasa y contiene la tríada catalítica Ser630 - Asp708 - His740. El bolsillo S1 es muy hidrófobo y está compuesto por las cadenas laterales: Tyr631, Val656, Trp662, Tyr666 y Val711. Rayos X existenteslas estructuras muestran que no hay mucha diferencia en el tamaño y la forma del bolsillo que indica que el bolsillo S1 tiene una alta especificidad por los residuos de prolina [9] [8]
Sitio de encuadernación [ editar ]
Los inhibidores de la DPP-4usualmente tienen un grupo electrofílico que puede interactuar con el hidroxilo de la serina catalítica en el sitio de unión activa ( Figura 3 ). Frecuentes que grupo es un nitrilo grupo pero también puede ser ácido borónico o difenil fosfonato . Este grupo electrofílico puede unirse al complejo de imidato con enlaces covalentes y una cinética lenta de unión estrecha, pero este grupo también es responsable de los problemas de estabilidad debidos a las reacciones con el grupo amino libre del aminoácido P2. Por lo tanto, también se han desarrollado inhibidores sin el grupo electrofílico, pero estas moléculashan demostrado toxicidad debido a la afinidad con otras dipeptidil peptidasas, por ejemplo, DPP-2, DPP-8 y DPP-9 . [10]
Los inhibidores de la DPP-4 abarcan diversos tipos estructurales. En 2007, algunos de los compuestos más potentes contienen un grupo de cianopirrolidina P1 mimético de prolina . Este grupo aumenta la potencia, probablemente debido a una captura covalente transitoria del grupo nitrilo por el hidroxilo del sitio activo Ser630, lo que lleva a una disociación retardada y una unión lenta y estricta de ciertos inhibidores. Cuando se lograron estas mejoras de potencia, se notaron algunos problemas de estabilidad química y se tuvieron que crear moléculas más avanzadas. Para evitar estos problemas de estabilidad, se investigó la posibilidad de excluir al grupo de nitrilo . Aminoácidos con arilo o cadenas laterales polares. no mostró una inhibición apreciable de la DPP-4 y, de hecho, todos los compuestos sin el grupo de nitrilo en esta investigación sufrieron una pérdida de potencia de 20 a 50 veces correspondiente a los compuestos que contienen el grupo de nitrilo . [11]
Descubrimiento y desarrollo [ editar ]
Es importante encontrar un sistema rápido y preciso para descubrir nuevos inhibidores de la DPP-4 con perfiles terapéuticos ideales . El cribado de alto rendimiento (HTS, por sus siglas en inglés) por lo general brinda tasas de aciertos bajas en la identificación de los inhibidores, pero el cribado virtual (VS) puede dar tasas más altas VS se ha utilizado, por ejemplo, para detectar pequeñas aminas alifáticas primarias para identificar fragmentos que podrían colocarse en los sitios S1 y S2 de DPP-4 . Por otro lado, estos fragmentos no eran muy potentes y, por lo tanto, se identificaron como un punto de partida para diseñar mejores. Los modelos tridimensionales pueden proporcionar una herramienta útil para diseñar novelas.Inhibidores de la DPP-4 . Se han fabricado modelos de farmacóforos basados en características químicas clave de compuestos con actividad inhibitoria de la DPP-4 . Estos modelos pueden proporcionar una imagen hipotética de la característica química primaria responsable de la actividad inhibitoria. [5] Los primeros inhibidores de la DPP-4 fueron inhibidores reversibles y tuvieron efectos secundarios negativos debido a la baja selectividad. Los investigadores sospecharon que se preferirían los inhibidores con vidas medias cortas para minimizar los posibles efectos secundarios . Sin embargo, desde ensayos clínicosMostró lo contrario, los últimos inhibidores de la DPP-4 tienen un efecto duradero. Uno de los primeros inhibidores de DPP-4 reportados fue P32 / 98 de Merck . Utilizó tiazolidida como sustituto de P1 y fue el primer inhibidor de la DPP-4 que mostró efectos tanto en animales como en humanos, pero no se desarrolló como un fármaco comercial debido a los efectos secundarios . Otro inhibidor antiguo es la DPP-728 de Novartis , donde se usa 2-cianopirrolidina como sustituto de P1. La adición del grupo ciano generalmente aumenta la potencia. Por lo tanto, la atención de los investigadores se dirigió a esos compuestos. Por lo general, los inhibidores de la DPP-4 son similares a un sustrato o no. [12]
Inhibidores de sustrato como [ editar ]
Los inhibidores de tipo sustrato ( Figura 4 ) son más comunes que los de tipo no sustrato. Se unen covalentemente o no covalentemente y tienen una estructura básica donde el sustituyente P1 ocupa el bolsillo S1 y el sustituyente P2 ocupa el bolsillo S2. Por lo general, contienen un mimético de prolina que ocupa el bolsillo S1. Los sustituyentes grandes en el anillo de 2-cianopirrolidina normalmente no se toleran ya que el bolsillo S1 es bastante pequeño. [12] Dado que DPP-4 es idéntico al marcador de activación de células T CD26 y se sabe que los inhibidores de la DPP-4 inhiben la proliferación de células T, estos compuestos se pensaron inicialmente como posibles inmunomoduladores . Cuando se descubrió la función contra la diabetes tipo 2 , las cianopirrolidinas se convirtieron en un material de investigación muy popular. Un poco más tarde se descubrieron vildagliptina y saxagliptina , que son los inhibidores de la cianopirrolidina DPP-4más desarrollados hasta la fecha. [6]
Cianopirrolidinas [ editar ]
Las cianopirrolidinas tienen dos interacciones clave con el complejo DPP-4: [6]
1. Nitrilo en la posición del enlace escindible del sustrato peptídico que es importante para una alta potencia. El grupo nitrilo forma enlaces covalentes reversibles con el serina hidroxilo catalíticamente activo (Ser630), es decir, las cianopirrolidinas son inhibidores competitivos con una cinética de disociación lenta.
2. Red de enlace de hidrógeno entre el grupo amino protonado y una región cargada negativamente de la superficie de la proteína , Glu205, Glu206 y Tyr662. Todas las cianopirrolidinas tienen aminas básicas, primarias o secundarias , lo que hace posible esta red, pero estos compuestos generalmente disminuyen su potencia si se cambian estas aminas. No obstante, dos solicitudes de patente revelan que el grupo amino puede cambiarse, es decir, reemplazarse por una hidracina , pero se afirma que estos compuestos no solo actúan a través de la inhibición de la DPP-4, sino que también evitan las complicaciones vasculares diabéticas actuando como un eliminador de radicales .
Relación estructura-actividad (SAR) [ editar ]
1. Existe una restricción estérica estricta alrededor del anillo de pirrolidina de los inhibidores basados en cianopirrolidina, y solo se permite la sustitución con hidrógeno , flúor , acetileno , nitrilo o metano.
2. La presencia de un resto nitrilo en el anillo de pirrolidina es fundamental para lograr una potente actividad
Además, la investigación sistemática del SAR ha demostrado que el tamaño del anillo y la estereoquímica para la posición P2 están bastante condicionados. Un anillo de 5 miembros y la configuración en L han mostrado mejores resultados que un anillo de 4 miembros o de 6 miembros con configuración en D. Solo se pueden tolerar cambios menores en el anillo de pirrolidina , ya que el buen ajuste del anillo con el bolsillo hidrófobo S1 es muy importante para una alta afinidad. Se han realizado algunos ensayos, por ejemplo, reemplazando la pirrolidinacon una tiazolina . Eso condujo a una potencia mejorada pero también a una pérdida de estabilidad química. Los esfuerzos para mejorar la estabilidad química a menudo llevaron a la pérdida de especificidad debido a las interacciones con DPP-8 y DPP-9. Estas interacciones se han relacionado con una mayor toxicidad y mortalidaden los animales. Hay limitaciones estrictas en la posición P1 y casi no se toleran cambios. Por otro lado, se pueden realizar una variedad de cambios en la posición P2. De hecho, la sustitución con cadenas laterales ramificadas bastante grandes, por ejemplo, terc- butilglicina, normalmente aumenta la actividad y la estabilidad química, lo que podría conducir a una inhibición más prolongada de la enzima DPP-4. También se ha observado que las cadenas laterales basadas en biarilo también pueden proporcionar inhibidores altamente activos. Originalmente se creía que sólo lipófilos.Se toleraría la sustitución. Ahora se afirma que también la sustitución de cadenas laterales polares cargadas negativamente, así como la sustitución hidrófila, puede conducir a una excelente actividad inhibidora. [6]
Estabilidad química [ editar ]
En general, los inhibidores de la DPP-4 no son compuestos muy estables. Por lo tanto, muchos investigadores se centran en mejorar la estabilidad de las cianopirrolidinas. La técnica más extendida para mejorar la estabilidad química es incorporar un volumen estérico . Las dos cianopirrolidinas que han sido más pronunciadas, vildagliptina y saxagliptina , se crearon de esta manera. K579 es un inhibidor de la DPP-4 descubierto por investigadores en Kyowa Hakko Kyogo. Había mejorado no solo la estabilidad química, sino también una acción más duradera. Esa acción de larga duración fue probablemente debido a la lenta disociación del complejo enzima-inhibidor y un metabolito de óxido activo.Que experimenta circulación enterohepática. El descubrimiento del óxido activo fue, de hecho, un gran avance, ya que condujo al desarrollo de vildagliptina y saxagliptina . Un problema importante en la estabilidad del inhibidor de la DPP-4 es la ciclación intramolecular . La condición previa para la ciclación intramolecular es la conversión del trans - rotámero , que es el rotámero de unión DPP-4 ( Figura 5). Por lo tanto, prevenir esta conversión aumentará la estabilidad. Esta prevención fue exitosa cuando se incorporó un grupo amida en un anillo, creando un compuesto que mantuvo la actividad inhibitoria de la DPP-4 que no sufrió la ciclación intramolecular y fue aún más selectivo entre las diferentes enzimas de la DPP. También se ha informado que una cianoazetidina en la posición P1 y un β-aminoácido en la posición P2 aumentan la estabilidad. [6]
Vildagliptina [ editar ]
La vildagliptina (Galvus) ( Figura 6 ) se sintetizó por primera vez en mayo de 1998 y recibió el nombre de Edwin B. Villhauer. Se descubrió cuando los investigadores de Novartis examinaron los derivados de adamantilo que habían demostrado ser muy potentes . El grupo adamantilo funcionó como una masa estérica y desaceleró la ciclación intramolecular mientras aumentaba la estabilidad química. Además, los metabolitos primarios eran altamente activos. Para evitar un centro quiral adicional, se llevó a cabo una hidroxilación en el anillo de adamantilo ( Figura 6 ). El producto,La vildagliptina fue incluso más estable, experimentó una ciclación intramolecular 30 veces más lenta y tuvo una alta actividad inhibitoria de la DPP-4 y un efecto farmacodinámico de mayor duración . [6]
Saxagliptina [ editar ]
Los investigadores de Bristol-Myers Squibb descubrieron que el aumento del volumen estérico de la cadena lateral del aminoácido N -terminal conducía a una mayor estabilidad. Para aumentar adicionalmente la estabilidad, el trans - rotámero se estabilizó con una sustitución cis -4,5-metano del anillo de pirrolidina , dando como resultado una interacción intramolecular de van-der-Waals , evitando así la ciclación intramolecular . Debido a esa mayor estabilidad, los investigadores continuaron su investigación sobre cis -4,5-metano cianopirrolidinas y se encontraron con un nuevo adamantilo.derivado , que mostró una extraordinaria inhibición ex vivo de DPP-4 en plasma de rata. También se señaló, una alta tasa de rotación microsomal que indicaba que el derivado se convertía rápidamente en un metabolito activo . Después de la hidroxilación en el grupo adamantilo , tuvieron un producto con mejor estabilidad microsomal y estabilidad química mejorada. Ese producto se llamó saxagliptina (Onglyza) ( Figura 6 ). [6] En junio de 2008, AstraZeneca y Bristol-Myers Squibb presentaron una nueva solicitud de medicamento para Onglyza en los Estados Unidos.y una solicitud de autorización de comercialización en Europa . [13] La aprobación fue otorgada en los Estados Unidos por la FDA en julio de 2009 para Onglyza 5 mg y Onglyza 2.5 mg. Esto se combinó más tarde con metformina de liberación prolongada (tomada una vez al día) y aprobada por la FDA en enero de 2011 con el nombre comercial Kombiglyze XR.
Denagliptina [ editar ]
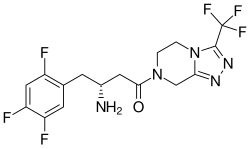
Denagliptin ( Figura 6 ) es un avanzado compuesto con una ramificado de cadena lateral en la posición P2, pero también tiene (4 S ) sustitución fluoro en el anillo cianopirrolidina. [6] Es un conocido inhibidor de la DPP-4desarrollado por GlaxoSmithKline (GSK). Las evaluaciones biológicas han demostrado que la configuración S de la porción de aminoácido es esencial para la actividad inhibidora, ya que la configuración R mostró una inhibición de mala gana. Estos hallazgos serán útiles en futuros diseños y síntesis de los inhibidores de la DPP-4 . [14]GSK suspendió los ensayos clínicos de fase III en octubre de 2008. [15]
Compuestos basados azetidina [ editar ]
Las informaciones para este grupo de inhibidores son bastante restringidas. Los inhibidores de la DPP-4 a base de azetidina se pueden agrupar en tres categorías principales: 2-cianoazetidinas, 3-fluoroazetidinas y 2-cetoazetidinas. Las cetoazetidinas y cianoazetidinas más potentes tienen grandes grupos de aminoácidos hidrófobos unidos al nitrógeno de la azetidina y son activos por debajo de 100 nM. [dieciséis]
Los inhibidores no-sustrato-como [ editar ]
Los inhibidores de tipo no sustrato no toman después de la naturaleza dipeptídica de los sustratos de DPP-4. Son inhibidores no covalentes y generalmente tienen un anillo aromático que ocupa el bolsillo S1, en lugar del mimético de prolina. [12]
En 1999, Merck comenzó un programa de desarrollo de medicamentos con inhibidores de la DPP-4. Cuando comenzaron el programa interno de cribado y química médica , dos inhibidores de la DPP-4 ya estaban en ensayos clínicos , isoleucil tiazolidida (P32 / 38) y NVP-DPP728 de Novartis . Merck con licencia L- treo- isoleucil tiazolidida y su estereoisómero alo . En estudios con animales, encontraron que ambos isómeros tenían una afinidad similar por la DPP-4, similar eficacia in vivo , farmacocinética y perfiles metabólicos similares . Sin embargo, elEl isómero alo era 10 veces más tóxico . Los investigadores descubrieron que esta diferencia en la toxicidad se debía a la mayor inhibición del alo isómero de DPP-8 y DPP-9, pero no debido a la inhibición selectiva de DPP-4. Más investigaciones también apoyaron que la inhibición de la DPP-4 no causaría una función inmune comprometida. Una vez que se descubrió este vínculo entre la afinidad por DPP-8 / DPP-9 y la toxicidad , Merck decidió identificar un inhibidor con más de mil veces la afinidad por DPP-4 sobre las otras dipeptidasas. Para ello, utilizaron bibliotecas de escaneo posicional.. Al escanear estas bibliotecas, los investigadores descubrieron que tanto la DPP-4 como la DPP-8 mostraron una fuerte preferencia por descomponer los péptidoscon una prolina en la posición P1, pero encontraron una gran diferencia en el sitio P2; es decir, encontraron que la funcionalidad ácida en la posición P2 podría proporcionar una mayor afinidad para DPP-4 sobre DPP-8 . Mercksiguió haciendo más investigación y detección. Dejaron de trabajar en los compuestos de la serie de α-aminoácidos relacionados con la isoleucil tiazolidida debido a la falta de selectividad, pero en su lugar descubrieron una serie muy selectiva de β- aminoácidos piperazina a través de SAREstudios sobre dos pistas de cribado. Al tratar de estabilizar el resto de piperazina , se hizo un grupo de derivados bicíclicos , lo que llevó a la identificación de una serie de triazolopiperazina potente y selectiva. La mayoría de estos análogos mostraron excelentes propiedades farmacocinéticas en especies preclínicas . La optimización de estos compuestos finalmente condujo al descubrimiento de la sitagliptina . [17]
Sitagliptina [ editar ]
La sitagliptina (Januvia) tiene una estructura novedosa con derivados de β-aminoamida ( Figura 7 ). Dado que la sitagliptina ha mostrado una excelente selectividad y eficacia in vivo , instó a los investigadores a inspeccionar la nueva estructura de los inhibidoresde la DPP-4 con un resto de β- aminoácido adjunto . Se están desarrollando estudios adicionales para optimizar estos compuestos para el tratamiento de la diabetes . [4] En octubre de 2006, la sitagliptina se convirtió en el primer inhibidor de la DPP-4 que obtuvo la aprobación de la FDA para el tratamiento de la diabetes tipo 2 . [18] Estructura cristalográfica de la sitagliptina.junto con el modelado molecular se ha utilizado para continuar la búsqueda de inhibidores estructuralmente diversos. Se descubrió un nuevo inhibidor de la DPP-4 potente , selectivo y biodisponible por vía oral al reemplazar la ciclohexilamina central en sitagliptina por 3-aminopiperidina. Una sustitución 2-piridilo fue el avance inicial del SAR, ya que ese grupo desempeña un papel importante en la potencia y la selectividad para DPP-4. [2]
Se ha demostrado con una cristalografía de rayos X cómo se une la sitagliptina al complejo DPP-4: [12]
1. El grupo trifluorofenilo ocupa el bolsillo S1.
2. El grupo trifluorometilo interactúa con las cadenas laterales de los residuos Arg358 y Ser209.
3. El grupo amino forma un puente salino con Tyr662 y los grupos carboxilados de los dos residuos de glutamato, Glu205 y Glu206.
Compuestos de feniletilamina restringidos [ editar ]
Los investigadores de Abbott Laboratories identificaron tres series nuevas de inhibidores de la DPP-4 que utilizan HTS. Después de más investigación y optimización, se descubrió ABT-341 ( Figura 8 ). Es un inhibidor potente y selectivo de la DPP-4 con una estructura 2D muy similar a la sitagliptina . Sin embargo, la estructura 3D es bastante diferente. ABT-341 también tiene un grupo trifluorofenilo que ocupa la bolsa S1 y el grupo amino libre , pero los dos grupos carbonilo están orientados a una distancia de 180 ° entre sí. También se cree que ABT-341 interactúa con el Tyr547, probablemente debido a un impedimento estérico entre el anillo de ciclohexenilo y la cadena lateral de tirosina . [12] Omarigliptines uno de tal compuesto que está en desarrollo Fase-III por Merck & Co .
Los compuestos de pirrolidina [ editar ]
El tipo de pirrolidina de los inhibidores de la DPP-4 se descubrió por primera vez después de HTS . [19] Lainvestigación mostró que los anillos de pirrolidina eran la parte de los compuestos que encajaban en el sitio de unión . El desarrollo adicional ha llevado a pirrolidinas sustituidas con flúor que muestran una actividad superior, así como a pirrolidinas con anillos de ciclopropilo fusionados que son altamente activos. [20]
Compuestos a base de xantina [ editar ]
Esta es una clase diferente de inhibidores que se identificó con HTS. [12] Los inhibidores de la DPP-4 basados en compuestos heterocíclicos aromáticos han ganado mayor atención recientemente. Las primeras patentes que describen las xantinas ( Figura 10 ) como inhibidores de la DPP-4 provienen de Boehringer-Ingelheim (BI) y Novo Nordisk . [21] Cuando los inhibidores de la DPP-4 basados en xantina se comparan con la sitagliptina y vildagliptina, se ha demostrado un perfil superior. Se cree que las xantinas tienen mayor potenciaInhibición más duradera y mejora más duradera de la tolerancia a la glucosa . [22]
Alogliptina [ editar ]
Alogliptin ( Figura 9 ) es un nuevo inhibidor de la DPP-4 desarrollado por la Takeda Pharmaceutical Company . [22] Los investigadores plantearon la hipótesis de que una estructura basada en quinazolinona ( Figura 9 ) tendría los grupos necesarios para interactuar con el sitio activo en el complejo DPP-4 . Los compuestos a base de quinazolinona interactuaron eficazmente con el complejo DPP-4, pero sufrieron una vida mediametabólica baja . Se encontró que al reemplazar la quinazolinona con una pirimidindiona, la estabilidad metabólica aumentaba y el resultado era un potente, inhibidor selectivo, biodisponible de la DPP-4 llamado alogliptina . Los compuestos basados en quinazolina mostraron una potente inhibición y una excelente selectividad sobre la proteasa relacionada , DPP-8 . Sin embargo, la corta vida media metabólica debida a la oxidación del grupo fenilo del anillo A fue problemática. Al principio, los investigadores trataron de hacer un derivado fluorado . El derivado mostró una mejor estabilidad metabólica y una excelente inhibición de la enzima DPP-4. Sin embargo, también se encontró que inhibe el CYP 450 3A4 y bloquea el canal hERG . La solución a este problema fue reemplazar elQuinazolinona con otros heterociclos , pero la quinazolinona podría reemplazarse sin ninguna pérdida de inhibición de la DPP-4. Se descubrió alogliptina cuando se reemplazó la quinazolinona con una pirimidindiona . La alogliptina ha demostrado una excelente inhibición de la DPP-4 y una selectividad extraordinaria, superior a 10.000 veces sobre las serina proteasas estrechamente relacionadas DPP-8 y DPP-9 . Además, no inhibe las enzimas CYP 450 ni bloquea el canal hERG en concentraciones de hasta 30 µM. Sobre la base de estos datos, se eligió alogliptina para la evaluación preclínica. [23]En enero de 2007, alogliptina se sometió al ensayo clínico de fase III y en octubre de 2008 fue revisada por la Administración de Drogas y Alimentos de los Estados Unidos . [24]
Linagliptina [ editar ]
Los investigadores de BI descubrieron que el uso de un grupo buty-2-nilo daba como resultado un candidato potente, llamado BI-1356 ( Figura 10 ). En 2008, BI-1356 se sometía a ensayos clínicos de fase III ; fue lanzado como linagliptina en mayo de 2011. La cristalografía de rayos X ha demostrado que ese tipo de xantina se une al complejo DPP-4 de una manera diferente a la de otros inhibidores : [12]
1. El grupo amino también interactúa con Glu205, Glu206 y Tyr662.
2. El grupo buty-2-nyl ocupa el bolsillo S1.
3. El grupo uracilo experimenta una interacción de apilamiento π con el residuo Tyr547
4. El grupo de quinazolina experimenta una interacción de apilamiento π con el residuo Trp629
Farmacología [ editar ]
| Fármaco | Absorción | Biodisponibilidad (%) | IC50(nM) | Volumen medio de distribución (L) | Enlace proteico (%) | Vida media (horas, dosis de 100 mg) | Metabolismo | Excreción |
|---|---|---|---|---|---|---|---|---|
| Sitagliptina | Absorbe rápidamente con la concentración máxima entre 1 y 4 horas. | 87 | 18 | 198 | 38 | 12.4 | Una pequeña fracción sufre metabolismo hepático a través deCYP 450 3A4 y 2C8. | Se excreta de forma inalterada en la orina (79%). |
| Vildagliptina | Absorbe rápidamente con la concentración máxima en 1–2 horas | 85 | 3 | 70.5 | 9.3 | 1.68 (una vez al día) y 2.54 (dos veces al día) | Hidrólisis que resulta en un metabolito farmacológicamente inactivo. Una fracción (22%) también se excreta sin cambios por los riñones | La excreción del metabolito se realiza a través de la orina (85%) y heces (15%). |
Las propiedades farmacocinéticas de sitagliptina y vildagliptina no se ven afectadas por la edad, el sexo o el IMC. [18] Las investigaciones clínicas han demostrado que la sitagliptina y la vildagliptina no tienen los efectos secundarios que tienden a seguir al tratamiento de la diabetes tipo 2 , por ejemplo, el aumento de peso y la hiperglucemia , pero sin embargo, se han observado otros efectos secundarios, como infecciones del tracto respiratorio superior y dolor de garganta. y diarrea .

































No hay comentarios:
Publicar un comentario