Las ciclooxigenasas son enzimas que participan en una compleja cascada biosintética que resulta en la conversión de ácidos grasos poliinsaturados en prostaglandinas y tromboxanos . [1] Su función principal es catalizar la transformación del ácido araquidónico en la prostaglandina H2 intermedia , que es el procursor de una variedad de prostanoides con acciones biológicas diversas y potentes. [2] Las ciclooxigenasas tienen dos isoformas principales que se llaman COX-1 y COX-2 (así como una COX-3). La COX-1 es responsable de la síntesis de prostaglandina y tromboxano en muchos tipos de células, incluido el tracto gastrointestinal y las plaquetas sanguíneas. La COX-2 desempeña un papel importante en la biosíntesis de prostaglandinas en células inflamatorias y en el sistema nervioso central. La síntesis de prostaglandinas en estos sitios es un factor clave en el desarrollo de la inflamación y la hiperalgesia . [3] Los inhibidores de la COX-2 tienen actividad analgésica y antiinflamatoria al bloquear selectivamente la transformación del ácido araquidónico en prostaglandina H2.
El aumento para el desarrollo de inhibidores selectivos de la COX-2 [ editar ]
 |
| DuP-697 |
El ímpetu para el desarrollo de inhibidores selectivos de la COX-2 fueron los efectos secundarios gastrointestinales adversos de los AINE . Poco después del descubrimiento del mecanismo de acción de los AINE, surgieron fuertes indicaciones para formas alternativas de COX, pero se encontraron pocas pruebas de apoyo. La enzima COX demostró ser difícil de purificar y no se secuenció hasta 1988. [5] En 1991, se confirmó la existencia de la enzima COX-2 al ser clonada por el Dr. Dan Simmons en la Universidad Brigham Young . Antes de la confirmación de la existencia de COX-2, la compañía Dupont había desarrollado un compuesto, DuP-697, eso fue potente en muchos ensayos antiinflamatorios pero no tuvo los efectos ulcerogénicos de los AINE. Una vez que se identificó la enzima COX-2, Dup-697 se convirtió en el bloque de construcción para la síntesis de los inhibidores de COX-2. Celecoxib y rofecoxib, los primeros inhibidores de la COX-2 que llegaron al mercado, se basaron en DuP-697. [5] [6] Llevó menos de ocho años desarrollar y comercializar el primer inhibidor de la COX-2, con Celebrex ( celecoxib ) lanzado en diciembre de 1998 y Vioxx ( rofecoxib ) lanzado en mayo de 1999. [7] [8] Celecoxib y un equipo de Searle descubrió otros inhibidores selectivos de la COX-2, valdecoxib , parecoxib y mavacoxib.División de Monsanto dirigida por John Talley . [9] [10]
Desarrollo de inhibidores de la COX-2 [ editar ]
Los primeros estudios mostraron que, cuando se induce la inflamación, el órgano afectado desarrolla inesperadamente una enorme capacidad para generar prostaglandinas. Se demostró que el aumento se debe a la síntesis de novo de enzimas frescas. En 1991, durante la investigación de la expresión de genes de respuesta temprana en fibroblastos.transformado con el virus del sarcoma de Rous, se identificó una nueva transcripción del ARNm que fue similar, pero no idéntica, a la enzima COX seminal. Se sugirió que se había descubierto una isoenzima de COX. Otro grupo descubrió una nueva especie de cDNA que codifica una proteína con una estructura similar a la COX-1 mientras estudiaba los genes inducidos por el éster de forbol en células Swiss 3T3. El mismo laboratorio mostró que este gen expresaba verdaderamente una nueva enzima COX. Las dos enzimas fueron renombradas como COX-1, refiriéndose a la enzima original y COX-2. [5] Sobre la base de estos resultados, los científicos comenzó a concentrarse en selectivos de la COX-2 inhibidores. Se realizó un enorme esfuerzo en el desarrollo de AINE entre los años 1960 y 1980, por lo que hubo numerosos farmacóforos para probar cuando se descubrió la COX-2. Los primeros esfuerzos se centraron en la modificación de dos compuestos de plomo, DuP-697 y NS-398 . Estos compuestos difieren mucho de los AINE que son análogos del ácido arilalkónico. Alentados por los experimentos de " prueba de concepto " con inhibidores selectivos, y armados con varias pistas sólidas y una idea clara de la naturaleza del sitio de unión , el desarrollo de este campo fue rápido. [3] Los ensayos enzimáticos recombinantes in vitro proporcionaron medios poderosos para evaluar la selectividad y la potencia de la COXy condujo al descubrimiento y desarrollo clínico del primer inhibidor selectivo de COX-2 diseñado racionalmente, el celecoxib. Se han realizado esfuerzos para convertir los AINE en inhibidores selectivos de la COX-2 como la indometacina mediante el alargamiento de la cadena lateral del ácido alquilcarboxílico, pero ninguno se ha comercializado. [1]
Relación estructura de actividad (SAR) [ editar ]
DuP-697 fue un componente básico para la síntesis de los inhibidores de la COX-2 y sirvió como modelo químico básico para los coxibs que son los únicos inhibidores selectivos de la COX-2 en el mercado hoy en día. DuP-697 es un heterociclo de diarilo con un resto cisestilbeno . Los estudios de relación de actividad de estructura (SAR) para los compuestos diaril heterocíclicos han indicado que un resto cis-estilbeno y los cambios en la posición para de uno de los anillos arilo juegan un papel importante en la selectividad de la COX-2. [1] [11] Celecoxib y parecoxib tienen un sustituyente sulfonamida (SO 2 NH 2 ) en posición para en uno de los anillos arilo, mientras que etoricoxib y rofecoxib tienen una metilsulfona (SO 2 CH 3 ). [12]El estado de oxidación en el azufre es importante para la selectividad; Las sulfonas y las sulfonamidas son selectivas para la COX-2, pero los sulfóxidosy los sulfuros no lo son. El sistema de anillos que se fusiona en este sistema de estilbeno ha sido ampliamente manipulado para incluir todos los esqueletos heterocíclicos y carbocíclicos imaginables de diferentes tamaños de anillos. Se sabe que un resto SO 2 NHCOCH 3 como en parecoxib, que es un profármaco para valdecoxib, es 10 5 - 10 6 agente de acetilación más reactivo de la enzima serina grupos hidroxilo que las amidas simples. [11]Debido al hecho de que diversos mecanismos cinéticos afectan la potencia de la COX-1 frente a la COX-2, muchos grupos utilizan la potencia y la selectividad confiables en la sangre total humana y ha sido aceptada como una evaluación estándar de la potencia y la selectividad de la COX-2.
La relación entre el perfil de aminoácidos de la enzima COX-2 y el mecanismo de inhibición [ editar ]
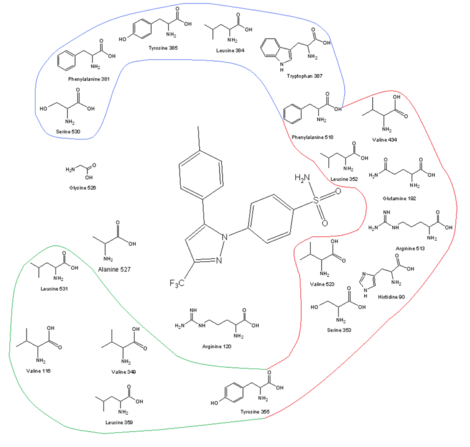 |
| Sitio receptor de COX-2 y su perfil de aminoácidos junto con celecoxib en el sitio de unión |
Una de las claves para desarrollar medicamentos selectivos para COX-2 es el sitio activomás grande de COX-2, que hace posible que las moléculas sean demasiado grandes para que quepan en el sitio activo de COX-1, pero que aún puedan ajustarse a la COX-2. El sitio activo más grande de COX-2 se debe en parte a un bolsillo lateral hidrófilo polar que se forma debido a la sustitución de Ile 523, His 513 e Ile434 en COX-1 por Val 523, Arg 513 y Val434 en COX-2. Val523 es menos voluminoso que Ile523, lo que aumenta el volumen del sitio activo. La sustitución de Ile434 por Val434 permite la cadena lateral de Phe518 para retroceder y hacer algo de espacio extra. Este bolsillo lateral permite interacciones con Arg513, que es un reemplazo para His513 de COX-1. Se cree que Arg513 es un residuo clave para los inhibidores de los heterociclos de diarilo, como los coxibs. La cadena lateral de Leu 384, en la parte superior del canal receptor, está orientada hacia el sitio activo de la COX-1, pero, en la COX-2, está orientada fuera del sitio activo y hace más espacio en el vértice de El sitio de unión. [13] [14] El grupo de sulfonamida voluminoso en los inhibidores de la COX-2, como celecoxib y rofecoxibevitar que la molécula entre en el canal COX-1. Para la actividad y selectividad óptimas de los coxibs, se requiere un 4-metilsulfonilfenilo unido a un anillo insaturado (generalmente) de cinco miembros con un grupo lipófilo vecino (rofecoxib). El SO 2 CH 3 puede reemplazarse por SO 2 NH 2 , en donde la bolsa lipofílica está ocupada por un anillo de fenilo opcionalmente sustituido o un sustituyente alcoxi voluminoso (celecoxib). Dentro de la bolsa lateral hidrófila de COX-2, el oxígeno del grupo sulfonamida (o sulfona ) interactúa con Hist90, Arg513 y Gln 192 y forma enlaces de hidrógeno . El grupo fenilo sustituido.en la parte superior del canal interactúa con las cadenas laterales de residuos de aminoácidos a través de interacciones hidrófobas y electrostáticas. Tyr 385 hace algunas restricciones estériles de este lado del sitio de unión, por lo que un pequeño sustituyente del grupo fenilo permite una mejor unión. Los grados de libertad también son importantes para la encuadernación. El anillo central de los coxibs decide la orientación de los anillos aromáticos y, por lo tanto, la unión a la enzima COX, aunque a menudo no tenga interacciones electrostáticas con ninguno de los residuos de aminoácidos. La alta lipofilicidad del sitio activo requiere una baja polaridad del andamio central de los coxibs. [14] [15]
Mecanismo de unión [ editar ]
Los estudios sobre el mecanismo de unión de los inhibidores selectivos de la COX-2 muestran que tienen dos pasos reversibles tanto con la COX-1 como con la COX-2, pero la selectividad para la COX-2 se debe a otro paso que es lento e irreversible y se ve solo en la inhibición de COX-2, no COX-1. El paso irreversible se ha atribuido a la presencia de la sulfonamida (o sulfona).) que cabe en el bolsillo lateral de COX-2. Esto se ha estudiado utilizando SC-58125 (un análogo de celecoxib) y COX-2 mutado, en donde el residuo de la valina 523 se reemplazó por isoleucina 523. La inhibición irreversible no ocurrió, pero se observó una inhibición reversible. Se ha creado un modelo para explicar este mecanismo de tres pasos detrás de los efectos inhibidores de los inhibidores selectivos de la COX-2. El primer paso explica el contacto del inhibidor con la puerta de la hidrófoba.canal (llamado la región de lobby). El segundo paso podría explicar el movimiento del inhibidor de la región del lobby al sitio activo de la enzima COX. El último paso probablemente representa el reposicionamiento del inhibidor en el sitio activo, lo que conduce a fuertes interacciones del grupo fenilsulfonamida o fenilsulfona del inhibidor y los aminoácidos de la bolsa lateral. [16] Es directamente inhibición al postaglanding.
Farmacocinética de coxibs [ editar ]
Los coxibs están ampliamente distribuidos por todo el cuerpo. Todos los coxibs alcanzan concentraciones cerebrales suficientes para tener un efecto analgésico central , y todos reducen la formación de prostaglandinas en las articulaciones inflamadas. Todos están bien absorbidos, pero la concentración máxima puede diferir entre los coxibs. Los coxibs están altamente unidos a proteínas, y la estimación publicada de las vidas medias es variable entre los coxibs. [17]
Celecoxib [ editar ]
Celecoxib fue el primer inhibidor específico de COX-2 aprobado para tratar pacientes con reumatismo y osteoartritis . Un estudio demostró que la tasa de absorción, cuando se administra por vía oral, es moderada y que la concentración plasmática máxima se produce después de aproximadamente 2 a 4 horas. Sin embargo, el grado de absorción no es bien conocido. Celecoxib tiene la afinidad de unirse extensivamente a las proteínas plasmáticas, especialmente a la albúmina plasmática . Tiene un volumen de distribución aparente ( VD ) de 455 +/- 166 L en humanos y el área bajo la curva de concentración plasmática-tiempo ( AUC ) aumenta proporcionalmente al aumento de las dosis orales, entre 100 y 800 mg. El celecoxib se metaboliza.principalmente por la isoenzima CYP2C9 al ácido carboxílico y también por glucuronidación no dependiente de CYP a los metabolitos de glucurónido . Los metabolitos se excretan en la orina y las heces, con una pequeña proporción de fármaco inalterado (2%) en la orina. Su vida media de eliminación es de aproximadamente 11 horas (6 a 12 horas) en individuos sanos, pero se han informado diferencias raciales en la disposición de los medicamentos y cambios farmacocinéticos en los ancianos. Los pacientes con insuficiencia renal crónica parecen tener una concentración plasmática 43% más baja en comparación con los individuos sanos, con un aumento del 47% en el aclaramiento aparente, y se puede esperar que los pacientes con insuficiencia hepática de leve a moderada tengan un AUC aumentado. [18]
| Celecoxib | ||
|---|---|---|
| Pico [droga] | 2–4 horas |  |
| Enlace proteico | 97% | |
| Metabolitos | Conjugados de ácido carboxílico y glucurónido | |
| Vida media [t 1/2 ] | 6–12 horas | |
Parecoxib y valdecoxib [ editar ]
Parecoxib sódico es un profármaco de amida de éster inactivo soluble en agua de valdecoxib , un nuevo inhibidor específico de COX-2 de segunda generación y el primer agente de este tipo que se desarrolla para uso inyectable. Se convierte rápidamente por hidrólisis enzimática hepática a la forma activa valdecoxib. El compuesto luego experimenta otra conversión, que involucra tanto la vía mediada por el citocromo P450 (CYP2C9, CYP3A4) como la vía no mediada por el citocromo P450, hacia el metabolito hidroxilado y el metabolito glucurónido. El metabolito hidroxilado, que también tiene propiedades inhibitorias específicas de la COX-2 débiles, luego se metaboliza aún más por la vía no citocromo P450 a un metabolito glucurónido. Estos metabolitos se excretan en la orina. [17] Después de la administración intramuscular de Parecoxib, la concentración plasmática máxima de sodio se alcanza en 15 minutos. La concentración plasmática disminuye rápidamente después de la administración debido a una vida media en suero bastante corta, que es de aproximadamente 15 a 52 minutos. Esto puede explicarse por la rápida formación de Valdecoxib. En contraste con el rápido aclaramiento de Parecoxib, la concentración plasmática de Valdecoxib disminuye lentamente debido a una vida media más larga. [19]Por otro lado, cuando se toma Valdecoxib por vía oral, se absorbe rápidamente (1-2 horas), pero la presencia de alimentos puede retrasar la concentración sérica máxima. Luego sufre el mismo metabolismo que se describe anteriormente. Está unida ampliamente a proteínas (98%) y la vida media plasmática es de aproximadamente 7 a 8 horas. Tenga en cuenta que la vida media se puede prolongar significativamente en los ancianos o en aquellos con insuficiencia hepática, y puede conducir a la acumulación de fármacos. [17] El metabolito hidroxilo alcanza su concentración plasmática media más alta dentro de las 3 a 4 horas posteriores a la administración, pero es considerablemente más bajo que el de valdecoxib o aproximadamente 1/10 de los niveles plasmáticos de valdecoxib. [19]
| Parecoxib | ||
|---|---|---|
| Pico [droga] | Dentro de 15 minutos |  |
| Enlace proteico | N / A | |
| Metabolitos | Valdecoxib, después de la hidrólisis enzimática hepática. | |
| Vida media [t 1/2 ] | 15–52 minutos | |
| Valdecoxib | ||
|---|---|---|
| Pico [droga] | 2–4 horas, retrasado por la comida |  |
| Enlace proteico | 98% | |
| Metabolitos | Derivados hidroxilo y metabolito glucuronido | |
| Vida media [t 1/2 ] | 7-8 horas | |
Etoricoxib [ editar ]
Etoricoxib , que se usa para pacientes con artropatías crónicas y dolor musculoesquelético y dental, se absorbe moderadamente cuando se administra por vía oral. Un estudio sobre su farmacocinética mostró que la concentración pico de etoricoxib en plasma se produce después de aproximadamente 1 hora. Se ha demostrado que está unida extensivamente a la albúmina plasmática (aproximadamente el 90%) y tiene un volumen de distribución aparente ( VD ) de 120 L en humanos. El área bajo la curva de concentración-tiempo (AUC) en plasma aumenta en proporción al aumento de la dosis (5–120 mg). La vida media de eliminación es de aproximadamente 20 horas en individuos sanos, y una vida media tan larga permite la elección de una dosis diaria. Etoricoxib, como los otros coxibs, se excreta en la orina y las heces y también se metaboliza de la misma manera. CYP3A4es principalmente responsable de la biotransformación de etoricoxib al metabolito del ácido carboxílico, pero también está disponible una vía de metabolismo no CYP450 al metabolito de glucurónido. Una porción muy pequeña de etoricoxib (<1 cambios="" elimina="" en="" font="" la="" nbsp="" orina.="" se="" sin="">Los pacientes con insuficiencia renal crónica no parecen tener una curva de concentración plasmática (AUC) diferente en comparación con los individuos sanos. Sin embargo, se ha informado que los pacientes con insuficiencia hepática moderada han aumentado la curva de concentración plasmática (AUC) en aproximadamente un 40%. Se ha dicho que es necesario realizar más estudios para describir con precisión la relevancia de las propiedades farmacocinéticas en términos de los beneficios clínicos y los riesgos de etoricoxib en comparación con otras opciones clínicas. [20] [21]
| Etoricoxib | ||
|---|---|---|
| Pico [droga] | 1 hora | 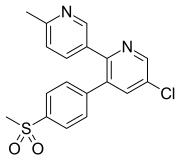 |
| Enlace proteico | 90% | |
| Metabolitos | Metabolito del ácido carboxílico y metabolito de glucurónido. | |
| Vida media [t 1/2] | 20 horas | |
Lumiracoxib [ editar ]
Lumiracoxib es único entre los coxibs por ser un ácido débil. Fue desarrollado para el tratamiento de la osteoartritis, la artritis reumatoide y el dolor agudo. La naturaleza ácida de lumiracoxib le permite penetrar bien en áreas de inflamación. Se ha demostrado que se absorbe bien y rápidamente, con una concentración plasmática máxima en aproximadamente 1 a 3 horas. [17] Un estudio mostró que cuando a un sujeto se le administró una dosis de 400 mg, la cantidad de fármaco sin cambios en el plasma 2,5 horas después de la dosis sugiere un efecto de primer paso modesto . La vida media terminal en plasma osciló entre 5,4 y 8,6 horas (media = 6,5 horas). La vida media en el líquido sinovial es considerablemente más larga que en el plasma, y la concentración en el líquido sinovialSe espera que 24 horas después de la administración produzca una inhibición sustancial de la COX-2. Este hecho puede explicar por qué algunos usuarios pueden ser suficientes con una dosis de una vez al día a pesar de una corta vida media en plasma. Los principales metabolitos del plasma son los derivados 5-carboxi, 4'-hidroxi y 4'-hidroxi-5-carboxi. El lumiracoxib se metaboliza ampliamente antes de ser excretado, y las vías de excreción se encuentran en la orina o en las heces. Las concentraciones plasmáticas máximas superan las necesarias para inhibir al máximo la COX-2, y eso es consistente con una vida media farmacodinámica más larga. El lumiracoxib in vitro ha demostrado una mayor selectividad de la COX-2 que cualquiera de los otros coxibs. [22]
| Lumiracoxib | ||
|---|---|---|
| Pico [droga] | 1–3 horas |  |
| Enlace proteico | 90% | |
| Metabolitos | Derivados de 5-carboxi, 4'-hidroxi y 4'-hidroxi-5-carboxi | |
| Vida media [t 1/2 ] | 6,5 horas | |
Rofecoxib [ editar ]
Rofecoxib fue el segundo inhibidor selectivo de la COX-2 que se comercializó, y el primero en ser retirado del mercado. [8]Cuando se estudió la farmacocinética en sujetos humanos sanos, la concentración máxima se alcanzó en 9 horas con una vida media efectiva de aproximadamente 17 horas. Se ha observado un pico secundario, que podría sugerir que la absorción de rofecoxib varía con la motilidad intestinal, lo que conduce a una alta variabilidad en el tiempo hasta que se alcanza la concentración máxima. El 71% y medio de la dosis se recuperó en la orina (menos del 1% sin metabolizar) y el 14,2% se recuperó en las heces (aproximadamente el 1,8% en la bilis). Entre los metabolitos se encuentran rofecoxib-3 ', 4'-dihidrodiol, 4'-hidroxirofecoxib-O-β-D-glucurónido, 5-hidroxirofecoxib-O-β-D-glucurónido, 5-hidroxirofecoxib, rofecoxib-eritro-3,4. -dihidrohidroxiácido, rofecoxib-treo-3,4-dihidrohidroxiácido, cis-3,4-dihidrorofecoxib y trans-3,4-dihidrorofecoxib. [23]
| Rofecoxib | ||
|---|---|---|
| Pico [droga] | 9 horas | 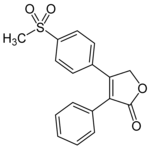 |
| Enlace proteico | N / A | |
| Metabolitos | Principales: ácido rofecoxib-treo-3,4-dihidrohidroxi y ácido rofecoxib-eritro-3,4-dihidrohidroxi | |
| Vida media [t 1/2 ] | 17 horas | |
Eventos cardiovasculares asociados con inhibidores selectivos de la COX-2 [ editar ]
Incluso antes de que se comercializara el primer inhibidor selectivo de la COX-2, los especialistas comenzaron a sospechar que podría haber un riesgo cardiovascular asociado con esta clase de medicamentos. En el estudio VIGOR (Vioxx Gastrointestinal Outcomes Research), se comparó rofecoxib ( Vioxx ) con naproxeno . Después de poco tiempo, se hizo evidente que había un riesgo cinco veces mayor de infarto de miocardio en el grupo de rofecoxib en comparación con el grupo que recibió naproxeno. Los autores sugirieron que la diferencia se debía a los efectos cardioprotectores del naproxeno. [24]El estudio APPROVe (Adenomatous Poly Prevention en Vioxx) fue un ensayo multicéntrico, aleatorizado, controlado con placebo, doble ciego, destinado a evaluar el efecto del tratamiento de tres años con rofecoxib en la recurrencia de pólipos neoplásicos en individuos con antecedentes de adenomas colorrectales. [25] [26] En 2000 y 2001, se reclutaron y siguieron 2587 pacientes con antecedentes de adenomas colorrectales. El ensayo se detuvo antes de tiempo (2 meses antes de la finalización prevista) en las recomendaciones de seguridad de los datos y la junta de monitoreo debido a las preocupaciones sobre la toxicidad cardiovascular. [25] Al observar los resultados del estudio, mostró un aumento estadísticamente significativo del riesgo cardiovascular al tomar rofecoxib en comparación con el placebo [25] [26]A partir de los 18 meses de tratamiento. [25] [26] [27] Luego, el 30 de septiembre, Merck emitió un comunicado de prensa anunciando su retiro voluntario a nivel mundial de Vioxx. [27] Algunos estudios de otros coxibs también han mostrado un aumento en el riesgo de eventos cardiovasculares, mientras que otros no lo han hecho. Por ejemplo, el estudio Adenoma Prevention with Celecoxib (APC) mostró un aumento relacionado con la dosis en el riesgo de muerte cardiovascular, infarto de miocardio, accidente cerebrovascular o insuficiencia cardíaca cuando se toma celecoxib en comparación con el placebo; y el estudio sucesivo de eficacia y seguridad de celecoxib I (SUCCESS-I) mostró un mayor riesgo de infarto de miocardio al tomar 100 mg dos veces al día de celecoxib en comparación con diclofenaco y naproxeno; pero tomar 200 mg dos veces al día tuvo una menor incidencia de infarto de miocardio en comparación con diclofenaco y naproxeno. Nussmeier et al. (2005) mostraron en un estudio un aumento en la incidencia de eventos cardiovasculares al tomar parecoxib y valdecoxib (en comparación con placebo) después de la cirugía de derivación coronaria. [26]
Posibles mecanismos [ editar ]
Se ha propuesto que la selectividad de la COX-2 podría causar un desequilibrio de las prostaglandinas en la vasculatura. Si esta fuera la explicación del aumento del riesgo cardiovascular, la aspirina en dosis bajas debería anular este efecto, [26] [28], lo cual no fue el caso en el ensayo APPROVe. [28] Además, los inhibidores no selectivos de la COX también han mostrado un aumento en los eventos cardiovasculares. [29] Otra posible explicación fue estudiada por Li H. et al. (2008). Mostraron que, en ratas espontáneamente hipertensas (SHR), los AINE no selectivos y los coxibes producen estrés oxidativo , indicado por un superóxido vascular mejorado (O 2- ) contenido y peróxido elevado en plasma, que está en sintonía con la expresión aumentada de la NADPH oxidasa, que se observó con el uso de diclofenaco y naproxeno y, en menor grado, de rofecoxib y celecoxib. El nitrito en plasma también disminuyó, lo que sugiere una síntesis disminuida de óxido nítrico vascular (NO). Esta disminución en la síntesis de NO no se debió a la disminución de la expresión de la óxido nítrico sintasa endotelial ( eNOS ) debido a que la expresión del ARNm de eNOS no se redujo, e incluso se reguló al alza para algunos productos. La disminución en la síntesis de NO podría, más bien, explicarse por la pérdida de la función de eNOS. [29]Para que la eNOS sea normalmente funcional, debe formar un dímero y tener su cofactor BH 4 , que es uno de los agentes reductores naturales más potentes. BH 4 es sensible a la oxidación por el peroxinitrito(ONOO - ), que se produce cuando NO reacciona con O 2 - , por lo que se ha planteado la hipótesis de que el agotamiento de BH 4 puede ocurrir con un estrés oxidativo excesivo (que puede ser causado por los AINE) y Por lo tanto, ser la causa de la disfunción de eNOS. Esta disfunción, que se conoce como desacoplamiento de la eNOS, provoca la producción de O 2 -por eNOS, lo que conduce a un mayor estrés oxidativo producido por eNOS. [30] En un estudio, tanto los inhibidores selectivos de la COX-2 como los AINE no selectivos produjeron estrés oxidativo, con mayores efectos observados con el uso de AINE no selectivos. Esto podría encajar con la hipótesis sobre el desequilibrio de prostaciclina / tromboxano. Es decir, aunque los AINE no selectivos producen más estrés oxidativo, previenen la agregación plaquetaria, mientras que los inhibidores de la COX-2 reducen la producción de prostaciclina y, por lo tanto, el riesgo cardiovascular para los AINE no selectivos no es mayor que para los coxibs. [29] Entre otras hipótesis están el aumento de la presión arterial, la disminución de la producción de epi-lipoxinas (que tienen efectos antiinflamatorios) y la inhibición de la remodelación vascular cuando se utilizan inhibidores selectivos de la COX-2.
No hay comentarios:
Publicar un comentario