El bromo o bromino (también llamado antaño fuego líquido) es un elemento químicode número atómico 35 situado en el grupo de los halógenos (grupo VII A) de la tabla periódica de los elementos. Su símbolo es Br.1 2
El bromo a temperatura ambiente es un líquido rojo, volátil y denso. Su reactividad es intermedia entre el cloro y el yodo. En estado líquido es peligroso para el tejido humano y sus vapores irritan los ojos y la garganta.
| Selenio ← Bromo → Kriptón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Gas o líquido: marrón rojizo Sólido: metálico lustroso | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo,número | Bromo, Br, 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Halógenos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período,bloque | 17, 4, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 79,904 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar]3d104s24p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones pornivel | 2, 8, 18, 7 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 115 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,96 (Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico(calc) | 94 pm (Radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 114 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 185 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | -1', +1, +3, +5, +7, | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Ácido fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª Energía de ionización | 1139,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª Energía de ionización | 2103 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª Energía de ionización | 3470 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª Energía de ionización | 4560 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª Energía de ionización | 5760 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª Energía de ionización | 8550 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª Energía de ionización | 9940 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª Energía de ionización | 18600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Líquido muy móvil y volátil | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (26,85 °C) 3119 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 265,8 K (-7 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 332 K (59 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 15,438 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 5,286 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 5800 Pa a 6,85 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Ortorrómbica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° CAS | 7726-95-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° EINECS | 231-778-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 480 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,122 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 206 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del bromo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Historia
El bromo (del griego bromos, que significa "hedor" o pestilencia) fue descubierto en 1826por Antoine-Jérôme Balard, pero no se produjo en cantidades importantes hasta 1860.
Abundancia y obtención
La mayor parte del bromo se encuentra en el mar en forma de bromuro, Br-. En el mar presenta una concentración de unos 65 µg/g.
El bromo molecular, Br2 se obtiene a partir de lassalmueras, mediante la oxidación del bromuro con cloro, una vez obtenido éste:
- 2Br - + Cl2 → Br2 + 2Cl-
Es necesario emplear un proceso de destilación para separarlo del Cl2.
Aproximadamente se producen en el mundo 500 millones de kilogramos de bromo por año (2001). Estados Unidos e Israel son los principales productores. Las aguas del mar Muerto y las minas de Stassfurt son ricas en bromuro de potasio.
Compuestos
Puede presentar distintos estados de oxidación. Los más comunes son -1 (lo más común), +1 (con cloro) +3 (con flúor) y +5 (con oxígeno).
- El estado de oxidación +1 es poco estable, pero muy oxidante desde el punto de vista cinético, en disolución acuosa y desproporciona a los estados de oxidación -1 y +5. Por ejemplo, el ion hipobromito, BrO- (sólo estable a bajas temperaturas 0 °C).
- El estado de oxidación +3 es poco estable en disolución acuosa y desproporciona a los estados de oxidación +1 y +5. Por ejemplo, el ion bromito, BrO2-, o el ácido bromoso, HBrO2 (muy inestable).
- El estado de oxidación +5 es termodinámicamente estable frente a la desproporción en disolución acuosa. Por ejemplo, el ion bromato, BrO3-. El bromato es un oxidante fuerte (como el permanganato) más oxidante que el clorato y cinéticamente más reactivo. Es además un carcinógeno (sospechas muy fuertes).
- El ion perbromato, BrO4-, con un estado de oxidación +7, se reduce con relativa facilidad y se prepara con dificultad: empleando flúor elemental o por métodos electrolíticos, es un oxidante muy fuerte 1,8 aunque algo lento desde el punto cinético.
El BrO3F (fluoruro de perbromilo) es un agente nuevo mucho más inestable que el análogo clorado y tan reactivo que destruye hasta el teflón. Es también un ácido de Lewis al contrario de su homólogo clorado fluoruro de perclorilo, formando un complejo BrO3F2(-1) análogo al XeO3F2. Cuando reacciona con ácidos de Lewis el bromo se reduce a +5 desprendiendo oxígeno, el análogo clorado no reaccciona con pentafluoruro de antimonio SbF5.
- El bromo también forma compuestos con otros halógenos (interhalógenos). Por ejemplo, BrF5, BrF3, IBr, etc.
El BrF5, es un líquido que reacciona explosivamente con casi todas las sustancias muy similar en reactividad al ClF3 capaz de hacer arder a las sustancias utilizadas como extintores, el agua, vidrio, óxidos, haluros y una amplia variedad de sustancias inorgánicas reaccionan, las sustancias orgánicas reaccionan explosivamente.
- Hay muchos compuestos en los que el bromo presenta estado de oxidación -1, llamándose a éstos bromuros.
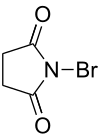
Se pueden obtener fácilmente compuestos orgánicos bromados, por ejemplo, mediante bromación radicalaria con bromo molecular y en presencia de luz o empleando N-bromosuccinimida, o bien por reacciones de adición o de sustitución. El compuesto orgánico bromuro de metilo, CH3Br, se emplea como plaguicida, pero afecta a la capa de ozono. Se ha determinado que los átomos de bromo son más eficaces que los de cloro en los mecanismos de destrucción de la capa de ozono, sin embargo los átomos de bromo están en menor cantidad.
El bromuro de hidrógeno, HBr, se obtiene por reacción directa de bromo con hidrógeno molecular o como subproducto de procesos de bromación de compuestos orgánicos.A 400º ataca al vidrio.Es muy ácido. A partir de éste, se pueden obtener distintos bromuros, por ejemplo:
- HBr + NaOH → NaBr + H2O
Es mucho más inestable que su análogo clorado y es reductor.
El ácido nítrico oxida a los bromuros en presencia de nitritos enérgicamente.
El bromo en disolución acuosa puede desproporcionar:
- Br2 + OH- → Br- + BrOH
Pero la reacción no transcurre en medio ácido.
También se puede obtener por oxidación el ion Br2+.
Papel biológico
El bromo se encuentra en niveles de trazas en humanos. Es considerado un elemento químico esencial, aunque no se conocen exactamente las funciones que realiza. Algunos de sus compuestos se han empleado en el tratamiento contra la epilepsia y como sedantes.
Isótopos
En la naturaleza se encuentran dos isótopos: 79Br y 81Br, los dos con una abundancia de cerca del 50%.
Aplicaciones
Las aplicaciones químicas e industriales del bromo son numerosas y variadas, destacando los compuestos organobromados, los cuales son preparados a partir de bromo diatómico o bien de bromuro de hidrógeno (ácido bromhídrico en disolución acuosa).
La prueba del bromo consiste en el uso de agua de bromo con el objetivo de detectar la presencia de compuestos orgánicos insaturados.
Los bromuros actúan médicamente como sedantes y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas.
Precauciones
En las sustancias hay una toxicidad intrínseca, debida a un átomo, iones o complejos particulares ejemplo el FCH2-COO- (ion fluoracetato) o el ion cianuro CN- y otra toxicidad debida a su reactividad. El flúor y todos sus compuestos son tóxicos, (el flúor por su reactividad y toxicidad) y el arsénico (por su toxicidad), en el caso del bromo (se parece más al cloro) su toxicidad, se debe a su reactividad (ésta menor que la del cloro), siendo sus iones negativos bromuro y cloruro poco tóxicos. El cloruro forma parte de la sal y de la sangre y es muy poco tóxico. El bromuro es más tóxico que el cloruro, pero no es particularmente tóxico.
Sin embargo, el bromo elemental es altamente tóxico y a partir pequeñas trazas (10 ppm), tanto por vía dérmica como inhalado, puede causar problemas inmediatos de salud o en dosis mayores la muerte. Es muy irritante tanto para los ojos como para la garganta; en contacto con la piel produce quemaduras dolorosas. Su manejo impropio supone un serio riesgo para la salud, requiriendo unas máximas precauciones de seguridad.
Bromo |  |
Número Atómico: 35
Masa Atómica: 79,904
Número de protones/electrones: 35
Número de neutrones (Isótopo 80-Br): 45
Estructura electrónica: [Ar] 3d10 4s2 4p5
Electrones en los niveles de energía: 2, 8, 18, 7
Números de oxidación: -1, +1, +3, +5
Masa Atómica: 79,904
Número de protones/electrones: 35
Número de neutrones (Isótopo 80-Br): 45
Estructura electrónica: [Ar] 3d10 4s2 4p5
Electrones en los niveles de energía: 2, 8, 18, 7
Números de oxidación: -1, +1, +3, +5
Electronegatividad: 2,96
Energía de ionización (kJ.mol-1): 1140
Afinidad electrónica (kJ.mol-1): 325
Radio atómico (pm): 114
Radio iónico (pm) (carga del ion): 196(-1)
Energía de ionización (kJ.mol-1): 1140
Afinidad electrónica (kJ.mol-1): 325
Radio atómico (pm): 114
Radio iónico (pm) (carga del ion): 196(-1)
Entalpía de fusión (kJ.mol-1):5,4
Entalpía de vaporización (kJ.mol-1): 15,0
Entalpía de vaporización (kJ.mol-1): 15,0
Punto de Fusión (ºC): -7,2
Punto de Ebullición (ºC): 58,8
Densidad (kg/m3): 3112,6; (20 ºC)
Volumen atómico (cm3/mol): 25,59
Estructura cristalina: Ortorrómbica
Color: Marrón-rojizo.
Punto de Ebullición (ºC): 58,8
Densidad (kg/m3): 3112,6; (20 ºC)
Volumen atómico (cm3/mol): 25,59
Estructura cristalina: Ortorrómbica
Color: Marrón-rojizo.
Isótopos: Dos isótopos naturales: 79-Br (50,69%) y 81-Br (49,31%). Veintinueve isótopos inestables cuyo período de semidesintegración oscila entre menos de 1,5 microsegundos (68-Br) y 57,036 horas (77-Br).
Descubierto en: 1826
Descubierto por: A. J. Balard.
Fuentes: Agua del mar y minerales: bromoargirita (AgBr), embolita (AgBrCl), iodembolita (AgBrI).
Usos: Aditivo antidetonación de la gasolina (su derivado 1,2-dibromoetano); combustibles; medicina; películas fotográficas; fumigantes; purificación de aguas; colorantes. Compuestos orgánicos.
Descubierto por: A. J. Balard.
Fuentes: Agua del mar y minerales: bromoargirita (AgBr), embolita (AgBrCl), iodembolita (AgBrI).
Usos: Aditivo antidetonación de la gasolina (su derivado 1,2-dibromoetano); combustibles; medicina; películas fotográficas; fumigantes; purificación de aguas; colorantes. Compuestos orgánicos.
Curiosidades sobre el elemento: Obtenido previamente por Liebig, fue reconocido como nuevo elemento por Balard en 1826. Se empezó a preparar en cantidad en 1860.
Se encuentra en la corteza en un 2,4x10-4% en peso. Los minerales de bromo son raros, encontrándose junto a la plata: bromoargirita, embolita, iodembolita. El agua de mar contiene unas 85 ppm, por lo que no es una buena fuente. Algunas salmueras (lagunas) naturales y las lejías con bromuros de la industria potásica son mejores fuentes.
El método de obtención actual consiste en la oxidación de bromuros con cloro. El bromo obtenido se condensa, destila y deseca. En el laboratorio se puede obtener por acción del ácido sulfúrico sobre bromuro potásico con dióxido de manganeso como catalizador.
Es el único no metal líquido y junto con el mercurio el único elemento líquido a temperatura ambiente. De color rojo oscuro, pesado (cinco veces más denso que el aire), fluido, que se volatiliza fácilmente a temperatura ambiente, produciendo un vapor rojo de olor muy desagradable, que asemeja al cloro.
Poco soluble en agua (0,035 l en 1 l de agua a temperatura ambiente, agua de bromo), soluble en disulfuro de carbono, formando un disoluciones rojas. El bromo y el cloro son miscibles en todas proporciones.
Es menos activo que el cloro, pero más que el iodo: es un oxidante medio. Se une a casi todos los elementos (excepto tántalo) aunque más lentamente y, sobre todo, en presencia de humedad. Reduce el amoniaco a nitrógeno. Tiene acción blanqueante, menos intensa. Se adiciona a los dobles enlaces de las moléculas orgánicas.
En estado sólido es rojo oscuro, y al disminuir la temperatura su color se va aclarando hasta anaranjado rojizo.
En estado gaseoso es color naranja a marrón oscuro, persistiendo las moléculas diatómicas hasta los 1500ºC.
Su principal uso es la obtención del 1,2-dibromoetano (80% del consumo de bromo), que se adiciona a la gasolina para evitar que los óxidos de plomo se depositen en los tubos de escape, pues reacciona con el plomo para formar PbBr2, volátil, que sale al aire y provoca graves problemas de salud. La reducción en el uso del plomotetraetilo (antidetonante) en las gasolinas ha afectado a la producción de bromo.
Se emplea en la obtención de fumigantes (bromuro de metilo), agentes antiinflamables (hexabromobenceno, hexabromociclododecano) de fibras artificiales, extintores, colorantes, desinsectación, desinfección de agua de piscinas, fotografía (bromuros inorgánicos), etc.,... Los bromuros orgánicos son también importantes intermedios.
Tiene efectos muy irritantes sobre ojos y garganta en concentraciones mínimas: disoluciones 1:1000 tienen efectos letales. Cuando cae en la piel produce quemaduras dolorosas. Es peligroso su uso y el de algunos de sus compuestos: éstos son más venenosos que los del cloro. El bromuro de metilo (CH3Br) ataca los nervios y es mortal en concentraciones del 0,035%.
Se encuentra en la corteza en un 2,4x10-4% en peso. Los minerales de bromo son raros, encontrándose junto a la plata: bromoargirita, embolita, iodembolita. El agua de mar contiene unas 85 ppm, por lo que no es una buena fuente. Algunas salmueras (lagunas) naturales y las lejías con bromuros de la industria potásica son mejores fuentes.
El método de obtención actual consiste en la oxidación de bromuros con cloro. El bromo obtenido se condensa, destila y deseca. En el laboratorio se puede obtener por acción del ácido sulfúrico sobre bromuro potásico con dióxido de manganeso como catalizador.
Es el único no metal líquido y junto con el mercurio el único elemento líquido a temperatura ambiente. De color rojo oscuro, pesado (cinco veces más denso que el aire), fluido, que se volatiliza fácilmente a temperatura ambiente, produciendo un vapor rojo de olor muy desagradable, que asemeja al cloro.
Poco soluble en agua (0,035 l en 1 l de agua a temperatura ambiente, agua de bromo), soluble en disulfuro de carbono, formando un disoluciones rojas. El bromo y el cloro son miscibles en todas proporciones.
Es menos activo que el cloro, pero más que el iodo: es un oxidante medio. Se une a casi todos los elementos (excepto tántalo) aunque más lentamente y, sobre todo, en presencia de humedad. Reduce el amoniaco a nitrógeno. Tiene acción blanqueante, menos intensa. Se adiciona a los dobles enlaces de las moléculas orgánicas.
En estado sólido es rojo oscuro, y al disminuir la temperatura su color se va aclarando hasta anaranjado rojizo.
En estado gaseoso es color naranja a marrón oscuro, persistiendo las moléculas diatómicas hasta los 1500ºC.
Su principal uso es la obtención del 1,2-dibromoetano (80% del consumo de bromo), que se adiciona a la gasolina para evitar que los óxidos de plomo se depositen en los tubos de escape, pues reacciona con el plomo para formar PbBr2, volátil, que sale al aire y provoca graves problemas de salud. La reducción en el uso del plomotetraetilo (antidetonante) en las gasolinas ha afectado a la producción de bromo.
Se emplea en la obtención de fumigantes (bromuro de metilo), agentes antiinflamables (hexabromobenceno, hexabromociclododecano) de fibras artificiales, extintores, colorantes, desinsectación, desinfección de agua de piscinas, fotografía (bromuros inorgánicos), etc.,... Los bromuros orgánicos son también importantes intermedios.
Tiene efectos muy irritantes sobre ojos y garganta en concentraciones mínimas: disoluciones 1:1000 tienen efectos letales. Cuando cae en la piel produce quemaduras dolorosas. Es peligroso su uso y el de algunos de sus compuestos: éstos son más venenosos que los del cloro. El bromuro de metilo (CH3Br) ataca los nervios y es mortal en concentraciones del 0,035%.

No hay comentarios:
Publicar un comentario