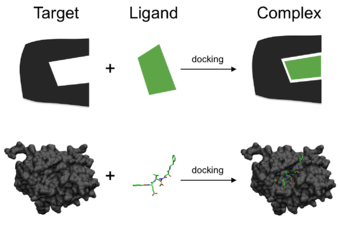
acoplamientoes un método que predice la orientación preferida de una molécula a una segunda cuando se unen entre sí para formar un complejo estable . [1] El conocimiento de la orientación preferida a su vez se puede usar para predecir la fuerza de asociación o afinidad de uniónentre dos moléculas usando, por ejemplo, funciones de puntuación .
Las asociaciones entre moléculas biológicamente relevantes tales como proteínas , péptidos , ácidos nucleicos , carbohidratos y lípidos desempeñan un papel central en la transducción de señales . Además, la orientación relativa de los dos socios que interactúan puede afectar el tipo de señal producida (p. Ej., Agonismo frente a antagonismo ). Por lo tanto, el acoplamiento es útil para predecir tanto la intensidad como el tipo de señal producida.
El acoplamiento molecular es uno de los métodos más utilizados en el diseño de fármacos basados en estructuras, debido a su capacidad para predecir la conformación de unión de ligandos de molécula pequeña al sitio de unión objetivo apropiado . La caracterización del comportamiento de unión juega un papel importante en el diseño racional de los fármacos , así como para dilucidar los procesos bioquímicos fundamentales.
Definición de problema [ editar ]
Uno puede pensar que el acoplamiento molecular es un problema de "cerradura y llave" , en el que se quiere encontrar la orientación relativa correcta de la "llave" que abrirá la "cerradura" (donde se encuentra en la superficie de la cerradura). el orificio de la llave, en qué dirección girar la llave después de insertarla, etc.). Aquí, la proteína se puede considerar como el "bloqueo" y el ligando se puede considerar como una "clave". El acoplamiento molecular se puede definir como un problema de optimización, que describiría la orientación de "mejor ajuste" de un ligando que se une a una proteína particular de interés. Sin embargo, dado que tanto el ligando como la proteína son flexibles, una analogía de "mano en guante" es más apropiada que "cerradura y llave" . [3] Durante el transcurso del proceso de acoplamiento, el ligando y la proteína ajustan su conformación para lograr un "ajuste óptimo" general y este tipo de ajuste conformacional que resulta en la unión general se conoce como "ajuste inducido" . [4]
La investigación de acoplamiento molecular se centra en la simulación computacional del proceso de reconocimiento molecular . Su objetivo es lograr una conformación optimizada tanto para la proteína como para el ligando y la orientación relativa entre la proteína y el ligando de manera que se minimice la energía libre del sistema en general.
Acoplamientos de acoplamiento [ editar ]
Dos enfoques son particularmente populares dentro de la comunidad de acoplamiento molecular. Un enfoque utiliza una técnica de comparación que describe la proteína y el ligando como superficies complementarias. [5] [6] [7] El segundo enfoque simula el proceso de acoplamiento real en el que se calculan las energías de interacción de ligando-proteína en pares. [8] Ambos enfoques tienen ventajas significativas, así como algunas limitaciones. Estos se describen a continuación.
Forma de complementariedad [ editar ]
Los métodos de correspondencia geométrica / complementariedad de formas describen la proteína y el ligando como un conjunto de características que los hacen acoplables. [9] Estas características pueden incluir descriptores de superficie molecular / superficie complementaria . En este caso, la superficie molecular del receptor se describe en términos de su área de superficie accesible al disolvente.y la superficie molecular del ligando se describe en términos de su descripción de superficie coincidente. La complementariedad entre las dos superficies equivale a la descripción de la coincidencia de formas que puede ayudar a encontrar la postura complementaria de anclar el objetivo y las moléculas del ligando. Otro enfoque es describir las características hidrófobas de la proteína usando giros en los átomos de la cadena principal. Otro enfoque más es utilizar una técnica de descriptor de forma de Fourier. [10] [11] [12]Mientras que los enfoques basados en la complementariedad de formas son generalmente rápidos y robustos, generalmente no pueden modelar los movimientos o cambios dinámicos en las conformaciones de ligando / proteína con precisión, aunque los desarrollos recientes permiten que estos métodos investiguen la flexibilidad del ligando. Los métodos de complementariedad de formas pueden escanear rápidamente varios miles de ligandos en cuestión de segundos y determinar si se pueden unir al sitio activo de la proteína y, por lo general, son escalables incluso para las interacciones proteína-proteína. También son mucho más susceptibles a los enfoques basados en farmacóforos, ya que utilizan descripciones geométricas de los ligandos para encontrar la unión óptima.
Simulación [ editar ]
Simular el proceso de acoplamiento es mucho más complicado. En este enfoque, la proteína y el ligando están separados por alguna distancia física, y el ligando encuentra su posición en el sitio activo de la proteína después de un cierto número de "movimientos" en su espacio conformacional. Los movimientos incorporan transformaciones rígidas del cuerpo, como traslaciones y rotaciones, así como cambios internos en la estructura del ligando, incluidas las rotaciones del ángulo de torsión. Cada uno de estos movimientos en el espacio de conformación del ligando induce un costo energético total del sistema. Por lo tanto, la energía total del sistema se calcula después de cada movimiento.
La ventaja obvia de la simulación de acoplamiento es que la flexibilidad del ligando se incorpora fácilmente, mientras que las técnicas de complementariedad de formas deben usar métodos ingeniosos para incorporar flexibilidad en los ligandos. Además, modela la realidad con mayor precisión, mientras que las técnicas complementarias de formas son más una abstracción.
Claramente, la simulación es computacionalmente costosa, teniendo que explorar un gran paisaje energético. Las técnicas basadas en cuadrícula, los métodos de optimización y la mayor velocidad de la computadora han hecho que la simulación de acoplamiento sea más realista.
Mecánica de acoplamiento [ editar ]
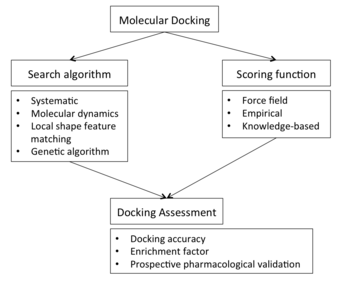
Para realizar una pantalla de acoplamiento, el primer requisito es una estructura de la proteína de interés. Por lo general, la estructura se ha determinado mediante una técnica biofísica como la cristalografía de rayos X o la espectroscopia de RMN , pero también puede derivarse de la construcción de modelos de homología . Esta estructura de proteína y una base de datos de ligandos potenciales sirven como entradas para un programa de acoplamiento. El éxito de un programa de acoplamiento depende de dos componentes: el algoritmo de búsqueda y la función de puntuación .
Algoritmo de búsqueda [ editar ]
El espacio de búsqueda en teoría consiste en todas las posibles orientaciones y conformaciones de la proteína emparejada con el ligando. Sin embargo, en la práctica con los recursos computacionales actuales, es imposible explorar exhaustivamente el espacio de búsqueda; esto implicaría enumerar todas las posibles distorsiones de cada molécula (las moléculas son dinámicas y existen en un conjunto de estados conformacionales) y todas las posibles orientaciones de rotación y traslación de El ligando en relación con la proteína en un nivel dado de granularidad . La mayoría de los programas de acoplamiento en uso representan todo el espacio conformacional del ligando (ligando flexible), y varios intentan modelar un receptor de proteína flexible. Cada "instantánea" de la pareja se conoce comoplantean .
Se ha aplicado una variedad de estrategias de búsqueda conformacional al ligando y al receptor. Éstos incluyen:
- Búsquedas torsionales sistemáticas o estocásticas sobre enlaces rotativos.
- simulaciones de dinámica molecular
- algoritmos genéticos para "evolucionar" nuevas conformaciones de baja energía y donde la puntuación de cada postura actúa como la función de aptitud utilizada para seleccionar individuos para la siguiente iteración.
Ligando flexibilidad [ editar ]
Se pueden generar conformaciones del ligando en ausencia del receptor y posteriormente acoplarse [13] o se pueden generar conformaciones sobre la marcha en presencia de la cavidad de unión del receptor, [14] o con flexibilidad rotacional completa de cada ángulo diédrico. utilizando acoplamiento basado en fragmentos. [15] Laevaluación de energía de campo de fuerza se usa con mayor frecuencia para seleccionar conformaciones energéticamente razonables, [16] pero también se han utilizado métodos basados en el conocimiento. [17]
Los péptidos son moléculas altamente flexibles y de tamaño relativamente grande, lo que hace que modelar su flexibilidad sea una tarea desafiante. Se desarrollaron varios métodos para permitir un modelado eficiente de la flexibilidad de los péptidos durante el acoplamiento proteína-péptido. [18]
Flexibilidad del receptor [ editar ]
La capacidad computacional se ha incrementado dramáticamente en la última década haciendo posible el uso de métodos más sofisticados y computacionalmente intensivos en el diseño de medicamentos asistidos por computadora. Sin embargo, lidiar con la flexibilidad de los receptores en las metodologías de acoplamiento sigue siendo un tema espinoso. [19] La principal razón detrás de esta dificultad es la gran cantidad de grados de libertad que deben considerarse en este tipo de cálculos. Sin embargo, descuidarlo, en algunos de los casos puede llevar a resultados de acoplamiento deficientes en términos de predicción de posturas vinculantes. [20]
Las estructuras estáticas múltiples determinadas experimentalmente para la misma proteína en diferentes conformaciones se utilizan a menudo para emular la flexibilidad del receptor. [21] Como alternativa, las bibliotecasde rotámeros de las cadenas laterales de aminoácidos que rodean la cavidad de unión se pueden buscar para generar conformaciones de proteínas alternativas pero energéticamente razonables. [22] [23]
Función de puntuación [ editar ]
Los programas de acoplamiento generan un gran número de posturas de ligandos potenciales, algunas de las cuales pueden rechazarse de inmediato debido a choques con la proteína. El resto se evalúa utilizando alguna función de puntuación, que toma una postura como entrada y devuelve un número que indica la probabilidad de que la postura represente una interacción de unión favorable y clasifique un ligando en relación con otro.
La mayoría de las funciones de puntuación son campos de fuerza de la mecánica molecular basados en la física que estiman la energía de la postura dentro del sitio de unión. Las diversas contribuciones a la unión pueden escribirse como una ecuación aditiva:
Los componentes consisten en efectos de solventes, cambios conformacionales en la proteína y el ligando, energía libre debido a interacciones proteína-ligando, rotaciones internas, energía de asociación del ligando y el receptor para formar un solo complejo y energía libre debido a cambios en los modos vibracionales. [24] Una energía baja (negativa) indica un sistema estable y, por lo tanto, una interacción de unión probable.
Un enfoque alternativo es derivar un potencial estadístico basado en el conocimiento para las interacciones de una gran base de datos de complejos proteína-ligando, como el Banco de Datos de Proteínas , y evaluar el ajuste de la postura de acuerdo con este potencial inferido.
Hay una gran cantidad de estructuras de cristalografía de rayos X para complejos entre proteínas y ligandos de alta afinidad, pero comparativamente menos para ligandos de baja afinidad ya que los complejos posteriores tienden a ser menos estables y, por lo tanto, más difíciles de cristalizar. Las funciones de puntuación entrenadas con estos datos pueden acoplar los ligandos de alta afinidad correctamente, pero también darán conformaciones acopladas plausibles para los ligandos que no se unen. Esto proporciona una gran cantidad de resultados positivos falsos , es decir, los ligandos predichos a unirse a la proteína que en realidad no lo hacen cuando se colocan juntos en un tubo de ensayo.
Una forma de reducir el número de falsos positivos es recalcular la energía de las posturas de puntaje superior utilizando técnicas (potencialmente) más precisas pero computacionalmente más intensivas, como los métodos Generalized Born o Poisson-Boltzmann . [8]
Evaluación de acoplamiento [ editar ]
La interdependencia entre el muestreo y la función de puntuación afecta la capacidad de acoplamiento para predecir posturas plausibles o afinidades de unión para nuevos compuestos. Por lo tanto, generalmente se requiere una evaluación de un protocolo de acoplamiento (cuando hay datos experimentales disponibles) para determinar su capacidad predictiva. La evaluación de acoplamiento se puede realizar utilizando diferentes estrategias, tales como:
- cálculo de la precisión de acoplamiento (DA);
- la correlación entre una puntuación de acoplamiento y la respuesta experimental o la determinación del factor de enriquecimiento (FE); [25]
- la distancia entre un resto de unión a iones y el ion en el sitio activo;
- La presencia de modelos de inducción.
Precisión de acoplamiento [ editar ]
La precisión de acoplamiento [26] [27] representa una medida para cuantificar la idoneidad de un programa de acoplamiento al racionalizar la capacidad de predecir la postura correcta de un ligando con respecto a lo observado experimentalmente. [28]
Factor de enriquecimiento [ editar ]
Las pantallas de acoplamiento también pueden evaluarse mediante el enriquecimiento de ligandos anotados de aglutinantes conocidos de entre una gran base de datos de presuntas moléculas " señuelo " no vinculantes . [25]De esta manera, el éxito de una pantalla de acoplamiento se evalúa por su capacidad para enriquecer el pequeño número de compuestos activos conocidos en los rangos superiores de una pantalla de entre un número mucho mayor de moléculas señuelo en la base de datos. El área bajo la curva de características operativas del receptor (ROC) se usa ampliamente para evaluar su desempeño.
Prospectiva [ editar ]
Los golpes resultantes de las pantallas de acoplamiento se someten a validación farmacológica (por ejemplo, IC 50 , mediciones de afinidad o potencia ). Solo los estudios prospectivos constituyen una prueba concluyente de la idoneidad de una técnica para un objetivo en particular. [29]
Benchmarking [ editar ]
El potencial de los programas de acoplamiento para reproducir los modos de enlace según lo determinado por la cristalografía de rayos X puede ser evaluado por un rango de conjuntos de referencia de acoplamiento.
Para moléculas pequeñas, existen varios conjuntos de datos de referencia para acoplamiento y detección virtual, por ejemplo, el Conjunto diverso Astex que consiste en estructuras cristalinas de rayos X de proteína-ligando de alta calidad [30] o el Directorio de señuelos útiles (DUD) para la evaluación del rendimiento de detección virtual. [25]
Una evaluación de los programas de acoplamiento por su potencial para reproducir los modos de unión a péptidos se puede evaluar en la sección Lecciones para la Evaluación de la Eficiencia de Acoplamiento y Clasificación (LEADS-PEP). [31]
Aplicaciones [ editar ]
Una interacción de unión entre un ligando de molécula pequeña y una proteína enzimática puede resultar en la activación o inhibición de la enzima. Si la proteína es un receptor, la unión del ligando puede resultar en agonismo o antagonismo . El acoplamiento se utiliza más comúnmente en el campo del diseño de medicamentos: la mayoría de los medicamentos son moléculas orgánicas pequeñas y el acoplamiento se puede aplicar a:
- Identificación de aciertos: el acoplamiento combinado con una función de puntuación se puede usar para detectar rápidamente grandes bases de datos de posibles fármacos en silico para identificar moléculas que probablemente se unan a la proteína objetivo de interés (consulte la selección virtual ).
- Optimización de la derivación: el acoplamiento se puede usar para predecir dónde y en qué orientación relativa se une un ligando a una proteína (también conocida como el modo de unión o postura). Esta información, a su vez, puede usarse para diseñar análogos más potentes y selectivos.
- Biorremediación : el acoplamiento de ligandos de proteínas también se puede usar para predecir los contaminantes que pueden degradarse por las enzimas.


No hay comentarios:
Publicar un comentario