Las bibliotecas químicas codificadas por ADN ( DEL ) son una tecnología para la síntesis y selección en una escala sin precedentes de colecciones de compuestos de moléculas pequeñas . El DEL se utiliza en química médica para salvar los campos de la química combinatoria y la biología molecular . El objetivo de la tecnología DEL es acelerar el proceso de descubrimiento de fármacos y, en particular, las actividades de descubrimiento de fases tempranas, como la validación de objetivos y la identificación de aciertos.
La tecnología DEL implica la conjugación de compuestos químicos o bloques de construcción con fragmentos cortos de ADN que sirven como códigos de barras de identificación y, en algunos casos, también dirigen y controlan la síntesis química. La técnica permite la creación masiva y la interrogación de bibliotecas a través de la selección de afinidad, típicamente en un objetivo de proteína inmovilizada. Recientemente se ha desarrollado un método homogéneo para seleccionar bibliotecas codificadas por ADN que utiliza tecnología de emulsión de agua en aceite para aislar, contar e identificar complejos individuales de ligando-objetivo en un enfoque de un solo tubo. En contraste con los procedimientos de selección convencionales, como la selección de alto rendimientoNo se requieren ensayos bioquímicos para la identificación del aglutinante, en principio, lo que permite el aislamiento de aglutinantes a una amplia gama de proteínas históricamente difíciles de abordar con tecnologías de cribado convencionales. Así que, además del descubrimiento general de compuestos moleculares específicos, la disponibilidad de aglutinantes para proteínas diana farmacológicamente importantes, pero hasta ahora "no controlables" abre nuevas posibilidades para desarrollar nuevos fármacos para enfermedades que no podrían tratarse hasta el momento. Al eliminar el requisito de evaluar inicialmente la actividad de los hits, se espera y se espera que muchos de los aglomerantes de alta afinidad identificados se muestren activos en el análisis independiente de hits seleccionados, por lo que ofrece un método eficiente para identificar hits de alta calidad y clientes potenciales farmacéuticos. .
Tecnologías de ADN codificado bibliotecas químicas y visualización [ editar ]
Hasta hace poco, la aplicación de la evolución molecular en el laboratorio se había limitado a tecnologías de visualización que involucraban moléculas biológicas, donde las moléculas pequeñas conducían al descubrimiento más allá de este enfoque biológico. El DEL ha abierto el campo de la tecnología de visualización para incluir compuestos no naturales como moléculas pequeñas, extendiendo la aplicación de la evolución molecular y la selección natural a la identificación de compuestos de moléculas pequeñas de actividad y función deseadas. Bibliotecas químicas codificadas de ADN tienen semejanza con las tecnologías de visualización biológicos tales como la tecnología de fagos de anticuerpos de presentación , presentación en levadura , pantalla mRNA y aptámero SELEX. En la presentación de fagos de anticuerpos, los anticuerpos están físicamente vinculados a partículas de fagos que llevan el gen que codifica el anticuerpo adjunto, que es equivalente a un enlace físico de un " fenotipo " (la proteína) y un " genotipo " (el gen que codifica la proteína ). [1] Los anticuerpos mostrados en fagos pueden aislarse de grandes bibliotecas de anticuerpos imitando la evolución molecular: a través de rondas de selección (en una diana de proteína inmovilizada), amplificación y traducción. [2] En DEL, el enlace de una molécula pequeña a un código de ADN identificador permite la fácil identificación de las moléculas de unión. Las bibliotecas DEL se someten a procedimientos de selección de afinidad en una proteína objetivo inmovilizada de elección, después de lo cual los no aglutinantes se eliminan mediante etapas de lavado, y los aglutinantes se pueden amplificar posteriormente mediante la reacción en cadena de la polimerasa (PCR) e identificarlos en virtud de su código de ADN (por ejemplo, Secuencia ADN). En las tecnologías DEL basadas en la evolución (ver más abajo), los éxitos pueden enriquecerse aún más mediante la realización de rondas de selección, amplificación por PCR y traducción en analogía con los sistemas de visualización biológica, como la visualización de fagos de anticuerpos. Esto hace posible trabajar con bibliotecas mucho más grandes.
Historia [ editar ]
El concepto de codificación de ADN se describió por primera vez en un artículo teórico de Brenner y Lerner en 1992 en el que se propuso vincular cada molécula de una entidad sintetizada químicamente a una secuencia de oligonucleótido particular construida en paralelo y usar esta etiqueta genética codificante para identificar y Enriquecer compuestos activos. [3] En 1993, la primera implementación práctica de este enfoque fue presentada por S. Brenner y K. Janda y, de manera similar, por el grupo de MA Gallop. [4] [5]Brenner y Janda sugirieron generar miembros de biblioteca codificados individuales mediante una síntesis combinatoriaparalela alternadel compuesto químico heteropolimérico y la secuencia de oligonucleótidos apropiada en la misma cuenta en una forma basada en "división y agrupación" (ver más abajo). [4]
Dado que el ADN no protegido se restringe a una ventana estrecha de condiciones de reacción convencionales, hasta finales de la década de 1990 se previeron varias estrategias de codificación alternativas (es decir , marcaje de compuestos basados en MS , codificación de péptidos , etiquetado haloaromático , codificación por aminassecundarias , dispositivos semiconductores ). ), principalmente para evitar la inconveniente de la síntesis de ADN en fase sólida y para crear bibliotecas combinatorias fácilmente seleccionables en modo de alto rendimiento. [6]Sin embargo, la amplificabilidad selectiva del ADN facilita enormemente la selección de bibliotecas y se vuelve indispensable para la codificación de bibliotecas de compuestos orgánicos de este tamaño sin precedentes. En consecuencia, a principios de la década de 2000, la química combinatoria del ADN experimentó un renacimiento.
El comienzo del milenio vio la introducción de varios desarrollos independientes en la tecnología DEL. Estas tecnologías se pueden clasificar en dos categorías generales: tecnologías DEL no basadas en la evolución y basadas en la evolución capaces de la evolución molecular. La primera categoría se beneficia de la capacidad de usar reactivos disponibles y, por lo tanto, permite una generación de bibliotecas bastante sencilla. Los éxitos pueden identificarse mediante la secuenciación del ADN, sin embargo, la traducción del ADN y, por lo tanto, la evolución molecular no es factible con estos métodos. Los enfoques de división y agrupación desarrollados por investigadores de Praecis Pharmaceuticals (ahora propiedad de GlaxoSmithKline), Nuevolution (Copenhague, Dinamarca) y la tecnología ESAC desarrollada en el laboratorio del Prof. Neri (Instituto de Ciencias Farmacéuticas, Zurich, Suiza) entran en esta categoría . La tecnología ESAC se distingue por ser un enfoque de autoensamblaje combinatorio que se asemeja al descubrimiento de aciertos basados en fragmentos (Fig. 1b). Aquí, el recocido de ADN permite muestrear combinaciones de bloques de construcción discretas, pero no se produce una reacción química entre ellas. Ejemplos de tecnologías DEL basadas en la evolución son el enrutamiento de ADN desarrollado por el Prof. DR Halpin y el Prof. PB Harbury (Stanford University, Stanford, CA), la síntesis con plantilla de ADN desarrollada por el Prof.D. Liu (Harvard University, Cambridge, MA) y comercializado por Ensemble Therapeutics (Cambridge, MA) y tecnología YoctoReactor. [7] Desarrollado y comercializado por Vipergen (Copenhague, Dinamarca). Estas tecnologías se describen con más detalle a continuación. La síntesis con plantilla de ADN y la tecnología YoctoReactor requieren la conjugación previa de bloques de construcción químicos (BB) a una etiqueta de oligonucleótido de ADN antes del ensamblaje de la biblioteca, por lo tanto, se requiere más trabajo por adelantado antes del ensamblaje de la biblioteca. Además, los BB marcados con ADN permiten la generación de un código genético para compuestos sintetizados y es posible la traducción artificial del código genético: es decir, los BB pueden recuperarse mediante el código genético amplificado por PCR, y los compuestos de la biblioteca pueden regenerarse. Esto, a su vez, permite que el principio de la selección y evolución natural darwiniana se aplique a la selección de moléculas pequeñas en analogía directa con los sistemas de visualización biológicos; a través de rondas de selección,
Tecnologías no basadas en la evolución [ editar ]
Split - Y - piscina ADN que codifica [ editar ]
Con el fin de aplicar la química combinatoria para la síntesis de bibliotecas químicas codificadas por ADN, se siguió un enfoque de división y agrupación. Inicialmente un conjunto de ADN únicos oligonucleótidos ( n ) cada uno conteniendo una secuencia de codificación específico se conjuga químicamente a un conjunto correspondiente de pequeña molecules.Consequently orgánico, los oligonucleótidos compuestos -conjugate se mezclan ( "pool") y se dividieron ( "Split") en una serie de grupos ( m ). En condiciones apropiadas, un segundo conjunto de bloques de construcción (m) se acoplan al primero y un oligonucleótido adicional.que es la codificación de la segunda modificación se introduce enzimáticamente antes de mezclar de nuevo. Estos pasos de "división y agrupación" pueden repetirse varias veces ( r ) aumentando en cada ronda el tamaño de la biblioteca de manera combinatoria (es decir, ( n x m ) r ). Alternativamente, los ácidos nucleicos peptídicos no se han utilizado para codificar bibliotecas preparadas por el método de "división y encuesta". [8] Un beneficio de la codificación PNA es que la química puede realizarse mediante SPPS estándar. [9]
Acoplamiento paso a paso de fragmentos de ADN codificantes a moléculas orgánicas nacientes [ editar ]
Una estrategia prometedora para la construcción de bibliotecas codificadas por ADN se representa mediante el uso de bloques de construcción multifuncionales conjugados covalentemente a un oligonucleótido que sirve como "estructura central" para la síntesis de bibliotecas. En una forma de "agrupación y división", un conjunto de andamios multifuncionales experimenta reacciones ortogonales con series de parejas reactivas adecuadas. Después de cada paso de reacción, la identidad de la modificación se codifica por una adición enzimática del segmento de ADN a la "estructura central" del ADN original. [10] [11] El uso de N- aminoácidosprotegidos covalentemente unidos a un fragmento de ADN permite, después de una etapa de desprotección adecuada, un enlace amida adicionalFormación con una serie de ácidos carboxílicos o una aminación reductiva con aldehídos . De forma similar, los ácidos dienos carboxílicos utilizados como andamiajes para la construcción de bibliotecas en el extremo 5 'del oligonucleótido modificado con amino , podrían someterse a una reacción de Diels-Alder con una variedad de derivados de maleimida . Una vez completada la etapa de reacción deseada, la identidad del resto químico agregado al oligonucleótido se establece mediante el recocido de un oligonucleótido parcialmente complementario y mediante una posterior polimerización de ADN con relleno de Klenow., produciendo un fragmento de ADN de doble cadena. Las estrategias de síntesis y de codificación descritas anteriormente permiten la construcción fácil de bibliotecas de ADN codificada de un tamaño de hasta 10 4 compuestos miembro portador dos conjuntos de “bloques de construcción”. Sin embargo, también se puede contemplar la adición gradual de al menos tres conjuntos independientes de restos químicos a un bloque de construcción trifuncional para la construcción y codificación de una biblioteca muy grande codificada en ADN (que comprende hasta 10 6 compuestos). [10] ( Fig.2 )
Combinatoria auto-montaje [ editar ]
Bibliotecas químicas autoensambladas codificadas [ editar ]
E ncoded S elfo A ssembling C hemical ( ESAC ) las bibliotecas se basan en el principio de que dos sub-bibliotecas de un tamaño de x miembros (por ejemplo, 10 3 ) que contiene un dominio de hibridación complementario constante puede producir una biblioteca de ADN combinatoria-duplex después de la hibridación con una complejidad de x 2 miembros de la biblioteca representados uniformemente (por ejemplo, 10 6 ). [12] Cada miembro de la sub-biblioteca consistiría en un oligonucleótido que contiene una región codificante variable flanqueada por una secuencia de ADN constante, que lleva una modificación química adecuada en la extremidad del oligonucleótido. [12]Las sub-bibliotecas de ESAC se pueden usar en al menos cuatro realizaciones diferentes. [12]
- Una sub-biblioteca puede emparejarse con un oligonucleótido complementario y usarse como una biblioteca codificada de ADN que muestra un único compuesto unido covalentemente para experimentos de selección basados en afinidad.
- Una sub-biblioteca puede emparejarse con un oligonucleótido que muestra un aglutinante conocido al objetivo, permitiendo así las estrategias de maduración de afinidad.
- Dos sub-bibliotecas individuales se pueden ensamblar de forma combinatoria y utilizar para la identificación de novo de moléculas de unión de bindentate.
- Se pueden ensamblar tres sub-bibliotecas diferentes para formar una biblioteca triplex combinatoria.
Los aglutinantes preferenciales aislados de una selección basada en afinidad pueden amplificarse por PCR y decodificarse en microarrays de oligonucleótidos complementarios [13] o por concatenación de los códigos, subclonación y secuenciación . [14] Los bloques de construcción individuales pueden eventualmente conjugarse usando enlazadores adecuados para producir un compuesto de alta afinidad similar a un medicamento. Las características del enlazador (por ejemplo, longitud, flexibilidad, geometría, naturaleza química y solubilidad) influyen en la afinidad de unión y las propiedades químicas del aglutinante resultante ( Fig . 3 )
Los experimentos de bio-panning en HSA de una biblioteca ESAC de 600 miembros permitieron el aislamiento del resto 4- ( p- yodofenil) butanoico. El compuesto representa la estructura central de una serie de moléculas de unión a la albúmina portátiles y de Albufluor TM, un agente de contraste angiográfico con fluoresceínarecientemente desarrollado actualmente en evaluación clínica. [15]
La tecnología ESAC se ha utilizado para el aislamiento de inhibidores potentes de la tripsina bovina y para la identificación de nuevos inhibidores de la estromelisina-1 ( MMP-3 ), una metaloproteinasa de matriz involucrada en procesos de remodelación de tejidos fisiológicos y patológicos, así como en procesos de enfermedades. , como la artritis y la metástasis . [dieciséis]
Tecnologías basadas en la evolución [ editar ]
DNA-enrutamiento [ editar ]
En 2004, DR Halpin y PB Harbury presentaron un método novedoso e intrigante para la construcción de bibliotecas codificadas con ADN. Por primera vez, las plantillas conjugadas con ADN sirvieron para codificar y programar la infraestructura de la síntesis de "división y agrupación" de los componentes de la biblioteca. [17] El diseño de Halpin y Harbury permitió rondas alternas de selección, amplificación por PCR y diversificación con pequeñas moléculas orgánicas, en completa analogía con la tecnología de visualización de fagos . La maquinaria de enrutamiento de ADN consiste en una serie de columnas conectadas que llevan anticodones unidos a resina, que podrían separar específicamente una población de plantillas de ADN en ubicaciones espacialmente distintas mediante hibridación . [17]De acuerdo con este protocolo de división y agrupación, se generó una biblioteca combinatoria de péptidos codificada por ADN de 10 6 miembros. [18]
De plantilla de ADN de síntesis [ editar ]
En 2001, David Liu y colaboradores demostraron que se pueden usar oligonucleótidos de ADN complementarios para ayudar a ciertas reacciones sintéticas , que no tienen lugar de manera eficiente en solución a baja concentración . [19] [20] Se usó un heterodúplex de ADN para acelerar la reacción entre los restos químicos mostrados en las extremidades de las dos cadenas de ADN. Además, el "efecto de proximidad", que acelera la reacción bimolecular, demostró ser independiente de la distancia (al menos dentro de una distancia de 30 nucleótidos ). [19] [20] En una secuencia programada, se hibridaron losoligonucleótidos que portaban un grupo de reactivos químicosa los derivados de oligonucleótidos complementarios que llevan un grupo químico reactivo diferente. La proximidad conferida por la hibridación del ADN aumenta drásticamente la molaridad efectiva de los reactivos de reacción unidos a los oligonucleótidos, permitiendo que ocurra la reacción deseada incluso en un ambiente acuoso en concentraciones que son varios órdenes de magnitud más bajas que las necesarias para la reacción orgánica convencional correspondiente. no con plantillas de ADN. [21] Utilizando una configuración con plantilla de ADN y una síntesis programada por secuencias, Liu y sus colaboradores generaron una biblioteca de macrociciclos con codificación de ADN compuesto de 64 miembros . [22]
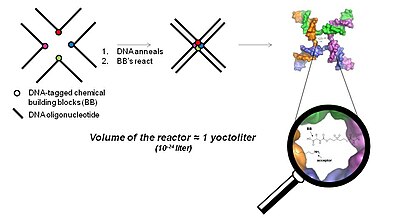
Tecnología de proximidad tridimensional (tecnología YoctoReactor) [ editar ]
El YoctoReactor (yR) es un enfoque de proximidad en 3D que explota la naturaleza de autoensamblaje de los oligonucleótidos de ADN en uniones de 3, 4 o 5 vías para dirigir la síntesis de moléculas pequeñas en el centro de la unión. La Figura 5 ilustra el concepto básico con una unión de ADN de 4 vías.
El centro de la unión de ADN constituye un volumen del orden de un yoctolitro , de ahí el nombre YoctoReactor. Este volumen contiene una reacción de molécula única que produce concentraciones de reacción en el rango alto mM. La concentración efectiva facilitada por el ADN acelera en gran medida las reacciones químicas que de otra manera no tendrían lugar en la concentración real varios órdenes de magnitud más bajos.
Construyendo una biblioteca yR [ editar ]
La Figura 6 ilustra la generación de una biblioteca yR utilizando una unión de ADN de 3 vías.
En resumen, los bloques de construcción químicos (BB) se unen a través de enlazadores escindibles o no escindibles a tres tipos de oligonucleótidos de ADN biespecíficos (oligo-BB) que representan cada brazo del yR. Para facilitar la síntesis de manera combinatoria, los oligo-BB están diseñados de tal manera que el ADN contiene (a) el código para un BB adjunto en el extremo distal de las áreas de oligo (líneas de color) y (b) de secuencia de ADN constante (negro). líneas) para lograr el autoensamblaje del ADN en una unión de 3 vías (independientemente de la BB) y la reacción química posterior. Las reacciones químicas se realizan mediante un procedimiento por etapas y, después de cada paso, el ADN se liga y el producto se purifica por electroforesis en gel de poliacrilamida. Los enlazadores escindibles (BB-ADN) se utilizan para todas las posiciones menos una, produciendo una biblioteca de moléculas pequeñas con un solo enlace covalente al código de ADN.
El enfoque de diseño de yR proporciona un sitio de reacción invariable con respecto a (a) la distancia entre los reactivos y (b) el entorno de secuencia que rodea el sitio de reacción. Además, la conexión íntima entre el código y el BB en los restos oligo-BB que se mezclan de manera combinatoria en un solo recipiente confiere una alta fidelidad a la codificación de la biblioteca. El código de los productos sintetizados, además, no está preestablecido, sino que se ensambla de manera combinatoria y se sintetiza en sincronicidad con el producto innato.
Cribado homogéneo de bibliotecas de yoctoreactor [ editar ]
Recientemente se ha desarrollado un método homogéneo para el cribado de bibliotecas de yoctorreactores (yR) que utiliza tecnología de emulsión de agua en aceite para aislar complejos individuales de ligando-objetivo. Llamado Enriquecimiento de la Trampa de Aglomerantes (BTE), los ligandos a una diana proteica se identifican atrapando pares de unión (diana proteica marcada con ADN y ligando yR) en gotitas de emulsión durante la cinética dominada por la disociación. Una vez atrapado, el ADN objetivo y el ligando se unen por ligadura, preservando así la información de unión.
De aquí en adelante, la identificación de aciertos es esencialmente un ejercicio de conteo: la información sobre los eventos de enlace se descifra mediante la secuenciación y el conteo de los ligantes selectivos de ADN unidos se cuentan con una frecuencia mucho mayor que los ligantes aleatorios. Esto es posible porque el atrapamiento aleatorio del objetivo y el ligando se "diluye" por el alto número de gotas de agua en la emulsión. La baja señal de ruido y de fondo característica de BTE se atribuye a la "dilución" de la señal aleatoria, la falta de artefactos de superficie y la alta fidelidad de la biblioteca yR y el método de detección. La detección se realiza en un solo método de tubo. Los golpes biológicamente activos se identifican en una sola ronda de BTE caracterizada por una tasa baja de falsos positivos.
BTE imita la naturaleza no equilibrada de las interacciones in vivo ligando-diana y ofrece la posibilidad única de detectar ligandos específicos de la diana en función del tiempo de residencia del ligando-diana debido a que la emulsión, que atrapa el complejo de unión, se forma durante una fase de disociación dinámica.
Decodificación de bibliotecas químicas de ADN codificada [ editar ]
Tras la selección de bibliotecas químicas codificadas por ADN, la estrategia de decodificación para la identificación rápida y eficiente de los compuestos de unión específicos es crucial para el desarrollo posterior de la tecnología DEL . Hasta ahora, la decodificación basada en la secuenciación de Sanger , la metodología basada en micromatrices y las técnicas de secuenciación de alto rendimiento representaban las metodologías principales para la decodificación de las selecciones de bibliotecas codificadas por ADN.
Sanger basado en secuenciación de decodificación [ editar ]
Aunque muchos autores previeron implícitamente una decodificación tradicional basada en la secuenciación de Sanger , [4] [5] [12] [18] [22] el número de códigos a secuencia simplemente según la complejidad de la biblioteca es definitivamente una tarea poco realista para un tradicional Enfoque de secuenciación de Sanger . Sin embargo, la implementación de la secuenciación de Sanger para decodificar bibliotecas de productos químicos codificados en el ADN en forma de alto rendimiento fue la primera en describirse. [12] Después de la selección y amplificación por PCR de las etiquetas de ADN de los compuestos de la biblioteca, se generaron concatámeros que contenían múltiples secuencias codificantes y se ligaron en un vector. Tras la secuenciación de Sanger de un número representativo de las colonias resultantes , se revelaron las frecuencias de los códigos presentes en la muestra de la biblioteca codificada con ADN antes y después de la selección. [12]
Microarray basado en la decodificación [ editar ]
Una micromatriz de ADN es un dispositivo para investigaciones de alto rendimiento ampliamente utilizado en biología molecular y en medicina . Consiste en una serie de puntos microscópicos ("características" o "ubicaciones") que contienen pocos picomoles de oligonucleótidos que llevan una secuencia de ADN específica. Esta puede ser una sección corta de un gen u otro elemento de ADN que se utilizan como sondas para hibridaruna muestra de ADN o ARN en condiciones adecuadas. La hibridación sonda-objetivo generalmente se detecta y cuantifica mediante la detección de fluoróforos basada en fluorescenciadianas marcadas para determinar la abundancia relativa de las secuencias de ácido nucleico diana . Microarray se ha utilizado para la decodificación exitosa de bibliotecas codificadas con ADN de ESAC [12] y bibliotecas codificadas con PNA. [23] Los oligonucleótidos codificantes que representan los compuestos químicos individuales en la biblioteca, se manchan y se unen químicamente en los portaobjetos de micromatrices , utilizando un robot BioChip Arrayer. Posteriormente, las etiquetas de oligonucleótidos de los compuestos de unión aislados de la selección se amplifican por PCR utilizando un cebador fluorescente y se hibridan en el ADN.portaobjetos de microarrays . Posteriormente, los microarrays se analizan mediante un escaneo láser y se detectan y cuantifican las intensidades del punto. El enriquecimiento de los compuestos de unión preferencial se revela comparando la intensidad de las manchas del portaobjetos de micromatrices de ADN antes y después de la selección. [12]
Decodificación por secuenciación de alto rendimiento [ editar ]
De acuerdo con la complejidad de la biblioteca química codificada por ADN (típicamente entre 10 3 y 10 6miembros), es poco probable que una descodificación basada en la secuenciación de Sanger convencional sea utilizable en la práctica, debido tanto al alto costo por base de la secuenciación como a la tediosa procedimiento involucrado [24] Las tecnologías de secuenciación de alto rendimiento explotaron estrategias que paralelizan el proceso de secuenciación, desplazando el uso de la electroforesis capilar y produciendo miles o millones de secuencias a la vez. En 2008 se describió la primera implementación de una técnica de secuenciación de alto rendimiento desarrollada originalmente para la secuenciación del genoma (es decir, tecnología " 454 " ).") para la decodificación rápida y eficiente de una biblioteca química codificada por ADN que comprende 4000 compuestos. [10] Este estudio condujo a la identificación de nuevos compuestos químicos con constantes de disociaciónsubmicromolar hacia la estreptavidina y definitivamente mostró la viabilidad de construir, realizar selecciones y descodificar ADN Bibliotecas codificadas que contienen millones de compuestos químicos.





No hay comentarios:
Publicar un comentario