ciclo termodinámico consiste en una secuencia vinculada de procesos termodinámicos que involucra la transferencia de calor y trabajo dentro y fuera del sistema, mientras que varía la presión, la temperatura y otras variables de estado dentro del sistema, y que eventualmente hace que el sistema vuelva a su estado inicial. [1] En el proceso de pasar por un ciclo, el fluido de trabajo (sistema) puede convertir el calor de una fuente cálida en un trabajo útil y desechar el calor restante en un sumidero frío, actuando así como un motor térmico . A la inversa, el ciclo puede invertirse y utilizar el trabajo para mover el calor de una fuente fría y transferirlo a un sumidero caliente, actuando así como una bomba de calor.. En cada punto del ciclo, el sistema está en equilibrio termodinámico, por lo que el ciclo es reversible (su cambio de entropía es cero, ya que la entropía es una función de estado).
Durante un ciclo cerrado, el sistema vuelve a su estado termodinámico original de temperatura y presión. Las cantidades de proceso (o las cantidades de trayectoria), como el calor y el trabajodependen del proceso. Para un ciclo en el que el sistema vuelve a su estado inicial, se aplica la primera ley de la termodinámica:
Lo anterior indica que no hay cambio de la energía del sistema a lo largo del ciclo. E in podría ser el trabajo y la entrada de calor durante el ciclo y E out sería el trabajo y la salida de calor durante el ciclo. La primera ley de la termodinámica también dicta que la entrada de calor neta es igual a la salida de trabajo neta a lo largo de un ciclo (tenemos en cuenta el calor, Q in , como positivo y Q out como negativo). La naturaleza repetitiva de la trayectoria del proceso permite un funcionamiento continuo, haciendo del ciclo un concepto importante en termodinámica . Los ciclos termodinámicos a menudo se representan matemáticamente como procesos cuasiestáticos en el modelado del funcionamiento de un dispositivo real.
Calor y trabajo [ editar ]
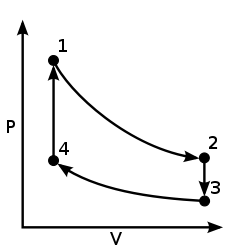
Dos clases principales de ciclos termodinámicos son ciclos de potencia y ciclos de bomba de calor . Los ciclos de energía son ciclos que convierten cierta entrada de calor en una salida de trabajo mecánico , mientras que los ciclos de la bomba de calor transfieren calor de temperaturas bajas a altas utilizando el trabajo mecánico como entrada. Los ciclos compuestos completamente de procesos cuasiestáticos pueden operar como ciclos de energía o de bomba de calor mediante el control de la dirección del proceso. En un diagrama de presión-volumen (PV) o de temperatura-entropía , las direcciones hacia la derecha y hacia la izquierda indican los ciclos de potencia y de bomba de calor, respectivamente.
Relación para trabajar [ editar ]
Debido a que la variación neta en las propiedades de estado durante un ciclo termodinámico es cero, forma un bucle cerrado en un diagrama PV . El eje Y de un diagrama FV muestra la presión ( P ) y el eje X muestra el volumen ( V ). El área encerrada por el bucle es el trabajo ( W ) realizado por el proceso:
Este trabajo es igual al balance de calor (Q) transferido al sistema:
La ecuación (2) hace que un proceso cíclico sea similar a un proceso isotérmico : aunque la energía interna cambia durante el curso del proceso cíclico, cuando el proceso cíclico finaliza, la energía del sistema es la misma que la que tenía cuando comenzó el proceso.
Si el proceso cíclico se mueve en el sentido de las agujas del reloj alrededor del bucle, entonces W será positivo y representará un motor térmico . Si se mueve en sentido contrario a las agujas del reloj, W será negativo y representará una bomba de calor .
Cada punto en el ciclo [ editar ]
Ciclo de otto
- 1 → 2: expansión isentrópica : entropía (s) constante (s), disminución de la presión (P), aumento del volumen (v), disminución de la temperatura (T)
- 2 → 3: Enfriamiento isocórico : volumen constante (v), disminución de la presión (P), disminución de la entropía (S), disminución de la temperatura (T)
- 3 → 4: Compresión isentrópica: entropía (s) constante (s), aumento de la presión (P), disminución del volumen (v), aumento de la temperatura (T)
- 4 → 1: Calentamiento isocórico: volumen constante (v), aumento de la presión (P), aumento de la entropía (S), aumento de la temperatura (T)
Una lista de procesos termodinámicos [ editar ]
- Adiabático : No transferir energía como calor (Q) durante esa parte del ciclo equivaldría a Q = 0. Esto no excluye la transferencia de energía como trabajo.
- Isotérmico : el proceso se encuentra a una temperatura constante durante esa parte del ciclo (T = constante, δT = 0). Esto no excluye la transferencia de energía como calor o trabajo.
- Isobárico : la presión en esa parte del ciclo se mantendrá constante. (P = constante, δP = 0). Esto no excluye la transferencia de energía como calor o trabajo.
- Isocórico : el proceso es un volumen constante (V = constante, δV = 0). Esto no excluye la transferencia de energía como calor o trabajo.
- Isentrópico : El proceso es de entropía constante (S = constante, δS = 0). Esto excluye la transferencia de calor pero no funciona.
- Isenthalpic : proceso que se realiza sin ningún cambio en la entalpía o entalpía específica
- Politrópico : proceso que obedece a la relación:
- Reversible : proceso donde la producción de entropía es cero.
Ciclos de energía [ editar ]
Los ciclos de energía termodinámicos son la base para el funcionamiento de los motores térmicos, que suministran la mayor parte de la energía eléctricadel mundo y funcionan con la gran mayoría de los vehículos motorizados . Los ciclos de potencia se pueden organizar en dos categorías: ciclos reales y ciclos ideales. Los ciclos encontrados en los dispositivos del mundo real (ciclos reales) son difíciles de analizar debido a la presencia de efectos de complicación (fricción) y la ausencia de tiempo suficiente para el establecimiento de condiciones de equilibrio. Para fines de análisis y diseño, se crean modelos idealizados (ciclos ideales); estos modelos ideales les permiten a los ingenieros estudiar los efectos de los parámetros principales que dominan el ciclo sin tener que gastar un tiempo significativo en la elaboración de detalles complejos presentes en el modelo del ciclo real.
Los ciclos de potencia también se pueden dividir según el tipo de motor térmico que buscan modelar. Los ciclos más comunes utilizados para modelar motores de combustión interna son el ciclo Otto , que modela los motores de gasolina , y el ciclo diésel , que modela los motores diesel . Los ciclos que modelan motores de combustión externa incluyen el ciclo Brayton , que modela turbinas de gas , el ciclo Rankine , que modela turbinas de vapor , el ciclo Stirling , modelos de motores de aire caliente y el ciclo Ericsson., que también modela motores de aire caliente.
Por ejemplo, la salida de trabajo mecánico de presión-volumen del ciclo ideal de Stirling (trabajo neto), que consta de 4 procesos termodinámicos, es [ citación necesaria ] [ dudosa ] :
Para el ciclo ideal de Stirling, no se produce ningún cambio de volumen en los procesos 4-1 y 2-3, por lo que la ecuación (3) se simplifica a:
Ciclos de bomba de calor [ editar ]
Los ciclos de bombas de calor termodinámicas son los modelos para bombas de calor y refrigeradoresdomésticos . No hay diferencia entre los dos, excepto que el propósito del refrigerador es enfriar un espacio muy pequeño, mientras que la bomba de calor doméstica está destinada a calentar una casa. Ambos trabajan moviendo el calor desde un espacio frío a un espacio cálido. El ciclo de refrigeración más común es el ciclo de compresión de vapor , que modela sistemas que usan refrigerantes que cambian de fase. El ciclo de refrigeración por absorción es una alternativa que absorbe el refrigerante en una solución líquida en lugar de evaporarlo. Los ciclos de refrigeración de gas incluyen el ciclo de Brayton invertido y el ciclo de Hampson-Linde. Los múltiples ciclos de compresión y expansión permiten que los sistemas de refrigeración por gas licuen los gases .
Modelado de sistemas reales [ editar ]
Los ciclos termodinámicos se pueden usar para modelar dispositivos y sistemas reales, generalmente mediante una serie de suposiciones. [2] a menudo es necesario simplificar los supuestos para reducir el problema a una forma más manejable. [2] Por ejemplo, como se muestra en la figura, los dispositivos como una turbina de gas o un motor a reacción pueden modelarse como un ciclo de Brayton. El dispositivo real se compone de una serie de etapas, cada una de las cuales está modelada como un proceso termodinámico idealizado. Aunque cada etapa que actúa sobre el fluido de trabajo es un dispositivo real complejo, puede modelarse como procesos idealizados que se aproximan a su comportamiento real. Si se agrega energía por medios distintos a la combustión, entonces se supone que los gases de escape pasarían del escape a un intercambiador de calor que enviaría el calor residual al ambiente y el gas de trabajo se reutilizaría en la etapa de entrada.
La diferencia entre un ciclo idealizado y el rendimiento real puede ser significativa. [2] Por ejemplo, las siguientes imágenes ilustran las diferencias en el rendimiento del trabajo predicho por un ciclo ideal de Stirling y el rendimiento real de un motor Stirling:
 |  |  |
| Ciclo ideal de stirling | Rendimiento real | Superposición real e ideal, mostrando la diferencia en el rendimiento del trabajo |
Como la salida neta de trabajo para un ciclo está representada por el interior del ciclo, hay una diferencia significativa entre la salida de trabajo predicha del ciclo ideal y la salida de trabajo real mostrada por un motor real. También se puede observar que los procesos individuales reales divergen de sus contrapartes idealizadas; por ejemplo, la expansión isocórica (proceso 1-2) ocurre con algún cambio de volumen real.
Ciclos termodinámicos conocidos [ editar ]
En la práctica, los ciclos termodinámicos idealizados simples se hacen generalmente de cuatro procesos termodinámicos . Se puede utilizar cualquier proceso termodinámico. Sin embargo, cuando se modelan ciclos idealizados, a menudo se utilizan procesos en los que se mantiene constante una variable de estado, como un proceso isotérmico (temperatura constante), proceso isobárico (presión constante), proceso isocórico (volumen constante), proceso isentrópico (entropía constante) , o un proceso isenthalpic (entalpia constante). A menudo también se utilizan procesos adiabáticos , donde no se intercambia calor.
Algunos ejemplos de ciclos termodinámicos y sus procesos constituyentes son los siguientes:
| Ciclo | Compresión, 1 → 2 | Adición de calor, 2 → 3 | Expansión, 3 → 4 | Rechazo de calor, 4 → 1 | Notas |
|---|---|---|---|---|---|
| Ciclos de alimentación normalmente con combustión externa o ciclos de bomba de calor: | |||||
| Campana coleman | adiabático | isobárico | adiabático | isobárico | Un ciclo de Brayton invertido. |
| Carnot | isentrópico | isotérmico | isentrópico | isotérmico | Motor de calor de carnot |
| Ericsson | isotérmico | isobárico | isotérmico | isobárico | El segundo ciclo de Ericsson desde 1853. |
| Rankine | adiabático | isobárico | adiabático | isobárico | Máquina de vapor |
| Higroscópico | adiabático | isobárico | adiabático | isobárico | Ciclo higroscópico |
| Scuderi | adiabático | presión y volumenvariables | adiabático | isocorico | |
| Stirling | isotérmico | isocorico | isotérmico | isocorico | motor Stirling |
| Manson | isotérmico | isocorico | isotérmico | isocórico entonces adiabático | Motor de manson-guisa |
| Stoddard | adiabático | isobárico | adiabático | isobárico | |
| Ciclos de energía normalmente con combustión interna : | |||||
| Brayton | adiabático | isobárico | adiabático | isobárico | Motor a reacción . La versión de combustión externa de este ciclo se conoce como primer ciclo de Ericssondesde 1833. |
| Diesel | adiabático | isobárico | adiabático | isocorico | Motor diesel |
| Lenoir | isobárico | isocorico | adiabático | Chorros de pulso . Nota, 1 → 2 logra tanto el rechazo de calor como la compresión. | |
| Otón | adiabático | isocorico | adiabático | isocorico | Motores de gasolina / gasolina |
Ciclo ideal [ editar ]
Un ciclo ideal se construye a partir de:
- TOP y BOTTOM del bucle: un par de procesos isobáricos paralelos
- IZQUIERDA y DERECHA del bucle: un par de procesos isocóricos paralelos
Energía interna de un gas perfecto que experimenta diferentes porciones de un ciclo:
Isotérmico:
Isocorico
Isobárico:
Ciclo de carnot [ editar ]
El ciclo de Carnot es un ciclo compuesto por los procesos totalmente reversibles de compresión y expansión isentrópicas y de adición y rechazo de calor isotérmico . La eficiencia térmica de un ciclo de Carnot depende solo de las temperaturas absolutas de los dos reservorios en los que tiene lugar la transferencia de calor, y para un ciclo de energía es:
dónde es la temperatura más baja del ciclo y el más alto. Para los ciclos de energía de Carnot, el coeficiente de rendimiento de una bomba de calor es:
La segunda ley de la termodinámica limita la eficiencia y el COP para todos los dispositivos cíclicos a niveles en o por debajo de la eficiencia de Carnot. El ciclo de Stirling y el ciclo de Ericsson son otros dos ciclos reversibles que utilizan la regeneración para obtener la transferencia de calor isotérmica.
Ciclo de Stirling [ editar ]
Un ciclo de Stirling es como un ciclo de Otto, excepto que las adiabáticas son reemplazadas por isotermas. También es lo mismo que un ciclo de Ericsson con los procesos isobáricos sustituidos por procesos de volumen constante.
- TOP y BOTTOM del bucle: un par de procesos isotérmicos casi paralelos
- Lados IZQUIERDO y DERECHO del bucle: un par de procesos isocóricos paralelos
El calor fluye en el circuito a través de la isoterma superior y la isocora izquierda, y parte de este calor fluye hacia afuera a través de la isoterma inferior y la isocora derecha, pero la mayor parte del flujo de calor es a través del par de isotermas. Esto tiene sentido ya que todo el trabajo realizado por el ciclo es realizado por el par de procesos isotérmicos, que se describen por Q = W . Esto sugiere que todo el calor neto entra a través de la isoterma superior. De hecho, todo el calor que llega a través del isocoro izquierdo sale a través del isocoro derecho: ya que la isoterma superior está a la misma temperatura más cálida y la isoterma inferior está a la misma temperatura más fría , y dado que el cambio en la energía para un isocoro es proporcional al cambio en la temperatura, entonces todo el calor que ingresa a través del isocoro izquierdo se cancela exactamente por el calor que sale del isocoro derecho.
Las funciones del Estado y la entropía [ editar ]
- .
La entropía es una función de estado y se define como
así que eso
- ,
entonces parece que para cualquier proceso cíclico,
lo que significa que el cambio neto de entropía del fluido de trabajo a lo largo de un ciclo es cero.





























No hay comentarios:
Publicar un comentario