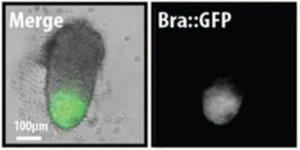
Los gastruloides son agregados tridimensionales de células madre embrionarias (CES) que, en condiciones de cultivo apropiadas, desarrollan una organización similar a la del embrión con tres ejes ortogonales y una distribución precisa de los primordios para múltiples derivados de las tres capas germinales en ausencia de tejidos extraembrionarios. Significativamente, carecen de cerebro anterior y medio. Son un sistema modelo para el estudio del desarrollo y la enfermedad de los mamíferos [3] [4] [5] [6] [7] [8].
Fondo [ editar ]
El sistema modelo Gastruloid se basa en el trabajo de Marikawa et al. [9] [10] . En esos estudios, pequeñas células de carcinoma embrionario P19 (EC) se agregaron como cuerpos embrioides ( EB ) y se usaron para investigar los procesos involucrados en la formación del mesodermo. [9] Los EB pudieron organizarse en estructuras similares al embrión gastrulante con expresión génica polarizada, alargamiento / organización axial y regulación positiva de los marcadores mesodérmicos posteriores. Esto estaba en marcado contraste con el trabajo con EB de ESC de ratón, donde este nivel de organización no se había informado, a pesar de que los progenitores de poblaciones axiales se pueden generar en cultivo [11][12] .
Después de este estudio, el laboratorio de Martínez Arias en el Departamento de Genética de la Universidad de Cambridge demostró cómo los agregados de ESC de ratón podían generar estructuras que exhibían comportamientos colectivos con sorprendentes similitudes con los de un desarrollo temprano, como la ruptura de simetría (en términos de expresión génica), alargamiento axial y especificación de la capa germinal [3] [7] . Para citar el artículo original: "En conjunto, estas observaciones enfatizan aún más la similitud entre los procesos que hemos descubierto aquí y los eventos en el embrión. Los movimientos están relacionados con los de las células en embriones gastrulantes y por esta razón denominamos estos agregados 'gastruloides' ".Como señalaron los autores de este protocolo, una diferencia crucial entre este método de cultivo y el trabajo previo con EB de ratón fue el uso de pequeñas cantidades de células que pueden ser importantes para generar la escala de longitud correcta para el patrón. [3] [4] [13]
Brachyury (T / Bra) , un gen que marca la racha primitiva y el sitio de gastrulación, está regulado por aumento en los Gastruloides después de un pulso del agonista de Wnt / β-Catenina CHIR99021 [2] (Chi; otros factores también han sido probado [3] ) y se regionaliza a la punta alargada del Gastruloide. Desde o cerca de la región que expresa T / Bra, las células que expresan el marcador mesodérmico tbx6 se extruyen de las células similares al embrión gastrulante; Es por esta razón que estas estructuras se llaman Gastruloides [3] .
Otros estudios revelaron que los eventos que especifican la expresión de T / Bra en gastruloides imitan a los del embrión [7] . Las modificaciones en el protocolo [14] y el cultivo extendido muestran que, después de siete días, los gastruloides exhiben una organización muy similar a un embrión de midgestation con primordios espacialmente organizados para todos los derivados mesodérmicos (axiales, paraxiales, intermedios, cardíacos, craneales y hematopoyéticos) y endodérmicos. como la médula espinal [8] . También implementan la expresión del gen Hox con las coordenadas espacio-temporales como el embrión [8] .
Una característica de los gastruloides es la desconexión entre los programas y esquemas transcripcionales y la morfogénesis.
Lectura adicional [ editar ]
Artículo del sitio web del laboratorio Martinez Arias que contiene información actualizada sobre la historia, los métodos y los protocolos actuales sobre el cultivo de gatruloides y sus usos.
El término Gastruloide se ha ampliado para incluir arreglos de células madre embrionarias humanas autoorganizadas en patrones (micro patrones) que imitan eventos de patrones tempranos en desarrollo.
El disco germinal puede referirse a:
en pájaros [ editar ]
El disco germinal , también llamado el blastodisco , es una circular mancha blanca pequeña,, (aproximadamente 1,5-3 mm de diámetro) en la superficie de la amarillo yema de un pájaro 's huevo .
en mamíferos [ editar ]
El blastodisc se refiere a una capa redonda de células unicelulares dentro de la blástula a partir de la cual se va a formar el embrión.
La espermatogénesis in vitro es el proceso de creación de gametos masculinos ( espermatozoides ) fuera del cuerpo en un sistema de cultivo. El proceso podría ser útil para la preservación de la fertilidad, el tratamiento de la infertilidad y puede desarrollar aún más la comprensión de la espermatogénesis a nivel celular y molecular.
La espermatogénesis es un proceso altamente complejo y su reconstrucción artificial in vitro es un desafío. [ cita requerida ] Esto incluye crear un microambiente similar al de los testículos, así como apoyar la señalización endocrina y paracrina, y garantizar la supervivencia de las células somáticas y germinales de las células madre espermatogoniales (SSC) a los espermatozoides maduros. [1]
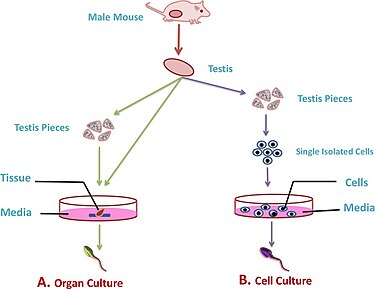
Se pueden usar diferentes métodos de cultivo en el proceso, tales como cultivos celulares aislados , cultivos fragmentados y cultivos 3D .
Técnicas de cultivo [ editar ]
Cultivos celulares aislados [ editar ]
Los cultivos celulares pueden incluir monocultivos, donde se cultiva una población celular, o sistemas de cocultivo, donde varias líneas celulares (deben ser al menos dos) se pueden cultivar juntas. [2] Las células se aislan inicialmente para el cultivo al digerir enzimáticamente el tejido testicular para separar los diferentes tipos de células para el cultivo. [ cita requerida ] El proceso de aislamiento de las células puede conducir al daño celular. [3]
La principal ventaja del monocultivo es que se puede investigar el efecto de diferentes influencias en una población celular específica de células. [ cita requerida ] El cocultivo permite observar y experimentar las interacciones entre las poblaciones celulares, lo que se considera una ventaja sobre el modelo de monocultivo. [2]
El cultivo celular aislado, específicamente el cocultivo del tejido testicular, ha sido una técnica útil para examinar las influencias de factores específicos como las hormonas o las diferentes células alimentadoras en la progresión de la espermatogénesis in vitro . [ cita requerida ] Por ejemplo, factores como la temperatura, la influencia de las células alimentadoras y el papel de la testosterona y la hormona foliculoestimulante (FSH) se han investigado utilizando técnicas de cultivo celular aisladas. [2]
Los estudios han concluido que diferentes factores pueden influir en el cultivo de células germinales, por ejemplo, medios, factores de crecimiento, hormonas y temperatura. Por ejemplo, cuando se cultivan células germinales de ratón inmortalizadas a temperaturas de 35, 37 y 29 ºC, estas células proliferan más rápidamente a la temperatura más alta y menos rápidamente a la temperatura más baja, pero hubo diferentes niveles de diferenciación. A la temperatura más alta no se detectaron diferencias, algunas se observaron a 37 ℃ y algunas espermátidestempranas aparecieron a 32 ℃. [2]
Las investigaciones de las células alimentadoras apropiadas concluyeron que una variedad de células podría fomentar el desarrollo de células germinales como las células de Sertoli , las células de Leydig y las células mioides peritubulares, pero lo más esencial son las células de Sertoli, pero las células de Leydig y las mioides peritubulares contribuyen al microambiente que alienta el tallo células para permanecer pluripotentes y auto renovarse en los testículos. [4]
Culturas de fragmentos de testículos [ editar ]
En cultivos de fragmentos, se extirpan los testículos y se cultivan fragmentos de tejido en medios suplementarios que contienen diferentes factores de crecimiento para inducir la espermatogénesis y formar gametos funcionales. [1] El desarrollo de esta técnica de cultivo ha tenido lugar principalmente con el uso de modelos animales, por ejemplo, ratones o tejido de testículo de rata.
La ventaja de usar este método es que mantiene la disposición espacial natural de los túbulos seminíferos . Sin embargo, la hipoxia es un problema recurrente en estos cultivos donde el bajo suministro de oxígeno dificulta el desarrollo y la maduración de las espermátidas (significativamente más en los tejidos de los testículos adultos que en los inmaduros). [1] Otros desafíos con este tipo de cultivo incluyen el mantenimiento de la estructura de los túbulos seminíferos, lo que hace que sea más difícil para los cultivos celulares a más largo plazo, ya que las estructuras de los tejidos pueden aplanarse, lo que dificulta su trabajo. [4] Para resolver algunos de estos problemas, se pueden utilizar cultivos 3D.
En 2012, se aislaron espermatozoides maduros capaces de fertilizar a partir de cultivos in vitro de tejido inmaduro de testículo de ratón. [5]
Culturas 3D [ editar ]
Los cultivos 3D utilizan esponjas, modelos o andamios que se asemejan a los elementos de la matriz extracelularpara lograr una estructura espacial más natural de los túbulos seminíferos y para representar mejor los tejidos y la interacción entre diferentes tipos de células en un experimento ex vivo . Los diferentes componentes de la matriz extracelular, como el colágeno, el agar y el alginato de calcio, se usan comúnmente para formar el gel o andamio que puede proporcionar oxígeno y nutrientes. [2] Para propagar cultivos 3D, los cultivos de células testiculares se incrustan en la esponja / armazón poroso y se les permite colonizar la estructura que luego puede sobrevivir durante varias semanas para permitir que la espermatogonía se diferencie y madure en espermatozoides.
Además, agitar los cultivos 3D durante el proceso de siembra permite un mayor suministro de oxígeno que ayuda a superar el problema de la hipoxia y, por lo tanto, mejora la vida útil de las células. [2]
A diferencia de los monocultivos, los cultivos de fragmentos / 3D pueden establecer condiciones in vitro que pueden parecerse un poco al microambiente testicular para permitir un estudio más preciso de la fisiología testicular y sus asociaciones con el desarrollo in vitro de células de esperma. [2]
Implicaciones futuras [ editar ]
Científico [ editar ]
La capacidad de recapitular la espermatogénesis in vitro brinda una oportunidad única para estudiar este proceso biológico a través de un método de investigación a menudo más barato y más rápido que el trabajo in vivo . La observación es a menudo más fácil in vitro , ya que las células objetivo están mayormente aisladas e inmóviles. Otra ventaja significativa de la investigación in vitro es la facilidad con la que los factores ambientales pueden modificarse y controlarse. También hay técnicas que no son prácticas o factibles in vivo que ahora se pueden explorar. [5]
El trabajo in vitro no está exento de desafíos propios. Por ejemplo, uno pierde la estructura natural proporcionada por el tejido in vivo y, por lo tanto, las conexiones celulares que podrían ser importantes para la función del tejido. [1]
Clínica [ editar ]
Si bien la espermatogénesis de roedores no es idéntica a su contraparte humana, especialmente debido a la alta tasa de evolución del tracto reproductor masculino, estas técnicas son un punto de partida sólido para futuras aplicaciones en humanos. [5]
Varias categorías de hombres infértiles pueden beneficiarse de los avances en estas técnicas, especialmente aquellos con una falta de producción de gametos viable. Estos hombres no pueden beneficiarse, por ejemplo, de las técnicas de extracción de esperma, y actualmente tienen pocas o ninguna opción para producir descendientes genéticos. [6]
En particular, los hombres que se han sometido a quimioterapia / radioterapia antes de la pubertad pueden beneficiarse de la espermatogénesis in vitro . Estas personas no tenían la opción de criopreservar esperma viable antes de su procedimiento y, por lo tanto, la capacidad de generar esperma genéticamente descendido más adelante en la vida es invaluable. Los posibles métodos que podrían aplicarse (a este y otros grupos) son la inducción de espermatogénesis en muestras de testículos tomadas antes de la pubertad o, si estas muestras no están disponibles / viables, los nuevos métodos que manipulan la diferenciación de células madre podrían producir SSC 'desde cero', utilizando muestras de células madre adultas . [5]
Un método alternativo es injertar tejido preservado en sobrevivientes adultos de cáncer, sin embargo, esto conlleva riesgos operativos, así como el riesgo de reintroducir células malignas. Sin embargo, incluso si se utiliza este método, los avances de la espermatogénesis in vitro permitirían la expansión de la muestra y la observación para garantizar mejor la calidad y la cantidad de tejido del injerto. [4]
En aquellos con SSC sanos o preservados pero sin un entorno celular que los respalde, la espermatogénesis in vitro podría usarse después del trasplante de los SSC en tejido de donantes sanos. [4]
Otro grupo que podría ser ayudado por la espermatogénesis in vitro son aquellos con cualquier forma de impedimento genético para la producción de esperma. Aquellos que no tienen un desarrollo de SSC viable son un objetivo obvio, pero también aquellos con niveles variables de detención espermatogénica; Anteriormente, sus células germinales subdesarrolladas se habían inyectado en los ovocitos, sin embargo, esto tiene una tasa de éxito de solo el 3% en humanos. [4]
Finalmente, la espermatogénesis in vitro usando células animales o humanas se puede usar para evaluar los efectos y la toxicidad de las drogas antes de las pruebas in vivo .
No hay comentarios:
Publicar un comentario