El primer caso de virus de inmunodeficiencia humana ( VIH ) se informó en los Estados Unidos a principios de los años ochenta. Se han descubierto muchos medicamentos para tratar la enfermedad, pero las mutaciones en el virus y la resistencia a los medicamentos dificultan el desarrollo. La integrasa es una enzima viral que integra el ADN retroviral en el genoma de la célula huésped . Los inhibidores de la integrasa son una nueva clase de medicamentos utilizados en el tratamiento del VIH. El primer inhibidor de la integrasa, el raltegravir , se aprobó en 2007 y otros medicamentos estaban en ensayos clínicos en 2011.
Historia [ editar ]
El cuerpo utiliza su sistema inmunológico para protegerse de las bacterias, virus y otros seres que causan enfermedades, y cuando no lo hace, se producen enfermedades de inmunodeficiencia. Una de esas enfermedades es el síndrome de inmunodeficiencia adquirida ( SIDA ), que suele ser el resultado de una infección por el virus de la inmunodeficiencia humana (VIH). [1] Se han identificado dos tipos de VIH estrechamente relacionados, el VIH-1 y el VIH-2 . Si bien el VIH-2 se está propagando en la India y África occidental, el VIH-1 es más virulento y la principal causa de SIDA en todo el mundo. Aunque algunos de los pacientes tienen resultados diferentes en la mayoría de los casos, las personas infectadas con VIH desarrollan SIDA y finalmente mueren de infecciones oportunistaso cáncer . La integración en el genoma retroviral es fundamental para la expresión génica y la replicación viral . El genoma viral se transcribe a la inversa en el ADN de la célula infectada por la transcriptasa inversa viral , y luego el ADN se integra en los cromosomas de la célula huésped con la ayuda de la integrasa viral. Los transcritos de ARN se producen a partir de ADN viral integrado y sirven tanto como ARNm para dirigir la síntesis de proteínas virales como, más tarde, como genomas de ARN de las nuevas partículas virales. Las partículas virales se escapan de la célula brotando de la membrana plasmática, cada una encerrada en una envoltura de membrana . [2] En este proceso, la integrasa del VIH-1 es esencial y, por lo tanto, un objetivo muy prometedor para el diseño de fármacos contra el SIDA. El diseño selectivo de medicamentos es una posibilidad ya que la integrasa del VIH-1 no tiene un equivalente celular conocido. [3] Se han descubierto y diseñado muchos inhibidores de la integrasa, pero solo unas pocas de las moléculas se desarrollaron aún más y llegaron hasta la fase II o la fase III de los ensayos clínicos . Raltegravir (nombre de marca Isentress) recibió la aprobación acelerada de la Administración de Drogas y Alimentos (FDA) de EE. UU . En octubre de 2007 y de EMEA (ahora EMA ) en diciembre de 2007. [4] [5] Se comercializó como un medicamento antirretroviral(ARV) para adultos infectados con VIH-1 que ya habían estado expuestos a un mínimo de tres clases de ARV y mostraron resistencia a múltiples medicamentos. En general hay dos grupos principales de inhibidores de la integrasa; Inhibidores de transferencia de hebras de integrasa (INSTI) e inhibidores de enlace de integrasa (INBI). Los INSTI restringen la unión del complejo de preintegración ( PIC ) y el ADN del huésped y las INBI restringen la unión de la integrasa y el ADN viral. Raltegravir es un inhibidor de la integrasa INSTI que inhibe la replicación del VIH-1 y del VIH-2. Es más potente que otros inhibidores de la integrasa conocidos anteriormente, además de causar menos efectos secundarios. Raltegravir, Elvitegravir, Dolutegravir y Bictegravir son los únicos inhibidores de la integrasa del VIH-1 que se usan para tratar las infecciones por VIH S / GSK1349572 . [4] [6] [7][8]
La enzima integrasa del VIH-1 [ editar ]
La integrasa del VIH-1 (IN) es una enzima clave en el mecanismo de replicación de los retrovirus. [9] Es responsable de la transferencia de ADN codificado de forma viral al cromosoma huésped, que es un evento necesario en la replicación retroviral. [10] Dado que IN no tiene equivalente en la célula huésped, los inhibidores de la integrasa tienen un alto índice terapéutico, ya que no interfieren con los procesos celulares normales. [11]
Estructura [ editar ]
IN pertenece, tanto mecánica como estructuralmente, a la superfamilia de polinucleotidil transferasas 10 y está compuesta por 288 aminoácidos que forman la proteína de 32 kDa. [9] Los retrovirus codifican sus enzimas (proteasa, transcriptasa inversa e integrasa) con el gen POL con el extremo 3 'que codifica para IN. [11]
IN se compone de 3 dominios funcionales estructuralmente independientes (ver figura 1) .: [9]
1. El dominio N-terminal (NTD) abarca los aminoácidos 1–50 y contiene dos residuos de histidina (His12 y His16) y dos residuos de cisteína (Cys40 y Cys43), todos los cuales están absolutamente conservados y forman un motivo HHCC de dedos de zinc. . [9] [12] Las mutaciones únicas de cualquiera de estos cuatro residuos reducen la actividad enzimática IN. [11] El zinc-finger motif HHCC quelatos un átomo de zinc por IN monómero . La NTD es necesaria para la formación de multímeros de orden superior, que parece ser su función principal. [12] [13] La multimerización requiere un átomo de zinc que estabilice el pliegue. [12]
2. El dominio central catalítico (CCD), que abarca los aminoácidos 51-22, contiene el sitio activo de IN pero no puede catalizar la integración en ausencia de NTD y CTD (el dominio C-terminal). [11] CCD contiene tres aminoácidos cargados negativamente absolutamente conservados; D64, D116 y E152. [9] Estos aminoácidos forman el motivo DDE que coordina los iones metálicos divalentes (Mg 2+ o Mn 2+ ). Estos iones metálicos son esenciales para la catálisis de la integración. [12] [13] El CCD tiene una estructura mixta β y α con cinco hojas β y seis hélices α unidas por bucles flexibles. [12]Los bucles flexibles permiten los cambios conformacionales que se requieren para el procesamiento en 3´ del ADN viral y las reacciones de transferencia de hebra (STF), que son dos pasos clave de la reacción de integración. [9] CCD es esencial para estos pasos y la sustitución de cualquiera de los residuos en el motivo DDE inhibe dramáticamente la actividad de IN. [12]
3. El dominio C-terminal (CTD), que abarca los aminoácidos 213–288, se une al ADN de manera no específica y su interacción con NTD y CCD es necesaria para el procesamiento de IN 3´ y las actividades de transferencia de hebra. [11] [12] CTD es el menos conservado de los tres dominios. [12] IN actúa como multímero y se requiere una dimerización para la etapa de procesamiento 3´, con IN tetramérica que cataliza la reacción de transferencia de la cadena.
Función [ editar ]
La integración del VIH-1 se produce a través de un proceso de varios pasos que incluye dos reacciones catalíticas: el procesamiento endonucleolítico 3´ de los extremos del ADN proviral (denominado proceso 3´) y la integración del ADN viral procesado 3´ en el ADN celular (denominado transferencia de cadena). [6] En 3´, el procesamiento IN se une a una secuencia corta localizada en cada extremo de la repetición terminal larga (LTR) del ADN viral y cataliza la división del endonucleótido. Esto resulta en la eliminación de un dinucleótido de cada uno de los extremos 3 'de la LTR. El ADN escindido se utiliza luego como un sustrato para la integración o transferencia de hebra. [9] La transferencia de hebra es una reacción de transesterificación que involucra un efecto nuleofílico directo .el ataque del grupo 3'hidroxi de los dos 3'-ADN virales recién procesados termina en el esqueleto fosfodiéster del ADN objetivo del huésped. [14] Esto conduce a la inserción covalente de ADN viral en el genoma de la célula infectada. La transferencia de la hebra se produce simultáneamente en ambos extremos de la molécula de ADN viral, con un desplazamiento de exactamente cinco pares de bases entre los dos puntos opuestos de inserción. [9] La reacción de integración se completa mediante la eliminación de los dinucleótidos no pareados de los extremos 5 ' del ADN viral, la reparación de las brechas de una sola hebra creadas entre las moléculas de ADN viral y objetivo y la ligación de los extremos 3' a 5'- Extremos del ADN huésped. [9] [14] Metales divalentes, Mg 2+ o Mn 2+, se requieren para el procesamiento en 3 'y los pasos de transferencia de hebra, así como para el ensamblaje de IN en el ADN del donante viral específico para formar un complejo que sea competente para llevar a cabo cualquiera de las funciones. Debido a que la abundancia de magnesio (Mg 2+ ) versus manganeso (Mn 2+ ) en las células humanas es 1,000,000, el magnesio parece ser un cofactor divalente más fácilmente disponible para la integración. [6]
Mecanismo de acción [ editar ]
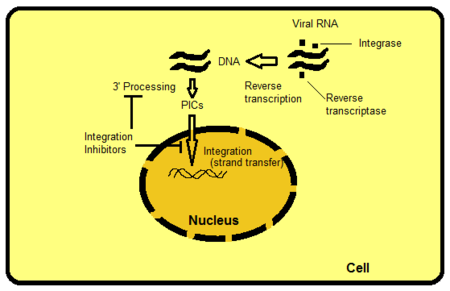
Hay varias formas de apuntar a la integrasa, pero la inhibición de la transferencia de cadenas es la más intuitiva y fácil de conseguir hasta la fecha. Otros objetivos incluyen, por ejemplo, los dominios de proteínas más allá del sitio activo de IN. Los dominios interactúan con el ADN viral o del huésped y son importantes para unirse a la enzima. Es posible obstaculizar las funciones de la enzima interrumpiendo o eliminando estos enlaces. El PIC es una estructura de proteína multimérica dentro de la célula hospedadora, compuesta de proteínas virales y hospedadoras. La integrasa es una parte del componente viral de PIC. Se cree que las proteínas víricas y del huésped de PIC modulan la actividad intrínseca de la enzima, el PIC lanzadera al núcleo y la integración directa del ADN viral en una región transcripcionalmente activa del genoma del huésped. Si fuera posible excluir ciertas proteínas del PIC, bloquearía la capacidad del virus para integrarse en el genoma del huésped. El proceso donde el ARN retroviral se transcribe a ADN y luego se integra en el genoma de la célula huésped se muestra en la figura 2.[8]
Inhibidores de transferencia de cadena (INSTIs) [ editar ]
Mg 2+ y Mn 2+ son cofactores críticos en la fase de integración. La inactivación de estos cofactores (por ejemplo, a través de la quelación) causa un deterioro funcional de la IN. Este concepto brinda a los investigadores la oportunidad de diseñar y desarrollar inhibidores de IN altamente eficientes (INI). De hecho, todas las INI de VIH-1 de molécula pequeña que se están investigando ahora contienen un motivo estructural que coordina los dos iones de magnesio divalentes en el sitio activo de la enzima. [6]
Raltegravir y elvitegravir comparten el mismo mecanismo de acción contra la integrasa: para unirse al sitio activo de los iones Mg 2+ . [8] Los inhibidores competitivos compiten directamente con el ADN viral para unirse a la integrasa para inhibir el procesamiento del extremo 3 '. [15] Al hacer esto, los inhibidores bloquean completamente el sitio activo para que no se una al ADN objetivo. Esta inhibición se llama inhibición de transferencia de cadena . [8]
Inhibición de la interacción LEDGF / p75- integrasa [ editar ]
El factor de crecimiento derivado del epitelio de la lente ( LEDGF / p75 ) es una proteína huésped que se une a la integrasa y es crucial para la replicación viral. El mecanismo de acción no se conoce con precisión, pero la evidencia sugiere que LEDGF / p75 guía a la integrasa para que inserte ADN viral en los sitios transcripcionalmente activos del genoma del huésped. Los inhibidores de esta proteína ya están siendo desarrollados y patentados. Es probable que sean altamente específicos para el objetivo y menos propensos al desarrollo de resistencia. [8]
Inhibidores de unión [ editar ]
Otra clase de INI podría ser los inhibidores de unión a IN (INBI), como el V-165. El V-165 es un compuesto que inhibe la integración pero sin efecto obvio en la síntesis de ADN viral. Cuando se estudió el mecanismo de acción, mostró que el V-165 interfiere con la formación del complejo viral de ADN-IN. Debido a su acción de interferencia, se clasifica como un inhibidor de unión IN. Otros compuestos, como las estirilquinolinas, comparten un mecanismo similar al competir con el sustrato LTR por la unión a IN. [dieciséis]
El diseño de fármacos [ editar ]
Encuadernación [ editar ]
Los INSTI se unen estrechamente y específicamente a la IN que está asociada con los extremos del ADN al quelar los iones metálicos divalentes (Mg 2+ ) que están coordinados por la tríada catalítica, es decir, el motivo DDE. [9] El motivo DDE se encuentra en el CCD de IN y es el sitio activo de la enzima y, por lo tanto, los INSTI se denominan inhibidores del sitio activo. Los INSTI se unen a un sitio específico cercano al motivo DDE de IN, un sitio que está presente solo en la conformación que ocurre después de que termina el procesamiento del ADN viral 3´. El ADN viral bien puede formar parte del sitio de unión del inhibidor. La unión es una forma de inhibición alostérica, ya que implica el bloqueo de un complejo específico de ADN integrasa-viral. [12]Esto da como resultado una inhibición selectiva de la reacción de transferencia de cadena, sin efecto significativo en la reacción de procesamiento 3´. [9] Por lo tanto, los INSTI pueden ser más específicos y unirse selectivamente al sitio de unión al ADN objetivo y, por lo tanto, ser menos tóxicos que los inhibidores bifuncionales que pueden unirse tanto al sitio de unión del donante como al objetivo. [12]
Los INBI también se unen a IN pero el mecanismo de acción es desconocido, por lo que no se puede detallar el enlace. [dieciséis]
Relación estructura actividad (SAR) [ editar ]
Se necesitan dos componentes estructurales para la unión de la integrasa: un resto bencilo hidrófobo que entierra en una bolsa altamente hidrófoba cerca del sitio activo; y la tríada quelante que se une con dos iones Mg 2+ en una región bastante hidrófila , anclando el inhibidor a la superficie de la proteína (ver figura 3). [17] De hecho, todos los inhibidores potentes de la integrasa poseen un componente de bencilo sustituido que es crítico para mantener la potencia de unión del extremo 3 '. La eliminación del grupo bencilo evita la función inhibitoria. [15] Por lo tanto, los sustituyentes lipofílicos son beneficiosos para la inhibición de la transferencia de la cadena, en particular el tiofenilo , el furanilo. y sustituciones (tiofen-2-il) fenilo. La amina heteroaromática y la amida también causan un aumento en la acción inhibitoria del procesamiento en 3 '. [6]
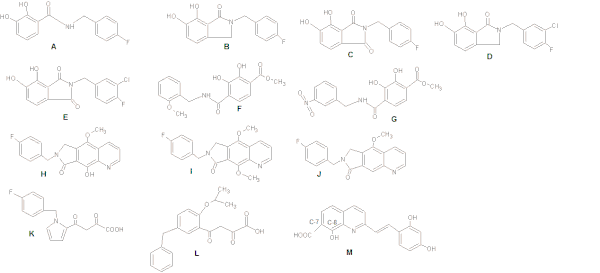
Cuando se investigaron los inhibidores de IN basados en catecol, se observó que mantener una relación plana con el anillo arilo bis-hidroxilado aumenta la potencia. La actividad inhibitoria podría optimizarse aún más mediante la inclusión de un sustituyente meta-cloro, mejorando la interacción del grupo bencilo con la bolsa hidrófoba adyacente (ver figura 4: Estructuras AG). [8]
Un grupo hidroxilo sustituido con bencilo (fig. 4 H) mejora la capacidad de quelación del metal (en comparación con la estructura J en la fig. 4) mientras que un grupo metoxi (I) es mucho menos potente debido al choque estérico por el grupo metilo adicional con los metales catalíticos . [15]
Cuando se investigan derivados de diceto , el anillo central de pirrol de la estructura K en la fig. 4 fue reemplazado por una serie de sistemas aromáticos que tenían varios patrones de sustitución. Eso proporcionó una orientación relativa óptima de la cadena de sitios bencilo y dicetoácido (DKA). Estructura L en fig. 4 dieron como resultado un aumento de 100 veces en la potencia. [18]
Benard et al (2004) sintetizaron INI con una subunidad de quinolina y un anillo aromático auxiliar unidos por espaciadores funcionalizados, tales como amida, hidrazida , urea y grupo hidroxiprop1-en-3-ona. Encontraron que el grupo amida que contenía dervados era el más prometedor. [18] [19] Al sintetizar series de estirilquinonas, los investigadores descubrieron que un grupo carboxilo en C-7, un grupo hidroxilo en C-8 en la subunidad de quinolina y un anillo de fenilo auxiliar (Figura 4: Estructura M) son necesarios para la inhibición, Aunque se toleran alteraciones del anillo. También se requieren dos grupos hidroxilo en el anillo fenilo auxiliar para la potencia inhibitoria. [18]
Farmacóforo [ editar ]
Dado que la información de la estructura crítica es escasa en la catálisis de la integrasa del VIH, es difícil encontrar el farmacóforo exacto para su inhibición. Wang et al (2010) esperaban que al estudiar el SAR y el farmacóforo de un andamio con doble inhibidor, enfocando tanto la integrasa como la transcriptasa inversa (RT), sería posible observar la actividad anti-integrasa. Al estudiar el SAR de los inhibidores de la integrasa del VIH, fue posible encontrar que para una inhibición óptima de la integrasa, el farmacóforo requiere una DKA regioespecífica (N-1) de una longitud específica. Una funcionalidad DKA o su bioisétero heterocíclico que inhibe selectivamente la transferencia de la hebra parece estar presente en todos los principales quimiotipos de los inhibidores de la integrasa. [17]Como se detalla en el análisis SAR anterior, los dos componentes estructurales necesarios del INI son un resto hidrófobo bencilo y una tríada quelante para unir los iones Mg 2+ . Para que la tríada se adhiera a los iones Mg 2+ se debe ionizar (ver fig. 5) y, por lo tanto, también se debe ionizar un bioóseo farmacóforo, y el bióbilo farmacóforo bioiso debe ser muy hidrófobo. [11] [17]
Sin embargo, a pesar del éxito anterior en el desarrollo clínico (raltegravir), falta un modelo de unión detallado, por lo que ha resultado difícil estructurar el diseño de los inhibidores de la integrasa. Cuando el farmacóforo del ácido salicílico y el catecol se fusionaron, se crearon nuevos andamios químicos. Los grupos hidroxilo y carboxílico adyacentes en el ácido salicílico podrían unirse con los iones metálicos y servir como su farmacóforo. Los inhibidores aromáticos polihidroxilados son en su mayoría activos contra las reacciones de transferencia de cadenas y el procesamiento 3 ', lo que sugiere un mecanismo que se dirige a ambos pasos. Esta es una parte muy importante del compuesto, ya que se puede usar para unirse al metal divalente en el sitio activo de IN y, como tal, es eficaz contra las cepas virales que son resistentes a los inhibidores específicos de la transferencia de cadenas. [6] [17]
Resistencia [ editar ]
Se ha descubierto que más de 60 variaciones de mutaciones INSTI causan resistencia in vivo e in vitro . Debido a estas mutaciones y al desarrollo de resistencia, los inhibidores son menos efectivos contra el virus. [9] Laresistencia de INI corresponde a las de otros medicamentos ARV. La primera resistencia de IN es causada por mutaciones primarias que disminuyen la sensibilidad de INI en combinación con mutaciones secundarias que reducen aún más la sensibilidad del virus y / o reparan la disminución de la condición física del virus. En segundo lugar, existe una barrera genética contra la resistencia al INI, definida por el número de mutaciones necesarias para la pérdida de la actividad clínica del INI. En tercer lugar, existe una resistencia cruzada extensa pero incompleta entre los INI. [13] Un bucle que contiene los residuos de aminoácidos 140-149 está ubicado en el dominio del núcleo catalítico y es importante para la función IN como se mencionó anteriormente. Este bucle es flexible y, aunque su papel no es del todo conocido, se cree que es importante y sus funciones son críticas para la unión del ADN. Esta resistencia aparece dentro de las mutaciones en esta región de codificación IN. [9] La resistencia al raltegravir y elvitegravir se debe principalmente a las mismas dos vías de mutación, pero también están involucradas otras mutaciones primarias para cada uno de los fármacos. [10] Algunas mutaciones aumentan la resistencia a los fármacos en gran medida que otras. Por ejemplo, una de las vías de mutación más comunes aumenta la resistencia a raltegravir hasta 100 veces más que la segunda más común. [9] La resistencia al inhibidor de la integrasa S / GSK1349572 aún se está desarrollando y la resistencia no se ha caracterizado completamente. Cuando se evaluó junto con las mutaciones primarias de raltegravir y elvitegravir, no mostró resistencia cruzada, lo que significa que podría ser útil contra virus resistentes a los medicamentos. [7] Elraltegravir tiene una absorción intestinal limitada y, por lo tanto, la resistencia no se puede superar prescribiendo dosis más altas. Los medicamentos más nuevos están garantizados para superar esta desventaja farmacológica y obtener concentraciones en plasma lo suficientemente altas como para atacar a los virus resistentes al raltegravir. [7]
Estado actual [ editar ]
La búsqueda de nuevas formas de mejorar el tratamiento de pacientes infectados con VIH es constante. Teniendo en cuenta la experiencia acumulada desde la década de 1980 de la llegada de INSTI al desarrollo de medicamentos ARV como una nueva y potente clase de ARV, marca una nueva era en el tratamiento del VIH. El desarrollo de un tratamiento exitoso de INSTI se logró cuando Merck Sharp & Dohme Limited descubrió el raltegravir. [12]La Comisión Europea autorizó una autorización de comercialización condicional en diciembre de 2007, que era válida en toda la Unión Europea . [20] En 2009, esta autorización se convirtió en una autorización de comercialización completa.y en el mismo año, la FDA cambió la aprobación de acelerada a la aprobación tradicional e incluyó al medicamento como agente de tratamiento antirretroviral de primera línea. [12] [21] El segundo medicamento INSTI, elvitegravir, fue identificado por Japan Tobacco y los ensayos clínicos comenzaron en 2005. En 2011, el medicamento aún estaba en la fase tres ensayos clínicos, donde se está comparando con el raltegravir, en sujetos con tratamiento y También se encuentra en la fase dos de desarrollo en sujetos ingenuos como parte de un tratamiento con múltiples fármacos. [12] S / GSK1349572 es un inhibidor de la integrasa descubierto por ViiV / Shinongi que ingresó a la fase tres en ensayos clínicos en 2011. Este nuevo medicamento es prometedor y parece ser bien tolerado y hasta el momento muestra mejores resultados que raltegravir y elvitegravir. [22]
Dado que ha habido problemas con la resistencia al raltegravir y elvitegravir, los científicos han comenzado a trabajar en los nuevos inhibidores de la integrasa de segunda generación, como el MK-2048, que en 2009 fue desarrollado por Merck. Es un prototipo de segunda generación de INSTI que permanece potente contra los virus que contienen mutaciones contra raltegravir y elvitegravir. El mecanismo de acción y SAR de MK-2048 es el mismo que el de otros INSTI, la estructura de MK-2048 que se muestra en la figura 6 con el farmacóforo esencial resaltado. [23] [24]
A pesar de que los medicamentos discutidos anteriormente son prometedores, el desarrollo tiene un largo camino por recorrer y muchas cosas aún se desconocen sobre la eficacia, la seguridad y el mecanismo de acción de estos medicamentos.




No hay comentarios:
Publicar un comentario