Las cefalosporinas son una amplia clase de antibióticos bactericidas que incluyen el anillo β-lactámico y comparten una similitud estructural y un mecanismo de acción con otros antibióticos β-lactámicos (por ejemplo , penicilinas , carbapenems y monobactamas ). [1] Las cefalosporinas (y otros β-lactámicos) tienen la capacidad de matar bacterias mediante la inhibición de pasos esenciales en la síntesis de la pared celular bacteriana, lo que al final resulta en la lisis osmótica y la muerte de la célula bacteriana. [2] Las cefalosporinas son antibióticos ampliamente utilizados debido a su eficacia clínica y perfil de seguridad deseable. [3]
Las cefalosporinas son diversas en su espectro antibacteriano , solubilidad en agua , tolerabilidad al ácido, biodisponibilidad oral , vida media biológica y otras propiedades. Por lo tanto, las cefalosporinas se pueden clasificar en generaciones dependiendo de la actividad antibacteriana , el tiempo de la invención y la base estructural.
Estructura básica de las cefalosporinas [ editar ]
El núcleo de la molécula de cefalosporina básica consiste en un sistema de dos anillos que incluye un anillo de β-lactama condensado con un anillo de dihidrotiazina. El núcleo en sí también puede ser referido como ácido 7-aminocefalosporánico que se puede derivar por hidrólisis del compuesto natural cefalosporina C . Los compuestos químicos que contienen este núcleo son relativamente estables a la hidrólisis ácida y la tolerancia a las β-lactamasas . La cefalosporina C contiene una cadena lateral que se deriva del ácido D-aminoadípico. Modificación de cadenas laterales.en las posiciones relevantes se ha utilizado para crear una nueva clase de antibióticos de cefalosporina. La modificación de las cadenas laterales en la posición 7 del anillo de lactama parece afectar la actividad antibacteriana, mientras que la posición 3 del anillo de dihidrotiazina altera las propiedades farmacocinéticas y la afinidad de unión al receptor. [4] [5]
Historia [ editar ]
Descubrimiento [ editar ]
Los primeros compuestos químicos del grupo de cefalosporinas se aislaron de Cephalosporium acremonium , un hongo productor de cefalosporinas descubierto por [[]] en 1948 en un desagüe de aguas residuales de la costa de Cerdeña . [1] De los filtrados crudos del cultivo de Cephalosporium acremonium , los científicos obtuvieron una nueva actividad antibacteriana. Se observó que el filtrado crudo podría inhibir el crecimiento de Staphylococcus aureus . [3]
Investigación [ editar ]
Las investigaciones adicionales realizadas por sir Edward Abraham y Guy Newton se realizaron en Inglaterra y el aislamiento de los fluidos de cultivo del hongo sardo produjo cefalosporina P, N y C. Estos compuestos naturales no fueron lo suficientemente potentes para usarlos como agentes antimicrobianos, pero sí con métodos químicos y la eliminación de la cadena lateral natural fue posible producir ácido 7-aminocefalosporánico ( 7-ACA ) que podría encajar aún más con cadenas laterales no naturales. 7-ACA es análogo al ácido 6-aminopenicilánico ( 6-APA ), un bloque de partida para hacer varios derivados de penicilinas. [1]
En 1959, Abraham informó que su derivado N-fenilacetilo de la cefalosporina C era mucho más potente contra las cepas de Staphylococcus aureus que el compuesto original. Este derivado se denominó más tarde Cephaloram, un análogo de la cefalosporina de la bencilpenicilina .
Eli Lilly desarrolló un método para producir 7-ACA basado en la escisión de la cadena lateral de α-aminoadipoilo de la cefalosporina C. [6] El trabajo adicional de Robert Morin condujo a la semisíntesis de 3-deacetoxi-7-ACA (7-ADCA) de penicilinas que es conveniente porque las penicilinas se pueden fermentar con más facilidad que las cefalosporinas. Por ejemplo, el 7-ADCA se puede semisintetizar en siete etapas de reacción química a partir de la fenoximetilpenicilina . [1]
Resultados [ editar ]
Cephalothin , una cefalosporina de primera generación para uso parenteral, fue la primera cefalosporina disponible para pacientes en los EE. UU. En 1964. Se eligió para ensayos clínicos de series de derivados de 7-ACA preparados en Eli Lilly . [7] La segunda cefalosporina para uso parenteral estuvo disponible poco después y se comercializó en los EE. UU. Con el nombre de cefaloridina . El éxito clínico de estas dos cefalosporinas instó a los investigadores a mejorar las propiedades farmacológicas y desarrollar más agentes. [8] [9]Hoy nos quedamos con miles de análogos semisintetizados de compuestos naturales de cefalosporina basados en el conocimiento adquirido por la investigación intensiva sobre la química de esos dos materiales de partida. [1]
Mecanismo de acción [ editar ]
Los efectos bactericidas de los antibióticos β-lactámicos se logran mediante la inhibición de la síntesis de la pared celular bacteriana. La pared celular de ambos gram-positivas y gram-negativas bacterias es un apretado unida covalentemente y reticulado peptidoglicano red y esencial para el crecimiento bacteriano , la división celular y la estructura celular. Por lo tanto, las bacterias necesitan enzimas que puedan romper la pared celular durante el crecimiento bacteriano y la división celular. La pared celular de las bacterias se construye en dos pasos desde el exterior de la célula. En el primer paso, las moléculas de unidades de disacáridos se unieron con péptidos.en sus extremos se transportan desde el citoplasma de las bacterias y se unen en la parte exterior de la pared por un transglicosa . En el segundo paso, una transpeptidasa une cadenas largas de polisacáridos que se unen entre sí mediante enlaces peptídicos . La secuencia de aminoácidos de D-alanil-D-alanina es reconocida por la transpeptidasa al final de la cadena peptídica. La enzima separa la alanina en el extremo terminal y une el resto a una cadena peptídica de un polisacárido adyacente. [10]Esta reacción de transpeptidación es inhibida por los antibióticos β-lactámicos como las cefalosporinas. Debido a esta inhibición, los antibióticos son más efectivos cuando las bacterias se encuentran en la fase logarítmica de crecimiento, y luego sintetizan la pared celular. Si las bacterias están en la fase estacionaria de crecimiento, entonces no hay sintetización de la pared en progreso y los antibióticos tienen un efecto mucho menor. [3]
Aunque no se conoce completamente el mecanismo de acción de los antibióticos β-lactámicos, se cree que ejercen su mecanismo de acción imitando la estructura del estado de transición de la reacción química cuando la transpeptidasa está unida a la secuencia D-alanil-D-alanina. . [10]Estas proteínas a menudo se denominan proteínas de unión a la penicilina (PBP). La apertura del anillo de β-lactama por un residuo de serina en el sitio de unión a la enzima conduce a la unión covalente de la molécula deantibiótico con el sitio activo de la enzima. El resultado es un complejo enzimático inactivo unido de forma irreversible que es incapaz de una mayor síntesis de la pared celular y la célula morirá por lisis osmótica. [2] [10] [11]
El diseño de fármacos [ editar ]
Relación estructura actividad [ editar ]
La estructura molecular de la cefalosporina se puede alterar de varias maneras para mejorar la estabilidad in vitro , la actividad antibacteriana y la resistencia contra las β-lactamasas. En las condiciones ácidas del estómago, la estabilidad in vitro puede mejorarse mediante la adición de un amino y un hidrógeno a las posiciones α1 y α2 de la estructura de la cefalosporina. Esto da como resultado un compuesto básico, un ión amonio que está protonado en dichas condiciones, lo que nos da una β-lactama más estable que conduce a un fármaco activo por vía oral. La actividad antibacteriana puede mejorarse si A2 es un grupo alcoxiEn lugar de un hidrógeno. El grupo 7-amino es crucial para la actividad antibacteriana. En algunos casos, al agregar un grupo metoxi en la posición A2, la estabilidad de las cefalosporinas aumenta hacia las β-lactamasas. En la posición A1, se pueden colocar azufre y oxígeno en el anillo. El azufre muestra una mejor actividad antibacteriana, pero el oxígeno muestra una mejor estabilidad hacia las β-lactamasas. En la posición C6, el hidrógeno es crucial para la actividad biológica. En la posición A3, la actividad antibacteriana es mayor cuando A3 es un heterociclo de 5 miembros en lugar de uno de 6 miembros. En la posición α1 y α2, el isómero L es 30–40 veces más estable hacia la β-lactamasa que el isómero D. La estabilidad hacia la β-lactamasa se puede aumentar alrededor de 100 veces con la adición demetoxioxima . La Z-oxima es casi 20,000 veces más estable que la E-Oxima. [1]
Sitio de encuadernación [ editar ]
Los avances en el campo de la ingeniería y la expresión de proteínas recombinantes , la purificación de proteínas, la RMN , la cristalografía de rayos X y la química computacional han mejorado las habilidades de los diseñadores de medicamentos para utilizar datos que se han recopilado en las estructuras tridimensionales de los complejos de ligandos de proteínas . [12]
La mayoría de las especies bacterianas tienen varios tipos de PBP que difieren de varias maneras, como la función enzimática, el peso molecular y la afinidad por los antibióticos β-lactámicos. Hay dos tipos de enzimas que son particularmente interesantes con respecto al sitio de unión de los β-lactámicos, PBP y β-lactamasas. Las alteraciones de la diana en el sitio de unión de la PBP han llevado a un alto nivel de resistencia de β-lactámicos entre bacterias como estafilococos , enterococos y neumococos . [13] Por ejemplo, el sitio de unión de PBP2 en Neisseria gonorrhoeae se ha determinado estructuralmente y tiene tres motivos de secuencia que se puede ver en casi todas las enzimas que interactúan con β-lactama.
- El motivo SXXK está ubicado en el extremo N-terminal de la hélice α2 e incluye dos residuos que son importantes para la función enzimática.
- Ser-310: incluye un nucleófilo de serina que es acilado tanto por el sustrato peptídico como por los antibióticos β-lactámicos.
- Lys-313: juega un papel importante en el suministro de la red unida al hidrógeno denso en el sitio activo y se encuentra a una distancia de Ser 310, ASN-364 y el esqueleto carbonilo de Ser-362.
- Motivo SXN que incluye Ser-362, Ser-363 y Asn-364.
- Motivo KTG que incluye Lys-497, Thr-498 y Gly-499
La investigación también implica que las regiones adyacentes al sitio activo que difieren entre diferentes PBP tienen una influencia significativa en la velocidad de la tasa de acilación de β-lactama. [14]
La resistencia antimicrobiana [ editar ]
La resistencia bacteriana a los compuestos de cefalosporina puede tener lugar por tres mecanismos.
- Modificaciones en destino PBP
- Inactivación de medicamentos por β-lactamasas bacterianas
- El fármaco no puede alcanzar la PBP objetivo en la célula bacteriana
Las cefalosporinas deben pasar a través de la pared celular bacteriana para alcanzar el PBP objetivo. En comparación, es más fácil penetrar en la pared celular de las bacterias grampositivas que en la pared celular de las bacterias gramnegativas. La estructura de la pared celular de las bacterias grampositivas se compone de forma rutinaria con peptidoglicano que permite el paso de moléculas del tamaño de cefalosporina. La estructura de la pared celular de las bacterias gramnegativas es más compleja, está compuesta de polisacáridos, lípidos y proteínas y es más difícil de penetrar. Las partículas pasan a través de la membrana externa a través de canales llenos de agua, o porinas , que son proteínas de membrana trans. [15] Durante la exposición a cefalosporinas, las bacterias pueden formar resistencia por sí mismas o como selección de la próxima generación de bacterias después de reproducirse, pormutación . [16] Las especies de bacterias como el neumococo y el meningococopueden adquirir material genético exógeno e incorporarlo en sus propios cromosomas, lo que conduce a la resistencia a los antimicrobianos. [17] De esa manera, se puede alterar la PBP objetivo para que disminuya su atracción por las cefalosporinas y otros antibióticos β-lactámicos. [18] [19] Las bacterias también pueden reemplazar el PBP que es vulnerable a los antibióticos Beta-lactámicos con un PBP que es menos vulnerable. [20] Los antibióticos β-lactámicos pueden ser inactivados por muchos tipos de β-lactamasas, que son producidos por las bacterias. Las enzimas hidrolizan el enlace entre el átomo de carbono y nitrógeno del anillo de β-lactama. Hay muchas betalactamasas que varían en la especificidad del sustrato y en el rango del huésped. [21] [22] El sitio activo de las enzimas se regenera fácilmente hidrolíticamente, por lo que es reutilizable muchas veces, de esta manera puede una cantidad comparativamente pequeña de betalactamasas destruir una gran cantidad de fármaco. Las bacterias grampositivas, como los estafilococos, tienen una alta liberación de beta-lactamasas en su espacio extracelular, donde se encuentran con el medicamento fuera de la pared celular. Por otro lado, las bacterias gramnegativas siguen un curso más conservador. Secretan sus betalactamasas en el espacio periplásmico.entre la membrana interna y externa para que no puedan escapar fácilmente al espacio extracelular y no tengan que ser biosintetizados en grandes cantidades. [1]
Desarrollo de fármacos [ editar ]
Esta sección revisará el desarrollo de medicamentos de una generación a la siguiente, con énfasis en las diferencias estructurales entre las generaciones. El sistema de clasificación de la generación se basa en dividir las cefalosporinas por sus propiedades químicas y su actividad relativa contra las bacterias gramnegativas frente a las grampositivas. [5] [14]. Desde la primera generación de cefalosporinas hasta la tercera generación, hay un desarrollo de ser más efectivo contra las bacterias grampositivas a ser más efectivo contra las bacterias gramnegativas y menos efectivo contra las bacterias grampositivas respectivamente. Sin embargo, la actividad vuelve a una eficacia equilibrada contra las bacterias gramnegativas y grampositivas en la cuarta generación. [23]
Clasificación de las cefalosporinas [ editar ]
La clase de cefalosporinas es muy extensa, por lo que es necesario un buen sistema de clasificación para distinguir las diferentes cefalosporinas entre sí. Existen pocas características químicas y de actividad que podrían usarse para la clasificación, por ejemplo, la estructura química, las propiedades de la cadena lateral, la farmacocinética, el espectro de actividad o las propiedades clínicas . A pesar de estas características variables, el sistema de clasificación más común para las cefalosporinas es dividirlas en generaciones. El sistema de generación se basa en diferentes actividades antimicrobianas mostradas por diferentes cefalosporinas. [3] [4] [24]
Cefalosporinas de primera generación [ editar ]
Las cefalosporinas de primera generación fueron las primeras cefalosporinas en el mercado. Tienen una buena actividad antimicrobiana contra las bacterias grampositivas pero una actividad limitada contra las especies gramnegativas. [25] Las estructuras químicas de las cefalosporinas de primera generación son bastante simples. Como un ejemplo tres fármacos de esta clase ( cefalexina , cefradina y cefadroxilo ) todos tienen un único grupo metilo en la posición C-3. Los grupos laterales comunes en C-3 para cefalosporinas de primera clase son pequeños grupos no cargados como el metilo. [5] El grupo metilo en la posición C-3 proporciona una baja afinidad por la PBP común que puede explicar en parte la actividad relativamente baja de estos primeros fármacos. Cefaclorsin embargo, tiene un grupo Cl en la posición C-3 que le otorga una mejor unión a la PBP y, por lo tanto, una mejor actividad antimicrobiana. No existe un acuerdo sobre la clasificación de Cefaclor como una cefalosporina de primera generación debido al grupo Cl en la posición C-3 y, por lo tanto, a su actividad mejorada, pero a menudo se clasifica como tal debido a su cadena lateral C-7 que está más relacionada con La primera generación que la segunda. Todas las cefalosporinas de la primera generación tienen un grupo α-amino en la posición C-7. Esta estructura los hace vulnerables a la hidrólisis por las β-lactamasas. [5] [9]
Cefalosporinas de segunda generación [ editar ]
Las cefalosporinas tempranas de segunda generación son muy similares en estructura básica a la primera generación. Sin embargo, Loracarbefno tiene el anillo de dihidrotiazina normal, pero es un carbacefema que tiene un átomo de carbono en el anillo en lugar de un átomo de azufre, lo que lo convierte en un anillo de tetrahidropiridina. Esta propiedad química le da a Loracarbef una mejor estabilidad en plasma al tiempo que conserva las características de absorción oral y la afinidad para unirse a PBP. El 7- fenil - glicinalo hace disponible por vía oral y el cloro en la posición C-3 lo hace tan activo como Cefaclor. Un cambio estructural importante en el desarrollo de cefalosporinas de segunda generación fue la introducción de un grupo α-iminometoxi en la cadena lateral C-7. Esto dio una mayor resistencia a las β-lactamasas debido al bloqueo estereoquímico del anillo beta-lactama. La cefuroxima fue la primera cefalosporina en incorporar esta cadena lateral. Otro grupo muy importante en la segunda generación es el anillo de aminotiazol a la cadena lateral C-3. Este desarrollo aumentó drásticamente la afinidad de unión a PBP y aumentó la actividad antimicrobiana. El anillo de aminotiazol se puede ver en la estructura de Cefotiam . [5] [9]
Cefalosporinas de tercera generación [ editar ]
La mayoría de las cefalosporinas de tercera generación tienen el grupo aminotiazol en la posición C-7. Diferentes grupos se encuentran en la posición 7-α como 7-α-iminohidroxi y 7-α-iminometoxi. Sin embargo, Ceftibuten posee un grupo 7-α-etilideno. Este grupo le da al ceftibuten una mayor resistencia a las β-lactamasas de espectro mejorado. Muchas de las cefalosporinas orales de tercera generación son ésteres de formas parenterales y se hidrolizan por esterasas en el tracto digestivo ( Cefteram- pivoxil). Algunos de los medicamentos de tercera generación pueden absorberse por vía oral sin necesidad de esterificación . Esto se hace, por ejemplo, con Cefixime y Cefdinir poniendo un grupo de vinilo.en la posición C-3. [5] [9]
Cefalosporinas de cuarta generación [ editar ]
Las cefalosporinas de cuarta generación tienen mayor actividad contra las bacterias gramnegativas que la segunda y tercera generación. Esta diferencia se atribuye a que son compuestos zwitterion iónicos dipolares . La cadena lateral C-7 es similar a las cefalosporinas de tercera generación que generalmente contienen un grupo iminometoxi aminotiazol o, en el caso de la cefclidina y una aminotiadiazol . Debido al nitrógeno cuaternario cargado positivamente en la cuarta generación de la cadena lateral C-3, las cefalosporinas pueden difundirse a través de la membrana bacteriana gramnegativa más fácilmente que las cefalosporinas anteriores. Se cree que la carga positiva orienta la molécula de fármaco a la entrada del canal de la porina. [26]
Cefalosporinas quinta generación [ editar ]
Actualmente solo hay dos medicamentos en esta categoría, Ceftobiprole y Ceftaroline . Estos nuevos medicamentos también son los únicos antibióticos β-lactámicos que son efectivos contra Staphylococcus-aureus resistente a la meticilina (SARM). El ceftobiprol es un pirrolidinona -3- ilidenemetil cefem. La cadena lateral C-3 fue diseñada específicamente para tener una fuerte afinidad de unión a PBP2a y PBP2x. Se sabe que PBP2a da resistencia a los estafilococos a otros medicamentos β-lactámicos y PBPx hace lo mismo con los neumococos . El ceftobiprol también tiene una cadena lateral de aminotiazoyilhidroxiimino en la posición C-7 que se sabe que da buena resistencia a la β-lactamasa de S. aureus. Juntos, estos grupos activos hacen que el ceftobiprol sea bactericida para MRSA. El ceftobiprol tiene poca solubilidad en agua y, por lo tanto, se administra por vía intravenosa como un profármaco éster llamado Ceftobiprol medocaril. Se descompone rápidamente en Ceftobiprol activo por esterasas de plasma. [27] La ceftarolina se desarrolló a partir de la cefalosporina de cuarta generación Cefozopran . Retiene el grupo alcoxiimino en la posición C-7 de las generaciones anteriores, por lo que es bastante estable en presencia de muchas lactamasas β. Desde MRSA y Streptococcus pneumoniaeresistente a la penicilinatienen resistencia dedicada a los nuevos tipos de PBP, PBP2a y PBP2x respectivamente, tanto Ceftaroline como Ceftobiprole tienen cadenas laterales C-3 especialmente diseñadas para unir estos nuevos PBP. En el caso de Ceftarolina, esta cadena lateral contiene un enlace espaciador de 2-tioazolitio optimizado para su actividad anti-MRSA. La ceftarolina tiene una baja solubilidad en agua, pero este problema se resolvió al unir un grupo N-fosfonoamino a la molécula que produce el profármaco intravenoso Ceftaroline fosamil. El profármaco se desfosforila en plasma para formar Ceftarolina activa. [28]
Estado actual [ editar ]
La resistencia a los antimicrobianos es la fuerza motriz para el desarrollo de nuevos agentes antimicrobianos. La complejidad y diversidad de los mecanismos de resistencia ha definido la necesidad de nuevos y mejorados antibióticos β-lactámicos. [29] Con su amplio espectro, las cefalosporinas dominan la quimioterapia β-lactama, aunque a menudo carecen de biodisponibilidad oral. [9]
El 29 de octubre de 2010, la Administración de Alimentos y Medicamentos (FDA) aprobó un nuevo agente de cefalosporina, ceftarolina . Teflaro (ceftaroline fosamil) es un profármaco antibiótico inyectable para el tratamiento de adultos con infecciones bacterianas agudas de la piel y la estructura de la piel (ABSSI) y neumonía bacteriana adquirida en la comunidad (CABP).







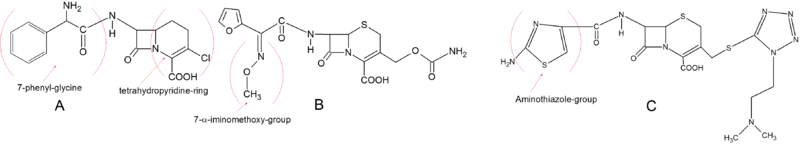




No hay comentarios:
Publicar un comentario