Este artículo trata sobre el descubrimiento y desarrollo de antiandrógenos o antagonistas del receptor de andrógenos (AR) .
En la década de 1960, se descubrió el primer antiandrógeno. Los antiandrógenos antagonizan el receptor de andrógenos (AR) y, por lo tanto, bloquean los efectos biológicos de la testosterona y la dihidrotestosterona(DHT). Los antiandrógenos son importantes para los hombres con enfermedades hormonalmente sensibles como el cáncer de próstata , la hiperplasia prostática benigna (BHP), el acné , la seborrea , el hirsutismo y la alopecia androgénica . Los antiandrógenos se utilizan principalmente para el tratamiento de enfermedades de la próstata. [1] [2] [3] La investigación de 2010 sugiere que las RA podrían estar relacionadas con la progresión de la enfermedad decáncer de mama triple negativo y carcinoma del conducto salival [4] y que los antiandrógenos pueden usarse potencialmente para tratarlo. [5] [6]
A partir de 2010, los antiandrógenos son moléculas pequeñas y pueden ser esteroideos o no esteroideos,dependiendo de la química del ligando . Los antiandrógenos esteroideos comparten una estructura esteroide similar, mientras que los antiandrógenos no esteroideos (NSAA) pueden tener farmacóforos estructuralmente distintivos . Solo un número limitado de compuestos están disponibles para uso clínico a pesar del hecho de que se ha descubierto e investigado una gran variedad de compuestos antiandrógenos.
Historia [ editar ]
A principios del siglo XX, se había establecido una relación entre la glándula pituitaria , los testículos y la próstata. El médico estadounidense Charles Brenton Huggins descubrió que la castración o la administración de estrógenos conducían a la atrofia glandular en los hombres, lo que podría revertirse con la re-administración de andrógenos. En 1941, Huggins trató a los pacientes con cáncer de próstata mediante la ablación de andrógenos, ya sea con castración o con terapia de estrógeno; el efecto beneficioso de la ablación de andrógenos en el cáncer de próstata metastásico se realizó, por lo que recibió el Premio Nobel de Fisiología o Medicina en 1966. [1]
Se hizo evidente que la ablación de andrógenos sola no era suficiente para curar a los pacientes con cáncer de próstata avanzado. A finales de la década de 1960, el receptor de andrógenos (AR) fue descubierto y caracterizado. La detección de bibliotecas químicas para los bloqueadores de AR condujo al descubrimiento del primer antiandrógeno, la ciproterona . Luego se agregó un grupo acetato a la ciproterona y se creó acetato de ciproterona . En la década de 1970, se descubrió la flutamida antiandrógeno . En 1989, la Administración de Drogas y Alimentos de los Estados Unidos (FDA) lo aprobó para utilizar el tratamiento del cáncer de próstata. En 1995, se aprobó bicalutamida , y nilutamida.seguido un año después. [1] [7]
Receptor de andrógenos [ editar ]
El AR pertenece a la subfamilia de receptores de esteroides de la superfamilia de receptores nucleares . Su función está regulada por la uniónde los andrógenos, que inicia cambios de conformación secuenciales del receptor que afectan las interacciones receptor- proteína y receptor-ADN. Los andrógenos endógenos son principalmente testosterona y DHT. [8] [9] [10] [11] La AR se expresa en células de una amplia gama de tejidos, en todo el cuerpo, más allá de los órganos sexuales primarios y secundarios. [12]
El gen AR tiene más de 90 kb de longitud y codifica una proteína de 919 aminoácidos . Sólo un gen AR se ha identificado en seres humanos que se encuentra en el cromosoma X . Comprende cuatro regiones principales, ver figura 1: [2] [3] [7] [8]
- Dominio N-terminal (NTD) que cumple una función modulatoria.
- Dominio de unión al ADN (DBD) que reconoce y se une a los elementos de respuesta de andrógenos (ARE) en la secuencia del gen diana.
- Dominio de unión al ligando (LBD) que es responsable del reconocimiento y la unión del ligando.
- Una pequeña región de bisagra entre el DBD y LBD.
Se han identificado dos funciones en AR que tienen funciones críticas en la regulación de la transactivación delgen objetivo , la función de activación N-terminal 1 (AF1) y la función de activación C-terminal 2 (AF2). AF1 es independiente del ligando y desempeña el papel principal en la transactivación del gen diana. El AF2 es un ligando dependiente y solo muestra una función limitada. [8] [10]
Mecanismo de acción [ editar ]
Sin consolidar, la AR se encuentra principalmente en el citoplasma , como un receptor de esteroides típico, y se asocia con un complejo de proteínas de choque térmico (HSP) a través de las interacciones con la LBD. Los andrógenos, ya sean agonistas o antagonistas, se colocan en la bolsa de unión al ligando (LBP) del AR citosólicoy se unen al LBD, vea la figura 2. El AR pasa por una serie de cambios conformacionales y el HSP se disocia del AR. La AR transformada sufre dimerización , fosforilación y translocación al núcleo. El receptor translocado luego se une a los elementos de respuesta de andrógenos (ARE) en el promotordel gen que responde al andrógeno, una secuencia de consenso localizada en sentido ascendente o descendente del sitio de inicio de la transcripción(TSS) de los genes diana AR. El reclutamiento de otros co-factores de transcripción (incluidos los coactivadores y los co-represores) y la maquinaria de transcripción general asegura además la transactivación de la expresión génica regulada por AR . Todos estos procesos complicados son iniciados por los cambios conformacionales inducidos por ligandos en la LBD. El reclutamiento específico de ligandos de los correguladores podría ser crucial para la actividad agonista o antagonista de los ligandos AR. La unión del ADN también es necesaria para la expresión génica regulada por AR, también conocida como función genómica clásica de AR. [7] [8] [10]
Desarrollo de antiandrógenos [ editar ]
La ciproterona es un antiandrógeno esteroideo que inhibe de forma competitiva la unión de la testosterona o DHT a la AR. La ciproterona se une a los AR que se expresan en las células cancerosas de la próstata, así como al AR que se expresa en el hipotálamo y la pituitaria. Por lo tanto, la ciproterona bloquea la retroalimentación negativa de los andrógenos a nivel hipotalámico-hipofisario, lo que conduce a un aumento de los niveles séricos de la hormona luteinizante (LH). Este aumento en los niveles de LH provoca un aumento en los niveles séricos de testosterona y, en última instancia, disminuye la capacidad de la ciproterona para competir por la unión de AR y bloquear la estimulación androgénica . [1] [7]
El acetato de ciproterona fue desarrollado para superar este problema. Se forma agregando un grupo acetato a la ciproterona, ver figura 3. El acetato de ciproterona tiene un modo de acción dual, ya que compite directamente con el DHT para unirse a la AR, pero también inhibe la secreción de gonadotropina . Por lo tanto, reduce los niveles de andrógenos, estrógenos y LH. [1] [7] El acetato de ciproterona actúa directamente como un antiandrógeno en las células cancerosas de la próstata y también funciona para disminuir indirectamente los niveles séricos de testosterona. Esto último causa las limitaciones del acetato de ciproterona, que son efectos centrales en la secreción de andrógenos, con la subsiguiente pérdida de la libido y la potencia sexual. Varios informes también afirman que el acetato de ciproterona causa hiperplasia hepática . Estaslos efectos secundariosdieron a las compañías farmacéuticas el incentivo para buscar NSAA "puras" alternativas que no tendrían estos efectos secundarios. [1] Los antiandrógenos puros bloquean el receptor de andrógenos sin ejercer ninguna actividad agonista o hormonal. [3]
La flutamida se convirtió en la primera NSAA en ser probada clínicamente. Posteriormente, se desarrollaron las nSAAs bicalutamida y nilutamida. Las supuestas ventajas de estos compuestos fueron que no afectaron la libido o la potencia como los otros compuestos de acción central en desarrollo, los agonistas de la hormona liberadora de hormona luteinizante (LHRH) y el acetato de ciproterona. Pero esta teoría no resultó ser cierta. Estas NSAA finalmente cruzaron la barrera hematoencefálica , como el acetato de ciproterona, lo que llevó a un aumento posterior en los niveles de testosterona en suero. [1]
Flutamida [ editar ]
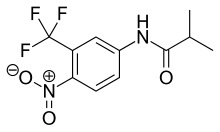
La flutamida es un análogo de arilpropionamida con propiedades antiandrogénicas puras, como se ve en la figura 4. Se absorbe completamente en el tracto gastrointestinal después de la administración oral y experimenta un metabolismo extenso de primer paso a su forma activa, 2-hidroxiflutamida, y producto de hidrólisis , 3-trifluorometil-4. -nitroanilina. [7] [9] [10] La hidroxiflutamida es un antagonista de AR más potente que la flutamida in vivo , con una mayor afinidad de unión por la AR. La hidroxiflutamida tiene una vida media de eliminación de aproximadamente 8 horas en humanos. La hidrólisis del enlace amidarepresenta la principal vía metabólicapara este metabolito activo . Al revertir el efecto estimulante de la DHT sobre el peso de la próstata ventral, la flutamida es aproximadamente 2 veces más potente que el acetato de ciproterona. La hidroxiflutamida tiene una afinidad de unión relativamente baja a la AR y, por lo tanto, generalmente se usa en dosis altas para lograr un bloqueo completo de la AR en la terapia. [9] [13]
Nilutamida [ editar ]
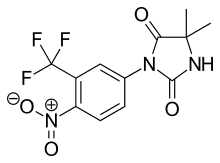
La nilutamida es un análogo de hidantoína nitroaromática de la flutamida, como se ve en la figura 5. [9] [10] La nilutamida se elimina exclusivamente por metabolismo, principalmente por la reducción del grupo nitro aromático . Aunque se identificó la hidrólisis de una de las funciones carbonilo de la imidazolindiona, es mucho menos susceptible al metabolismo hepático que el enlace amida en la hidroxiflutamida. Esto da como resultado una vida media más larga de nilutamida en humanos de 2 días. No obstante, el radical nitro aniónico formado durante la reducción de nitro aún podría estar asociado con la hepatotoxicidad en humanos, especialmente cuando se utiliza una dosis relativamente alta empleada para el bloqueo de andrógenos.[9] La nilutamida causa efectos secundarios que limitan su uso, comoneumonitis y adaptación tardía a la oscuridad. [7]
Bicalutamida [ editar ]
La bicalutamida es un análogo de la arilpropionamida, que se ve en la figura 6. [9] [10] Ha reemplazado a la flutamida y la nilutamida como el antiandrógeno de primera elección para el tratamiento del cáncer de próstata. La bicalutamida no es tan hepatotóxica como la flutamida y la nilutamida y tiene una vida media más larga, de 6 días en humanos, que permite la administración una vez al día en dosis más bajas. La bicalutamida comparte la estructura del enlace amida con la flutamida. Aun así, la hidrólisis del enlace amida se descubrió en ratas, no en humanos, lo que podría explicar la semivida prolongada de bicalutamida en humanos. [9]
La bicalutamida tiene un grupo ciano en la posición para en lugar de un grupo nitro como flutamida y nilutamida. Este cambio en los grupos evita la reducción de nitro observada en la nilutamida. La bicalutamida tiene un carbono quiral en su estructura (marcado con un asterisco en la figura 6), que está conectado a los grupos hidroxilo y metilo. Por lo tanto, se administra como un racemato . [9] La investigación posterior a la aprobación reveló que su actividad antiandrogénica reside casi por completo en el enantiómero (R) . La (R) -bicalutamida tiene una afinidad casi cuatro veces mayor para la próstata AR que la hidroxiflutamida y tiene un mejor perfil de efectos secundarios en comparación con otros antiandrógenos. [9] [10]
Estructura y relación de actividad [ editar ]
Antiandrógenos esteroideos [ editar ]
El acetato de ciproterona es un derivado de 6-cloro-1,2-metileno de 17α-acetoxiprogesterona. Muestra mayor actividad antiandrogénica junto con actividades androgénicas. El acetato de ciproterona muestra una alta afinidad por AR en ratas, que aumenta cuando el grupo 1,2-metileno se elimina del compuesto. Si el átomo de cloro es reemplazado por un grupo metilo, la unión disminuye ligeramente, mientras que la eliminación adicional del doble enlace C6 modifica la cinética de unión, ver la figura 7. [3]
Antiandrógenos no esteroideos [ editar ]
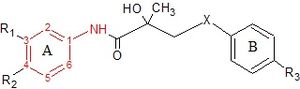
La hidroxiflutamida y sus análogos, bicalutamida y nilutamida, comparten una estructura de anillo de anilida . Las estructuras se pueden ver en la figura 7, donde el anillo de anilida está coloreado de rojo. Estos tres compuestos requieren un anillo aromático deficiente en electrones para una unión a AR eficiente. Reemplazar la anilida con un alqueno produce compuestos débilmente activos, que pueden atribuirse a la falta de unión intramolecular al hidrógeno o a la capacidad deficiente del donante de enlaces de hidrógeno. [3] Varias combinaciones de sustituciones de extracción de electrones en el anillo de anilina de estos medicamentos no han mostrado una mayor unión al receptor AR, en comparación con los compuestos que tienen un grupo cloro o trifluorometilo en elPosición meta (R1) y un grupo ciano o nitrógeno en la posición para (R2). [3] [14]
Para la hidroxiflutamida, un grupo de compuestos que diferían en el anillo aromático no se unía a la AR. Esto sugiere que la bisubstitución en el anillo de hidroxiflutamida es esencial para una alta afinidad de unión a AR. También se ha demostrado que la hidroxiflutamida requiere la fuerte capacidad del donante del enlace de hidrógeno del grupo hidroxilo terciario y de los fijadores fijos involucrados en la unión intramolecular de hidrógeno, para unirse efectivamente a AR. [3] [14]
Para la bicalutamida, las actividades antiandrogénicas de las subestaciones de sulfuro y sulfona del enlace X se probaron in vitro . Los sulfuros mostraron en la mayoría de los casos una afinidad de unión al menos 2 veces mayor que las sulfonas correspondientes. Sin embargo, esta relación se revirtió cuando el grupo R3 era NHSO 2CH 3 , donde la afinidad de unión de la sulfona era 3 veces mayor que la del sulfuro. Estos resultados indican que los sustituyentes del anillo B determinan en gran medida el efecto del enlace X en la unión de AR. Los investigadores han propuesto que el grupo hidroxilo terciario está involucrado en la interacción directa con AR porque cuando un acetiloEl grupo se introduce en ese resto hidroxilo, la afinidad de unión al receptor disminuye considerablemente. [14]
La nilutamida tiene una afinidad muy baja por la AR cuando se prueba en la próstata de rata castrada. Las modificaciones como la sustitución del átomo de N3 por oxígeno tienen poco efecto sobre la afinidad del compuesto por la AR de próstata. Al reemplazar el átomo de oxígeno con un átomo de azufre en la posición C2 del anillo de imidazol y agregar alcohol butílico al átomo de N3, la unión del receptor y la actividad biológica del compuesto aumenta 100 veces la de los NSAA. Además, el compuesto no se une a otros receptores de esteroides. Si se cambia un grupo metilo para el grupo alcohol butílico, el compuesto muestra 3 y 10 veces más actividad antiandrogénica in vivo que bicalutamida y nilutamida, respectivamente. [3]
El síndrome de abstinencia de antiandrógenos [ editar ]
Los antiandrógenos que se encuentran actualmente en el mercado son particularmente útiles para el tratamiento del cáncer de próstata durante las etapas iniciales. Sin embargo, el cáncer de próstata a menudo progresa a un estado hormonal refractario en el cual el cáncer progresa en presencia de ablación androgénica continua o terapia con antiandrógenos. [9] Esto sugiere que el uso a largo plazo de estos antiandrógenos durante el cáncer de próstata puede llevar al desarrollo de células de cáncer de próstata independientes de andrógenos o la capacidad de los andrógenos suprarrenales para apoyar el crecimiento del tumor . [8] Este fenómeno se llama síndrome de abstinencia de antiandrógenos.(AWS) y es uno de los principales inconvenientes de los antiandrógenos existentes. La AWS se define como la regresión del tumor o el alivio sintomático observado al suspender la terapia con antiandrógenos. El mecanismo para esto no se comprende completamente, pero las teorías actuales incluyen alteraciones del gen AR, proteínas correguladoras y / o vías de transducción de señales. Esta resistencia a los antiandrógenos también puede estar vinculada a la debilidad relativa de los antiandrógenos actuales, ya que tienen una afinidad 50 veces o más inferior a la de DHT para el AR. Esto también puede explicar por qué a menudo se observa una sobreexpresión de AR compensatoria. [7]
Mutaciones del gen del receptor de andrógenos [ editar ]
Las mutaciones del gen AR en la LBD que alteran la especificidad del ligando y / o la actividad funcional existen y se cree que contribuyen a la conversión de algunos antagonistas de AR en agonistas, lo que explica la mejora temporal paradójica que a veces se observa en los pacientes cuando se detiene la terapia con antiandrógenos. [15] Estas mutaciones pueden tener un gran efecto en las actividades antagonistas de los actuales antiandrógenos de molécula pequeña y hacer que sean menos eficientes en el bloqueo de la función de AR a través de la modulación indirecta desde el interior de la LBP. Estudios recientes con células tumorales circulantes, sugieren que la frecuencia de mutación es más alta que la supuesta anteriormente en base a las biopsias de tumores . [16] El T877A , [17] W741Ly las mutaciones W741C [18] son ejemplos de mutaciones conocidas de AR LBD. La línea celular de cáncer de próstata LNCaP expresa AR con una mutación puntual T877A que causa la proliferación en presencia de los antiandrógenos hidroxiflutamida y acetato de ciproterona. Esta mutación también se ha descubierto en pacientes con síndrome de abstinencia de antiandrógenos tratados con estos compuestos. [17] En otro estudio, el tratamiento con bicalutamida de las células LNCaP dio como resultado dos mutaciones LBD, W741L y W741C, [18] causando que la bicalutamida adquiera actividad agonista para ambos AR mutantes. [19] La mutación W741L genera espacio adicional tal que el fenilo unido a sulfoniloel anillo de bicalutamida se aloja en la ubicación del anillo de indol faltante de W741. [20] En la AR no mutante, la presencia de la cadena lateral W741 probablemente hace que la bicalutamida sobresalga, lo que impide la posición activa de H12 en el receptor de AR. Sin embargo, la hidroxiflutamida funcionó como un antagonista para los AR mutantes W741. [18] Esto concuerda con la teoría de que la flutamida y la nilutamida antagonizan la AR a través del mecanismo de "antagonismo pasivo", ya que son de un tamaño más modesto que la bicalutamida. [20]Por lo tanto, estos medicamentos pueden ser efectivos como terapia de segunda línea para el cáncer de próstata refractario previamente tratado con bicalutamida. [18]
Estado actual [ editar ]
Antagonistas dominio N-terminal [ editar ]
Se ha propuesto que los antagonistas del dominio N-terminal (NTD) de la AR superen las limitaciones de los antiandrógenos actuales con respecto a las AR mutantes, bloqueando directamente la función de AR de la superficie de la proteína, fuera de la LBP. Se cree que este bloqueo directo proporciona una estrategia más eficiente para evitar o superar la acción de AR anormal durante el AWS, además de permitir una mayor flexibilidad en la modificación estructural sin las limitaciones de espacio del LBP rígido. [8]
Los receptores de esteroides tienen similitudes en las secuencias de genes y estructuras de proteínas, lo que a menudo conduce a interferencias funcionales entre los receptores de esteroides. Uno de los criterios para los antagonistas de AR NTD es lograr un alto grado de especificidad para la AR. Sin embargo, es importante darse cuenta de que la especificidad de la AR no se traduce necesariamente en vivo , ya que los antagonistas de la NTD también pueden interactuar con otras proteínas que no sean la AR. [8]
Ligando de dominio de dominio como sitio de destino [ editar ]
La activación de AR requiere la formación de una región de función de activación funcional 2 (AF2) en AR LBD que media las interacciones entre AR y varios cofactores de transcripción . Por lo tanto, la mayor parte de la investigación sobre los antagonistas de la NTD AR se centra en los péptidos que pueden bloquear directamente la AF2 en AR LBD de la superficie de la proteína. Incluso en la AR mutante unida, los antagonistas de la NTD podrían bloquear la función AF2 a través de la interacción directa de la superficie, independientemente de la unión del ligando. [8]
La investigación sobre estos antagonistas de la NTD generalmente se lleva a cabo mediante el análisis de afinidad de bibliotecas de presentación de fagos que expresan péptidos aleatorios que contienen diversos motivos distintivos . Los AR parecen tener una preferencia distinta por el tipo de motivos de unión 'FxxLF' (donde F = fenilalanina , L = leucina y X = cualquier resto de aminoácido), mientras que otros receptores nucleares tienen un mecanismo de unión altamente similar para el tipo de 'LxxLL' Motivos de encuadernación. Esto proporciona una oportunidad única para el desarrollo de péptidos específicos de AR. [8]
Aunque los antagonistas de molécula pequeña y el antagonista de NTD que se dirigen a la superficie de AF2 difieren en los sitios de unión, ambos inhiben la función AR al interrumpir la función de AF2. Por lo tanto, de forma mecánica, estos antagonistas de la NTD también pueden clasificarse como "antagonistas de AF2". [8]
Dominio N-Terminal como sitio de destino [ editar ]
Funcionalmente, AR NTD desempeña el papel principal en la regulación de la activación de la transcripción del gen diana y en la mediación de diversas interacciones receptor-proteína e intra-receptor N-terminal y C-terminal. Por lo tanto, la modulación de la función NTD se considera una estrategia eficiente para apuntar a la acción AR. Entre varios dominios funcionales en diferentes receptores nucleares, la NTD es la menos conservada y, por lo tanto, podría convertirse en el mejor sitio objetivo para que los antagonistas de la NTD logren la especificidad de AR. Sin embargo, las características estructurales de la NTD son indeterminadas debido a un alto grado de flexibilidad en su conformación. Tanto el análisis bioquímico como el de espectroscopia de dicroismo circular sugieren que la AR NTD está altamente desordenada en condiciones nativas, lo que lo convierte en un objetivo difícil para el descubrimiento de fármacos. [8]
En 2008, hubo informes de un péptido clorado, sintokamida A , aislado de esponjas marinas que inhibe eficazmente la transcripción del gen informador activado en el dominio N-terminal de AR, ver figura 8. [21] La evidencia presentada no fue suficiente para apoyar la conclusión de que la sintokamida A inhibe directamente la función de AR NTD, y el mecanismo de acción necesita más investigación. [8]
Moduladores selectivos del receptor de andrógenos [ editar ]
Los antiandrógenos de molécula pequeña que están disponibles en la actualidad tienen efectos secundarios indeseables causados por una inhibición completa y no selectiva de la acción de AR. Para minimizar estos efectos secundarios, se ha propuesto una nueva clase de moduladores selectivos de los receptores de andrógenos (SARM, por sus siglas en inglés) como un nuevo enfoque para el tratamiento del cáncer de próstata. Estos ligandos deben comportarse como antagonistas en la próstata sin actividad o actividad agonista en otros tejidos diana, para tener poco o ningún efecto en los tejidos anabólicos o el sistema nervioso central (SNC). Sin embargo, descubrir esta nueva clase de ligandos puede ser un desafío porque el mecanismo molecular de la acción AR no se conoce bien. [8]
Se han propuesto varios mecanismos para lograr esta selectividad tisular de los ligandos AR. La evidencia más definitiva existe para el papel de la 5-alfa reductasa . La 5-alfa reductasa solo se expresa en tejidos específicos y, por lo tanto, podría ser un contribuyente único a la selectividad tisular. La inhibición específica de la enzima tipo 2 por la finasterida bloquea la conversión de testosterona a DHT en la próstata. [8]
Varios enfoques podrían hacer uso de la conversión potencial específica de tejido para desarrollar SARM, incluyendo:
- Compuestos parentales inactivos que son activados por la 5-alfa reductasa de tipo 2 en la próstata para formar antiandrógenos.
- Agonistas de AR que son inactivados por la 5-alfa reductasa tipo 2 en la próstata.
- Agonistas de AR que se convierten en antiandrógenos solo por la 5-alfa reductasa de tipo 2 en la próstata. [22]
Otros antiandrógenos de molécula pequeña [ editar ]
El estado de desarrollo de otros antiandrógenos de molécula pequeña en investigación en 2011 se puede ver en la tabla 1.
| Nombre del compuesto | Estructura | Empresa | Etapa de desarrollo | Otra información | |
|---|---|---|---|---|---|
| RU58642 |  | Roussel-Uclaf SA | Preclínica - no hay más desarrollos desde 1998 | Oralmente activo y más potente que los pequeñosantiandrógenos moleculares actuales . [23] | |
| Lg120907 | 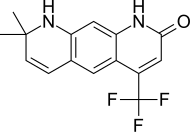 | Ligand Pharmaceuticals | Preclínica | Actividad antagonista fuerte, activa por vía oral en lapróstata sin elevar los niveles plasmáticos de LH ytestosterona . [24] | |
| LG105 | 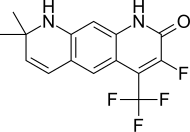 | Ligand Pharmaceuticals | Preclínica | Disponible por vía oral, fuerte actividad antagonista en la próstata sin elevar los niveles plasmáticos de LH y testosterona. Parece ser más potente que LG120907. [24] | |
| Apalutamida(Erleada) |  | Medivación | Aprobado | Alta afinidad de unión a AR.A diferencia de labicalutamida , no promueve la translocación nuclear y afecta tanto la unión del ADN a los elementos de respuesta de andrógenos como el reclutamiento decoactivadores . [25] | |
| Enzalutamide(Xtandi) |  | Medivación | Aprobado | Alta afinidad de unión a AR.A diferencia de la bicalutamida, no promueve la translocación nuclear y afecta tanto la unión del ADN a los elementos de respuesta de andrógenos como el reclutamiento de coactivadores. [25] Induceapoptosis de células tumorales y no tiene actividadagonista . [26] | |
| BMS-641988 | 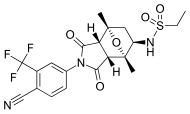 | Bristol-Myers Squibb | Fase I clínico - ensayo terminado | Mostró mayor potencia en comparación con bicalutamida. El ensayo de fase I se suspendió debido a una convulsión epiléptica en un paciente. [27] Esto llevó a los hallazgos de que varios antiandrógenos producen una unión de antagonistas fuera del objetivo a los receptores GABA-A . [28] | |
| CH5137291 | 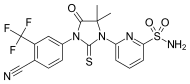 | Chugai Pharmaceutical Co. Ltd. | Preclínica | Inhibe completamente la transactivación mediada por AR y la proliferación del modelo de xenoinjerto CRPC LNCaP-BC2, que es resistente a la bicalutamida.[29] [30] |
Antiandrógenos naturales [ editar ]
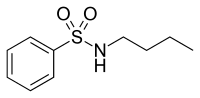
El ácido intrarrico y la N-butilbencenosulfonamida son compuestos naturales con propiedades antiandrógenas que se han purificado de la corteza del árbol africano Pygeum africanum , véanse las figuras 9 y 10. [31]Los ensayos in vitro mostraron que ambos son agonistas selectivos de AR y que Inhibe la proliferación de varias líneas celulares de cáncer de próstata. El ácido ararrico también dificulta la invasión de la matriz extracelular y ambos compuestos son capaces de prevenir la translocación nuclear inducida por andrógenos de la AR. Actualmente se están sintetizando derivados más potentes con la esperanza de mejorar el perfil farmacológico de estos dos compuestos.





No hay comentarios:
Publicar un comentario