La termodinámica es la rama de la física que tiene que ver con el calor y la temperatura y su relación con la energía y el trabajo . El comportamiento de estas cantidades se rige por las cuatro leyes de la termodinámica , independientemente de la composición o propiedades específicas del material o sistema en cuestión. Las leyes de la termodinámica se explican en términos de componentes microscópicos por la mecánica estadística . La termodinámica se aplica a una amplia variedad de temas en ciencia e ingeniería , especialmente química física , ingeniería química.e ingeniería mecánica .
Históricamente, la termodinámica se desarrolló por el deseo de aumentar la eficiencia de las primeras máquinas de vapor , particularmente a través del trabajo del físico francés Nicolas Léonard Sadi Carnot (1824) quien creía que la eficiencia del motor era la clave que podría ayudar a Francia a ganar las Guerras Napoleónicas . [1] El físico escocés-irlandés Lord Kelvin fue el primero en formular una definición concisa de termodinámica en 1854 [2] que declaró: "La termodinámica es el tema de la relación entre el calor y las fuerzas que actúan entre partes contiguas de los cuerpos, y Relación del calor a la agencia eléctrica.
La aplicación inicial de la termodinámica a los motores térmicos mecánicos se extendió tempranamente al estudio de compuestos químicos y reacciones químicas. La termodinámica química estudia la naturaleza del papel de la entropía en el proceso de las reacciones químicas y ha proporcionado la mayor parte de la expansión y el conocimiento del campo. [3] [4] [5] [6] [7] [8] [9] [10] [11]Otras formulaciones de termodinámica surgieron en las décadas siguientes. La termodinámica estadística , o mecánica estadística, se ocupaba de las estadísticasPredicciones del movimiento colectivo de partículas a partir de su comportamiento microscópico. En 1909, Constantin Carathéodory presentó un enfoque puramente matemático del campo en su formulación axiomática de la termodinámica, una descripción a menudo denominada termodinámica geométrica .
Introducción [ editar ]
Una descripción de cualquier sistema termodinámico emplea las cuatro leyes de la termodinámica que forman una base axiomática. La primera ley especifica que la energía se puede intercambiar entre sistemas físicos como calor y trabajo . [12] La segunda ley define la existencia de una cantidad llamada entropía , que describe la dirección, termodinámicamente, que un sistema puede evolucionar y cuantifica el estado de orden de un sistema y que se puede utilizar para cuantificar el trabajo útil que se puede extraer. del sistema. [13]
En termodinámica, las interacciones entre grandes conjuntos de objetos se estudian y categorizan. Para ello son fundamentales los conceptos del sistema termodinámico y su entorno . Un sistema está compuesto de partículas, cuyos movimientos promedio definen sus propiedades, y esas propiedades se relacionan entre sí mediante ecuaciones de estado . Las propiedades se pueden combinar para expresar la energía interna y los potenciales termodinámicos , que son útiles para determinar las condiciones para el equilibrio y los procesos espontáneos .
Con estas herramientas, la termodinámica se puede usar para describir cómo los sistemas responden a los cambios en su entorno. Esto se puede aplicar a una amplia variedad de temas en ciencia e ingeniería , como motores , transiciones de fase , reacciones químicas , fenómenos de transporte e incluso agujeros negros . Los resultados de la termodinámica son esenciales para otros campos de la física y de la química , ingeniería química, ingeniería aeroespacial , ingeniería mecánica , la biología celular , la ingeniería biomédica ,ciencia de los materiales y economía , por nombrar algunos. [14] [15]
Este artículo se centra principalmente en la termodinámica clásica, que estudia principalmente sistemas en equilibrio termodinámico . La termodinámica de no equilibrio a menudo se trata como una extensión del tratamiento clásico, pero la mecánica estadística ha traído muchos avances en ese campo.
Historia [ editar ]
La historia de la termodinámica como disciplina científica generalmente comienza con Otto von Guericke , quien en 1650 construyó y diseñó la primera bomba de vacío del mundo y demostró un vacíoutilizando sus hemisferios de Magdeburgo . Guericke se vio obligado a hacer un vacío para desmentir la suposición sostenida de Aristóteles de que "la naturaleza aborrece el vacío". Poco después de Guericke, el físico y químico inglés Robert Boyle se enteró de los diseños de Guericke y, en 1656, en coordinación con el científico inglés Robert Hooke , construyó una bomba de aire. [17]Usando esta bomba, Boyle y Hooke notaron una correlación entrePresión , temperaturay volumen . Con el tiempo, se formuló la Ley de Boyle , que establece que la presión y el volumen son inversamente proporcionales . Luego, en 1679, basándose en estos conceptos, un asociado de Denis Papin , de Boyle, construyó un digestor de vapor , que era un recipiente cerrado con una tapa bien ajustada que confinaba vapor hasta que se generaba una alta presión.
Los diseños posteriores implementaron una válvula de liberación de vapor que evitó que la máquina explotara. Al observar el movimiento rítmico de la válvula hacia arriba y hacia abajo, Papin concibió la idea de un pistón y un motor de cilindro. Sin embargo, no siguió con su diseño. Sin embargo, en 1697, basándose en los diseños de Papin, el ingeniero Thomas Savery construyó el primer motor, seguido por Thomas Newcomen en 1712. Aunque estos primeros motores eran toscos e ineficientes, atrajeron la atención de los principales científicos de la época.
Los conceptos fundamentales de la capacidad de calor y el calor latente , que eran necesarios para el desarrollo de la termodinámica, fueron desarrollados por el profesor Joseph Black en la Universidad de Glasgow, donde James Watt fue empleado como fabricante de instrumentos. Black y Watt realizaron experimentos juntos, pero fue Watt quien concibió la idea del condensador externo, lo que resultó en un gran aumento en la eficiencia de la máquina de vapor . [18] Basándose en todos los trabajos anteriores, Sadi Carnot , el "padre de la termodinámica", publicó Reflexiones sobre el poder motriz del fuego.(1824), un discurso sobre el calor, la potencia, la energía y la eficiencia del motor. El libro describe las relaciones energéticas básicas entre el motor de Carnot , el ciclo de Carnot y la fuerza motriz . Marcó el inicio de la termodinámica como una ciencia moderna. [10]
El primer libro de texto termodinámico fue escrito en 1859 por William Rankine , originalmente formado como físico y profesor de ingeniería civil y mecánica en la Universidad de Glasgow . [19] Las primeras y segundas leyes de la termodinámica surgieron simultáneamente en la década de 1850, principalmente a partir de las obras de William Rankine , Rudolf Clausius y William Thomson (Lord Kelvin).
Los fundamentos de la termodinámica estadística fueron establecidos por físicos como James Clerk Maxwell , Ludwig Boltzmann , Max Planck , Rudolf Clausius y J. Willard Gibbs .
Durante los años 1873-76, el físico matemático estadounidense Josiah Willard Gibbs publicó una serie de tres artículos, el más famoso es Sobre el equilibrio de sustancias heterogéneas , [3] en el que mostraba cómo los procesos termodinámicos , incluidas las reacciones químicas , podían analizarse gráficamente. Al estudiar la energía , la entropía , el volumen , la temperatura y la presión del sistema termodinámico de tal manera, se puede determinar si un proceso ocurrirá espontáneamente. [20] También Pierre DuhemEn el siglo XIX escribió sobre termodinámica química. [4] A principios del siglo 20, químicos como Gilbert N. Lewis , Merle Randall , [5] y EA Guggenheim [6] [7] aplicaron los métodos matemáticos de Gibbs al análisis de procesos químicos.
Etimología [ editar ]
La etimología de la termodinámica tiene una historia intrincada. [21] Primero se deletreó en forma de guión como un adjetivo ( termo-dinámico ) y de 1854 a 1868 como el sustantivo termodinámica para representar la ciencia de los motores de calor generalizados. [21]
El biofísico estadounidense Donald Haynie afirma que la termodinámica fue acuñada en 1840 a partir de la raíz griega thermρμη therme, que significa calor y δύναμις dynamis, que significa poder. [22] Sin embargo, esta etimología ha sido citada como poco probable. [21]
Pierre Perrot afirma que el término termodinámica fue acuñado por James Joule en 1858 para designar la ciencia de las relaciones entre calor y energía, [10] sin embargo, Joule nunca usó ese término, sino que usó el término perfecto motor termo-dinámico en referencia a Thomson 1849 [23] fraseología. [21]
Para 1858, la termodinámica , como término funcional, se usaba en el artículo de William Thomson "Una explicación de la teoría de Carnot sobre la fuerza motriz del calor". [23]
Ramas de la termodinámica [ editar ]
El estudio de los sistemas termodinámicos se ha desarrollado en varias ramas relacionadas, cada una utilizando un modelo fundamental diferente como base teórica o experimental, o aplicando los principios a diversos tipos de sistemas.
Termodinámica clásica [ editar ]
La termodinámica clásica es la descripción de los estados de los sistemas termodinámicos en un equilibrio cercano, que utiliza propiedades medibles y macroscópicas. Se utiliza para modelar intercambios de energía, trabajo y calor basados en las leyes de la termodinámica . El calificador clásico refleja el hecho de que representa el primer nivel de comprensión del tema tal como se desarrolló en el siglo XIX y describe los cambios de un sistema en términos de parámetros empíricos macroscópicos (a gran escala y mensurables). Una interpretación microscópica de estos conceptos fue proporcionada posteriormente por el desarrollo de la mecánica estadística .
Mecánica estadística [ editar ]
La mecánica estadística , también llamada termodinámica estadística, surgió con el desarrollo de teorías atómicas y moleculares a finales del siglo XIX y principios del XX, y complementó la termodinámica clásica con una interpretación de las interacciones microscópicas entre partículas individuales o estados cuántico-mecánicos. Este campo relaciona las propiedades microscópicas de los átomos y las moléculas individuales con las propiedades macroscópicas y masivas de los materiales que se pueden observar a escala humana, lo que explica la termodinámica clásica como un resultado natural de las estadísticas, la mecánica clásica y la teoría cuántica a nivel microscópico.
Termodinámica química [ editar ]
La termodinámica química es el estudio de la interrelación de la energíacon las reacciones químicas o con un cambio físico de estado dentro de los límites de las leyes de la termodinámica .
Termodinámica del equilibrio [ editar ]
La termodinámica del equilibrio es el estudio sistemático de las transferencias de materia y energía en los sistemas a medida que pasan de un estado de equilibrio termodinámico a otro. El término "equilibrio termodinámico" indica un estado de equilibrio. En un estado de equilibrio, no hay potenciales desbalanceados, o fuerzas impulsoras, entre partes macroscópicamente distintas del sistema. Un objetivo central en la termodinámica de equilibrio es: dado un sistema en un estado de equilibrio inicial bien definido, y dado su entorno, y dadas sus paredes constitutivas, para calcular cuál será el estado de equilibrio final del sistema después de que una operación termodinámica específica haya cambiado Sus muros o alrededores.
La termodinámica de no equilibrio es una rama de la termodinámica que se ocupa de los sistemas que no están en equilibrio termodinámico . La mayoría de los sistemas que se encuentran en la naturaleza no están en equilibrio termodinámico porque no están en estados estacionarios, y están sujetos continua y discontinuamente a flujos de materia y energía hacia y desde otros sistemas. El estudio termodinámico de los sistemas de no equilibrio requiere conceptos más generales de los que trata la termodinámica de equilibrio. Muchos sistemas naturales aún hoy en día permanecen fuera del alcance de los métodos termodinámicos macroscópicos conocidos actualmente.
Leyes de la termodinámica [ editar ]
La termodinámica se basa principalmente en un conjunto de cuatro leyes que son universalmente válidas cuando se aplican a sistemas que se encuentran dentro de las restricciones implícitas en cada una. En las diversas descripciones teóricas de la termodinámica estas leyes pueden expresarse en formas aparentemente diferentes, pero las formulaciones más destacadas son las siguientes:
- Ley cero de la termodinámica : si dos sistemas están cada uno en equilibrio térmico con un tercero, también están en equilibrio térmico entre sí.
Esta declaración implica que el equilibrio térmico es una relación de equivalencia en el conjunto de sistemas termodinámicos en consideración. Se dice que los sistemas están en equilibrio si los pequeños intercambios aleatorios entre ellos (por ejemplo, el movimiento browniano ) no conducen a un cambio neto en la energía. Esta ley se asume tácitamente en cada medida de temperatura. Por lo tanto, si uno trata de decidir si dos cuerpos están a la misma temperatura , no es necesario ponerlos en contacto y medir cualquier cambio de sus propiedades observables en el tiempo. [24] La ley proporciona una definición empírica de temperatura y justificación para la construcción de termómetros prácticos.
La ley cero no fue nombrada inicialmente como una ley de la termodinámica, ya que su base en el equilibrio termodinámico estaba implícita en las otras leyes. La primera, la segunda y la tercera leyes se habían establecido explícitamente con anterioridad y se había encontrado una aceptación común en la comunidad física. Una vez que se realizó la importancia de la ley cero para la definición de la temperatura, no fue posible volver a numerar las otras leyes, por lo que se numeró la ley cero .
- Primera ley de la termodinámica : la energía interna de un sistema aislado es constante.
La primera ley de la termodinámica es una expresión del principio de conservación de la energía . Establece que la energía se puede transformar (cambiar de una forma a otra), pero no se puede crear o destruir. [25]
La primera ley suele formularse diciendo que el cambio en la energía interna de un sistema termodinámicocerrado es igual a la diferencia entre el calor suministrado al sistema y la cantidad de trabajo realizado por el sistema en su entorno. Es importante tener en cuenta que la energía interna es un estado del sistema (consulte Estado termodinámico ), mientras que el calor y el trabajo modifican el estado del sistema. En otras palabras, un cambio de energía interna de un sistema puede lograrse mediante cualquier combinación de calor y trabajo agregado o eliminado del sistema, siempre que sean totales para el cambio de energía interna. La manera en que un sistema logra su energía interna es independiente de la trayectoria.
- Segunda ley de la termodinámica : el calor no puede fluir espontáneamente desde una ubicación más fría a una ubicación más caliente.
La segunda ley de la termodinámica es una expresión del principio universal de decaimiento observable en la naturaleza. La segunda ley es una observación del hecho de que, con el tiempo, las diferencias de temperatura, presión y potencial químico tienden a compensarse en un sistema físico que está aislado del mundo exterior. La entropía es una medida de cuánto ha progresado este proceso. La entropía de un sistema aislado que no está en equilibrio tenderá a aumentar con el tiempo, acercándose a un valor máximo en equilibrio. Sin embargo, los principios que guían los sistemas que están lejos del equilibrio todavía son discutibles. Uno de tales principios es el principio de máxima producción de entropía . [26] [27]Afirma que los sistemas de no equilibrio se comportan de tal manera que maximizan su producción de entropía. [28]
En la termodinámica clásica, la segunda ley es un postulado básico aplicable a cualquier sistema que implique la transferencia de energía térmica; En termodinámica estadística, la segunda ley es una consecuencia de la supuesta aleatoriedad del caos molecular. Hay muchas versiones de la segunda ley, pero todas tienen el mismo efecto, que es explicar el fenómeno de la irreversibilidad en la naturaleza.
- Tercera ley de la termodinámica : cuando un sistema se acerca al cero absoluto, todos los procesos cesan y la entropía del sistema se aproxima a un valor mínimo.
La tercera ley de la termodinámica es una ley estadística de la naturaleza con respecto a la entropía y la imposibilidad de alcanzar el cero absoluto de temperatura. Esta ley proporciona un punto de referencia absoluto para la determinación de la entropía. La entropía determinada en relación con este punto es la entropía absoluta. Las definiciones alternativas son, "la entropía de todos los sistemas y de todos los estados de un sistema es más pequeña en el cero absoluto", o de manera equivalente "es imposible alcanzar el cero absoluto de la temperatura mediante un número finito de procesos".
El cero absoluto, en el que se detendría toda la actividad si fuera posible, es −273.15 ° C (grados Celsius), o −459.67 ° F (grados Fahrenheit), o 0 K (kelvin), o 0 ° R (grados Rankine ).
Modelos de sistema [ editar ]
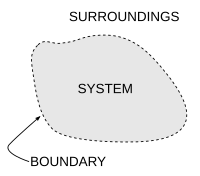
Un concepto importante en termodinámica es el sistema termodinámico , que es una región del universo en estudio definida con precisión. Todo en el universo, excepto el sistema, se llama el entorno . Un sistema está separado del resto del universo por un límite que puede ser un límite físico o nocional, pero que por convención define un volumen finito. Los intercambios de trabajo , calor o materia entre el sistema y los alrededores tienen lugar a través de este límite.
En la práctica, el límite de un sistema es simplemente una línea de puntos imaginaria dibujada alrededor de un volumen dentro del cual va a haber un cambio en la energía interna de ese volumen. Cualquier cosa que pase a través del límite que efectúe un cambio en la energía interna del sistema debe tenerse en cuenta en la ecuación de balance de energía. El volumen puede ser la región que rodea a un solo átomo de energía resonante, como Max Planck definido en 1900; puede ser un cuerpo de vapor o aire en una máquina de vapor , como lo definió Sadi Carnot en 1824; Puede ser el cuerpo de un ciclón tropical , como Kerry Emanuel teorizó en 1986 en el campo de la termodinámica atmosférica.; También podría ser solo un núclido (es decir, un sistema de quarks ) según la hipótesis de la termodinámica cuántica , o el horizonte de eventos de un agujero negro .
Los límites son de cuatro tipos: fijos, móviles, reales e imaginarios. Por ejemplo, en un motor, un límite fijo significa que el pistón está bloqueado en su posición, dentro del cual puede ocurrir un proceso de volumen constante. Si se permite que el pistón se mueva, ese límite es móvil, mientras que los límites del cilindro y la culata son fijos. Para los sistemas cerrados, los límites son reales, mientras que para los sistemas abiertos, los límites son a menudo imaginarios. En el caso de un motor a reacción, se puede asumir un límite imaginario fijo en la admisión del motor, límites fijos a lo largo de la superficie de la caja y un segundo límite imaginario fijo a través de la boquilla de escape.
En general, la termodinámica distingue tres clases de sistemas, definidos en términos de lo que se permite cruzar sus límites:
| Tipo de sistema | Flujo de masa | Trabajo | Calor |
|---|---|---|---|
| Abierto | |||
| Cerrado | |||
| Aislado termicamente | |||
| Mecánicamente aislado | |||
| Aislado |
A medida que pasa el tiempo en un sistema aislado, las diferencias internas de presiones, densidades y temperaturas tienden a compensarse. Se dice que un sistema en el que todos los procesos de ecualización se han completado está en un estado de equilibrio termodinámico .
Una vez en el equilibrio termodinámico, las propiedades de un sistema son, por definición, invariables en el tiempo. Los sistemas en equilibrio son mucho más simples y fáciles de entender que los sistemas que no están en equilibrio. A menudo, al analizar un proceso termodinámico dinámico, se supone que cada estado intermedio en el proceso se encuentra en equilibrio, produciendo procesos termodinámicos que se desarrollan tan lentamente como para permitir que cada paso intermedio sea un estado de equilibrio y se dice que son procesos reversibles. .
Estados y procesos [ editar ]
Cuando un sistema está en equilibrio bajo un conjunto dado de condiciones, se dice que está en un estado termodinámico definido . El estado del sistema se puede describir mediante una cantidad de cantidades de estado que no dependen del proceso por el cual el sistema llegó a su estado. Se denominan variables intensivaso variables extensivas según cómo cambian cuando cambia el tamaño del sistema. Las propiedades del sistema se pueden describir mediante una ecuación de estado que especifica la relación entre estas variables. Se puede pensar en el estado como la descripción cuantitativa instantánea de un sistema con un número determinado de variables mantenidas constantes.
Un proceso termodinámico se puede definir como la evolución energética de un sistema termodinámico que va de un estado inicial a un estado final. Puede ser descrito por cantidades de proceso . Típicamente, cada proceso termodinámico se distingue de otros procesos de carácter energético según los parámetros, como la temperatura, la presión o el volumen, etc., se mantienen fijos; Además, es útil agrupar estos procesos en pares, en los que cada variable mantenida constante es un miembro de un par conjugado .
Varios procesos termodinámicos comúnmente estudiados son:
- Proceso adiabático : se produce sin pérdida ni ganancia de energía por el calor.
- Proceso isenthalpic : ocurre a una entalpia constante.
- Proceso isentrópico : un proceso adiabático reversible, ocurre en una entropía constante
- Proceso isobárico : se produce a presión constante.
- Proceso isocórico : ocurre a un volumen constante (también llamado isométrico / isovolumétrico)
- Proceso isotérmico : se produce a una temperatura constante.
- Proceso en estado estacionario : ocurre sin un cambio en la energía interna.
Instrumentación [ editar ]
Hay dos tipos de instrumentos termodinámicos , el medidor y el depósito . Un medidor termodinámico es cualquier dispositivo que mide cualquier parámetro de un sistema termodinámico . En algunos casos, el parámetro termodinámico se define realmente en términos de un instrumento de medición idealizado. Por ejemplo, la ley cero establece que si dos cuerpos están en equilibrio térmico con un tercer cuerpo, también están en equilibrio térmico entre sí. Este principio, como lo señaló James Maxwell en 1872, afirma que es posible medir la temperatura. Un termómetro idealizado es una muestra de un gas ideal a presión constante. De la ley del gas ideal. pV = nRT , el volumen de dicha muestra se puede utilizar como un indicador de temperatura; De esta manera define la temperatura. Aunque la presión se define mecánicamente, un dispositivo de medición de la presión, llamado barómetro , también puede construirse a partir de una muestra de un gas ideal mantenido a una temperatura constante. Un calorímetro es un dispositivo que se utiliza para medir y definir la energía interna de un sistema.
Un reservorio termodinámico es un sistema que es tan grande que sus parámetros de estado no se alteran apreciablemente cuando se pone en contacto con el sistema de interés. Cuando el depósito se pone en contacto con el sistema, el sistema se pone en equilibrio con el depósito. Por ejemplo, un depósito de presión es un sistema a una presión particular, que impone esa presión sobre el sistema al que está conectado mecánicamente. La atmósfera de la Tierra se utiliza a menudo como un depósito de presión. Si el agua del océano se utiliza para enfriar una central eléctrica, el océano es a menudo un reservorio de temperatura en el análisis del ciclo de la central eléctrica.
Variables conjugadas [ editar ]
El concepto central de la termodinámica es el de la energía , la capacidad de trabajar . Por la Primera Ley , se conserva la energía total de un sistema y su entorno. La energía se puede transferir a un sistema mediante calentamiento, compresión o adición de materia, y se puede extraer de un sistema mediante enfriamiento, expansión o extracción de materia. En mecánica , por ejemplo, la transferencia de energía es igual al producto de la fuerza aplicada a un cuerpo y el desplazamiento resultante.
Las variables conjugadas son pares de conceptos termodinámicos, siendo el primero similar a una "fuerza" aplicada a algún sistema termodinámico , el segundo es similar al "desplazamiento" resultante y el producto de los dos iguala la cantidad de energía transferida. Las variables conjugadas comunes son:
- Presión - volumen (los parámetros mecánicos );
- Temperatura - entropía (parámetros térmicos);
- Potencial químico - número de partículas (parámetros del material).
Potenciales [ editar ]
Los potenciales termodinámicos son diferentes medidas cuantitativas de la energía almacenada en un sistema. Los potenciales se utilizan para medir los cambios de energía en los sistemas a medida que evolucionan de un estado inicial a un estado final. El potencial utilizado depende de las restricciones del sistema, como la temperatura o presión constante. Por ejemplo, las energías de Helmholtz y Gibbs son las energías disponibles en un sistema para realizar un trabajo útil cuando la temperatura y el volumen o la presión y la temperatura son fijos, respectivamente.
Los cinco potenciales más conocidos son:
| Nombre | Símbolo | Fórmula | Variables naturales |
|---|---|---|---|
| Energía interna | |||
| Helmholtz energía libre | |||
| Entalpia | |||
| Energía libre de Gibbs | |||
| Potencial de Landau (Gran potencial) | , |
dónde es la temperatura ,la entropía ,la presión ,el volumen ,el potencial químico , el número de partículas en el sistema, y Es el recuento de tipos de partículas en el sistema.
Los potenciales termodinámicos pueden derivarse de la ecuación de balance de energía aplicada a un sistema termodinámico. Otros potenciales termodinámicos también se pueden obtener a través de la transformación de Legendre .



























No hay comentarios:
Publicar un comentario