Gases de efecto invernadero
ozono (O3) es una sustancia cuya molécula está compuesta por tres átomos de oxígeno, formada al disociarse los dos átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno gaseoso (O2), formando moléculas de ozono (O3).
A temperatura y presión ambientales el ozono es un gas de olor acre y generalmente incoloro, pero en grandes concentraciones puede volverse ligeramente azulado. Si se respira en grandes cantidades, puede provocar una irritación en los ojos o garganta, la cual suele pasar después de respirar aire fresco por algunos minutos.
| Ozono | ||
|---|---|---|
    | ||
| Nombre IUPAC | ||
| Trioxígeno | ||
| General | ||
| Fórmula estructural | ver imagen | |
| Fórmula molecular | O3 | |
| Identificadores | ||
| Número CAS | 10028-15-61 | |
| ChEBI | 25812 | |
| ChemSpider | 23208 | |
| PubChem | 24823 | |
| Propiedades físicas | ||
| Apariencia | Azul pálido | |
| Densidad | 2,140 kg/m3; Expresión errónea: carácter de puntuación « » desconocido g/cm3 | |
| Masa molar | 47,998 g/mol | |
| Punto de fusión | 80,7 K (-192 °C) | |
| Punto de ebullición | 161 K (-112 °C) | |
| Viscosidad | N/A | |
| Índice de refracción(nD) | 1,2226 (liquid) | |
| Propiedades químicas | ||
| Solubilidaden agua | 0,105 g/100 mL (0 °C) | |
| Termoquímica | ||
| ΔfH0sólido | 142,3 kJ/mol | |
| Riesgos | ||
| Riesgosprincipales | Exposición mayor de 0,05 PPM | |
| Ingestión | N/R | |
| Inhalación | >0,05 PPM por 8 horas | |
| Piel | No reacciona | |
| Ojos | Irritación a más de 0,05 PPM | |
Descubrimiento
El ozono es el primer alótropo de un elemento químico que fue identificado por la ciencia. En la actualidad no se conoce bien quién fue su descubridor original, siendo varios los candidatos. Varios estudios apuntan a que fueron los químicos Charles Fabry y Henri Buisson quienes descubrieron en 1913 la capa de ozono.
En 1785, el químico holandés Martinus van Marum mientras estaba llevando a cabo experimentos con chispas eléctricas por encima del agua notó un olor extraño, que atribuyó a las reacciones eléctricas, sin darse cuenta de que en realidad había creado ozono.2 Medio siglo más tarde,Christian Friedrich Schönbein notó el mismo olor acre y lo reconoció como el olor que se apreciaba a menudo en las tormentas eléctricas después de la caida de un rayo. En 1839, logró aislar el compuesto gaseoso y lo llamó «ozono», de la palabra griega ozein (ὄζειν), 'tener olor'.3 4 Por esta razón, Schönbein es generalmente acreditado con el descubrimiento del ozono.2 5La fórmula para el ozono, O3, no fue determinado hasta 1865 por Jacques-Louis Soret6 y confirmado por Schönbein en 1867.3 7
Durante gran parte de la segunda mitad del siglo XIX y hasta bien entrado el siglo XX, el ozono se consideró un componente saludable del medio ambiente por los naturalistas y asilos de salud. La localidad de Beaumont,California tuvo como lema oficial «Beaumont: Zona de Ozono», como evidencian las postales y el encabezamiento de lal cartas de la Cámara de Comercio.8 Los naturalistas que trabajaban al aire libre a menudo consideraban las elevaciones más altas beneficiosas debido a su contenido de ozono. «Hay una atmósfera muy diferente [en la cota más alta] con suficiente ozono para sostener la energía necesaria [para trabajar]», escribió el naturalista Henry Henshaw, trabajando en Hawaii.9 El aire marino se pensaba que era más saludable debido a su contenido de ozono; pero el olor que da lugar a esta creencia es, de hecho, la de los metabolitos de las algas halogenadas.10
De hecho, incluso Benjamin Franklin pensaba que la presencia del cólera estaba relacionado con la deficiencia o falta de ozono en la atmósfera, un sentimiento compartido por la Asociación Británica de Ciencia (British Science Association, entonces conocida simplemente como British Association).11
Aplicaciones
El ozono se puede producir artificialmente mediante un generador de ozono.
Tiene uso industrial como precursor en la síntesis de algunos compuestos orgánicos, pero principalmente como desinfectante depurador y purificador de aguas minerales. Su principal propiedad es la de ser un fuerte oxidante. También es conocido por el importante papel que desempeña en la atmósfera. A este nivel es necesario distinguir entre el ozono presente en la estratosfera y el de la troposfera. En ambos casos su formación y destrucción son fenómenos fotoquímicos.
Cuando el oxígeno del aire es sujeto a un pulso de alta energía, como un rayo, el doble enlace O=O del oxígeno se rompe entregando dos átomos de oxígeno los cuales luego se recombinan con otras moléculas de oxígeno. Estas moléculas recombinadas contienen tres átomos de oxígeno en vez de dos, lo que origina ozono.
Desinfección del agua
La primera vez que se utilizó con este propósito tuvo lugar en 1893. Desde entonces ha ido ganando en popularidad y es usado cada vez más por industrias y particulares.
Las principales ventajas que aporta el ozono para su uso en aguas son:
- Elimina los olores y sabores del agua.
- No deja residuos.
- Compatible con otros tratamientos.
- No afecta al pH.
- No colorea el agua.
Una de las principales ventajas de su uso es la conversión del ozono en oxígeno, sin dejar ningún residuo químico perjudicial en el agua.
Ozono atmosférico
El ozono atmosférico se encuentra en estado puro en diferentes concentraciones entre los 10 y los 40 km sobre el nivel del mar, siendo su concentración más alta alrededor de los 25 km (ozonosfera), es decir en la estratosfera.
Actúa en la atmósfera como depurador del aire y sobre todo como filtro de los rayos ultravioletas procedentes del Sol. Sin ese filtro la existencia de vida en la Tierra sería completamente imposible; de ahí la gran importancia de la llamada “capa de ozono”.
El ozono en su forma natural es un gas de color azul y de un olor picante muy característico. Se licúa a −111,9° C y se solidifica a −193° C.
El ozono en altas concentraciones y por períodos prolongados tiene efectos perjudiciales para la salud. Más allá de especulaciones (muchas de ellas de carácter publicitario) acerca de efectos beneficiosos a bajas concentraciones, la Organización Mundial de la Salud plantea que no hay ninguna evidencia de un umbral por debajo del cual no exista perjuicio.12
Ozono estratosférico
El ozono se encuentra de forma natural en la estratosfera, formando la denominada capa de ozono. El ozono estratosférico se forma por acción de la radiación ultravioleta, que disocia las moléculas de oxígeno molecular (O2) en dos átomos, los cuales son altamente reactivos, pudiendo reaccionar estos con otra molécula de O2 formándose el ozono.
El ozono se destruye a su vez por acción de la propia radiación ultravioleta, ya que la radiación con longitud de onda menor de 290 nm hace que se desprenda un átomo de oxígeno de la molécula de ozono. Se forma así un equilibrio dinámico en el que se forma y destruye ozono, consumiéndose de esta forma la mayoría de la radiación de longitud de onda menor de 290 nm. Así, el ozono actúa como un filtro que no deja pasar dicha radiación perjudicial hasta la superficie de la Tierra.
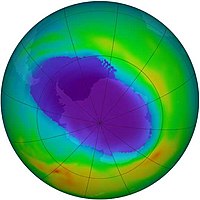
El equilibrio del ozono en la estratosfera se ve afectado por la presencia de contaminantes, como pueden ser los compuestos clorofluorocarbonados (CFC), que suben hasta la alta atmósfera donde catalizan la destrucción del ozono más rápidamente de lo que se regenera, produciendo así el agujero de la capa de ozono. El daño que causan cada uno de estos contaminantes es función de su potencial de agotamiento del ozono, esto fue descubierto por los científicos Mario Molina (México), Frank Sherwood Rowland(Estados Unidos) y el holandés Paul J. Crutzen obteniendo por ello el Premio Nobel de Química en 1995.
Para medir la concentración de ozono en la atmósfera se utilizan instrumentos en satélites tales como GOMOS en el satélite Envisat.
Ozono troposférico
También denominado ozono ambiental. Se trata de un gas incoloro que se crea a través de reacciones foto químicas entre óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV) derivados de fuentes como la quema de combustible. Es el compuesto más destacado de los oxidantes foto químicos y forma parte del llamado esmog fotoquímico.
Puede encontrarse en la zona más baja de la atmósfera, ya que proviene de emisiones naturales de COA, NO* y OC así como del ozono estratifico descendente. Esto se convierte en un problema puesto que el ozono, en concentración suficiente, puede provocar daños en la salud humana (a partir de unos 150 micro-gramos por metro cúbico) o en la vegetación (a partir de 30 ppb (partes por billón anglosajón, o millardo)) y contribuye a generar un calentamiento en la superficie de la tierra. Estas características del ozono han propiciado que dentro de la Unión Europea aparezca una normativa relativa al ozono en el aire ambiente (Directiva 2002/3/CE), que establece el nuevo régimen jurídico comunitario sobre el ozono troposférico presente en la baja atmósfera.
Su formación empieza a partir de la emisión del dióxido de nitrógeno (NO2) e hidrocarburos (compuestos que reaccionan en la presencia de calor y luz solar para producir ozono).
El mecanismo mediante el cual se genera el ozono en la troposfera es completamente distinto, ya que a esta altura no llegan las radiaciones ultravioletas. El ozono, en este caso, se forma a partir de ciertos precursores (NO* - óxidos de nitrógeno; y VOCs - compuestos orgánicos volátiles, como el formaldehído), contaminantes provenientes de la actividad humana. Estos contaminantes se disocian formando radicales con radiación menos energética, y dichos radicales pueden formar ozono con el oxígeno molecular.
El conjunto del ozono, NOx y COV forma una neblina visible en zonas muy contaminadas denominada smog fotoquímico o smog de verano, ya que, en el hemisferio norte, ocurre generalmente entre los meses de agosto y septiembre.
Toxicidad
Su presencia en la estratosfera protege de las excesivas radiaciones ultravioletas. Es un potente oxidante detectable a concentraciones por debajo de 0,1 ppm. Es bastante soluble, por lo que su acción irritante se manifiesta en las vías respiratorias superiores. Aunque no es probable que el ozono de forma natural aparezca en concentraciones peligrosas para el hombre, es un compuesto extremadamente reactivo.
El límite recomendado de exposición de ozono es de 0,1 partes por millón (ppm), o sea 0,2 miligramos por metro cúbico, calculado como una concentración ponderada de ocho horas, y a corto plazo de 0,03 ppm (0,6 mg. por metro cúbico), como una concentración ponderada de quince minutos. En función de la concentración puede producir diversos efectos en el organismo (Tabla 1)
Incluso en concentraciones muy bajas el ozono puede ser nocivo para el tracto respiratorio superior y los pulmones, aun tratándose de una exposición de corta duración.
A concentraciones extremadamente bajas, el ozono puede producir hipersensibilidad bronquial y respuesta inflamatoria en el tejido respiratorio Además la exposición intermitente puede producir una inflamación en bronquios y pulmones.13
Estudios en animales indican que el ozono también puede provocar edema pulmonar, que pueden aparecer hasta veinticuatro horas más tarde de la exposición.
La disminución en la función respiratoria no parece ser más pronunciada en fumadores o personas con desórdenes pulmonares preexistentes.
A concentraciones más altas puede aparecer función renal reducida, fatiga extrema, mareo, inhabilidad para dormir, o cianosis.
El ozono (O3) es un potente oxidante que reacciona con proteínas y lípidos, particularmente con membranas biológicas. Una pequeña cantidad se absorbe en la sangre; su reactividad extrema limita su habilidad de acumularse. Es posible que haya efectos secundarios caracterizados por un defecto en la disociación del oxígeno de la oxihemoglobina. Incluso en niveles de exposición de ozono de 0.1 ppm, puede resultar en un envejecimiento prematuro si la exposición es lo suficientemente prolongada
Además, debido a su habilidad oxidante, a muy altas concentraciones puede causar irritación en la piel y ojos.
A largo plazo, los efectos potenciales que se han detectado han sido jaqueca, irritación de nariz y garganta, constricción del pecho y congestión pulmonar en trabajadores expuestos.
Se cree que el ozono actuará de manera sinérgica con otros materiales, ya que tras un estudio en ratas, los animales expuestos al ozono con anterioridad a una exposición a polvillo de amianto o asbesto, la concentración pulmonar de amianto fue superior en los pulmones un mes después que los animales no expuestos a ozono. Por otra parte, no se observó sinergia entre el ozono y el ácido sulfúrico o dióxido de nitrógeno.14
En cuanto al uso de ozono en industrias, no se considera satisfactoria la detección de fugas por el olor porque incluso fugas ligeras causan la insensibilidad de sentido olfativo y llevan a la falsa conclusión de que la fuga ya no existe, por lo que se deben emplear detectores de ozono para advertir de forma sonora y visual las fugas.
Tras ser empleado en la industria u otras técnicas de forma artificial, para ser liberado de nuevo a la atmósfera debería pasar a través de un equipo destructor de ozono que provoque la descomposición de ozono a oxígeno, o ser liberado de modo que no represente ningún peligro.
Concentración ppm. Descripción de los efectos
| Concentración O3 | Efectos que produce |
|---|---|
| 0,003 - 0,01 | Umbral de percepción olfativa por promedio por
persona en aire limpio.
|
| 0,02 - 0,04 | Promedio representativo de concentraciones totales de oxidante en la mayoría de
las ciudades de los E. U. A. en 1964. Aprox. el 95 % de los oxidantes es ozono
|
| 0,1 | Límite recomendado de exposición. A menudo experimentada irritación de ojos, nariz y garganta. |
| 0,2 - 0,5 | Reducida adaptación a la oscuridad y alteración del equilibrio del músculo extra ocular:ocurre tras varias horas de exposición. |
| 0,5 | A veces se producen náuseas y dolor de cabeza. Exposiciones prolongadas pueden producir edema pulmonar y propiciar la susceptibilidad frente a infecciones respiratorias (ambas bacterianas y virales). |
| 1,0 | 10 minutos de exposición reduce la tasa de saturación de oxihemoglobina al 50%. |
| 1 - 2 | Exposición crónica (un año seis horas al día) ha resultado en bronquiolitis y bronquitis en animales |
| 1,5 - 2 | Exposición de dos horas resulta en tos, dolor subrenal y esputo excesivo. |
| 5 - 25 | Experimentalmente se ha visto que tres horas de exposición a 12 ppm fue mortal para ratas, humanos (soldadores) expuestos a 9 ppm desarrollaron edemas pulmonares. |
| 50 - 30 | minutos de exposición puede ser fatal. |
Tabla1.- Relación de la concentración de ozono frente a los efectos que produce en el organismo
Primeros auxilios
Si una persona se ve afectada por el ozono se deben tomar las siguientes precauciones:
1) Retirar al paciente a una atmósfera templada no contaminada y desapretar su ropa del cuello y cintura
2) Mantener al paciente en reposo
3) Si el paciente tiene dificultar para respirar, suministrarle oxígeno mediante un equipo apropiado y un operario entrenado.
4) Si la respiración es débil o ha cesado, se deberá iniciar la respiración asistida. Se preferirán los métodos boca-boca o boca nariz.
5) Buscar asistencia médica
6) La intoxicación por ozono debe tratarse sintomáticamente. Deberá incluir reposo, analgésicos para contrarrestar el dolor y antibióticos prescritos por el médico15
Ozono troposférico
A diferencia de la capa de ozono (a nivel estratosférico), el ozono troposférico se encuentra a nivel del suelo, donde tiene lugar la vida en el planeta.
Efectos sobre la salud
Esta molécula es un oxidante muy potente que, en la troposfera, afectará tanto a la vegetación natural como a la producción de cultivos e incluso a la salud humana. En función de la concentración y el tiempo de exposición a los gases, los daños serán más o menos perjudiciales. Puede producir tos, irritaciones en la faringe, irritaciones en la garganta Y en los ojos; dificultades respiratorias, empeoramiento de la función pulmonar O síntomas de malestar general. En verano, por la mayor cantidad de horas de sol, puede alcanzar umbrales muy peligrosos para la salud y, por ello, es necesario hacer un seguimiento muy detallado de sus concentraciones. En el caso de que se superen los 240 microgramos por metro cúbico (nivel de alerta a la población), existe riesgo para la salud humana. Sobre todo durante la hora 10,00 y las 16,00, que son los momentos de máxima concentración. Los niños, ancianos y personas con problemas respiratorios serán los grupos más sensibles.
Esta situación es más común en las regiones mediterráneas, donde coinciden situaciones anticiclónicas con grandes densidades de tráfico. La única manera de reducir las emisiones es reduciendo los precursores NOx, COV, es decir, disminuyendo la cantidad de vehículos en las calles.



No hay comentarios:
Publicar un comentario