Abstracción nucleofílica
La abstracción nucleofílica o abstracción nucleófila es un tipo de reacción organometálica que se puede definir como un ataque nucleófilo sobre un ligando de uncomplejo metálico que hace que parte o la totalidad del ligando original sea retirado del metal quedando secuestrado por el nucleófilo.
Abstracción alquílica
Aunque la abstracción nucleófila de un grupo alquilo es relativamente poco común, hay ejemplos de este tipo de reacción. Para que esta reacción sea favorable, el metal debe primero ser oxidado, porque los metales reducidos son a menudo malos grupos salientes. La oxidación del metal hace que el enlace M-C se debilite, lo que permite que se produzca la abstracción nucleofílica. Un oxidante que se describe en la bibliografía es el I2 Y Br2.3
Es importante tener en cuenta que el producto de esta reacción se invierte con respecto al centro de la estereoquímica unido al metal.
Abstracción carbonílica
El N-óxido de trimetilamina (Me3NO) se puede utilizar en la abstracción nucleófila de carbonilo. Se produce un ataque nucleofílico en el carbono del grupo carbonilo por parte del Me3NO que empuja a los electrones en el metal. La reacción produce CO2 y NMe3.4 5
Abstracción de hidrógeno
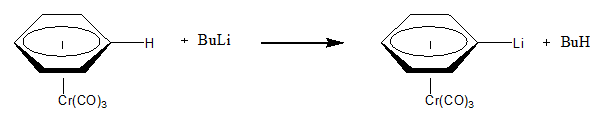
La abstracción nucleofílica puede ocurrir en una parte del ligando de un metal si las condiciones son las adecuadas. Por ejemplo, en el siguiente ejemplo se muestra la abstracción nucleofílica de H+ de un ligando areno unido al cromo. La naturaleza electroatractora (que retira densidad electrónica) del cromo permite la reacción se produzca de una manera fácil.1
Abstracción metílica
Un carbeno de Fischer puede someterse a la abstracción nucleofílica donde se elimina un grupo metilo con la adición de un pequeño agente de abstracción, que ataca al carbono del carbeno. En este caso sin embargo, el volumen estérico del agente de abstracción que se añade provoca la abstracción del grupo metilo. Si el grupo metilo se sustituye con acetato, la reacción se produce unas 70 veces más lenta, lo que es de esperar con un mecanismo de desplazamiento SN2.6
Reacciones nucleofílicas y electrofílicas
Estas reacciones tienen lugar en los compuestos de 18 electrones, ya que esta configuración electrónica les confiere la estabilidad necesaria para sufrir este tipo de reacciones. Asimismo, estas reacciones suelen tener aplicaciones importantes en síntesis orgánica. Las adiciones nucleófilas y electrófilas incluyen también la adición de reactivos simples como el protón y el hidruro. Cuando el nucleófilo es impedido se comporta como una base y cuando el electrófilo es impedido es un abstractor de H-. Así, las adiciones y las abstracciones de H+ y de H-, frecuentes de química organometálica, permiten interconversiones simples entre los compuestos electrófilos y uncleófilos. Esta práctica en corriente con el fin de funcionalizar un ligado según la naturaleza nucleófila o electrófila del reactivo del cual disponemos. Para las aplicaciones en catálisis y en síntesis (Crabtree, 2005).
18.1 ATAQUES NUCLEOFÍLICOS
a. Adiciones
Las adiciones nucleófilas están favorecidas cuando el fragmento organometálico al cual está unido el ligado que sufre el ataque posee un carácter electroatrayente. El fragmento organometálico presenta este carácter electroatrayente cuando el complejo es catiónico o tiene ligandos electroatrayentes, normalmente carbolnilos, sobre el metal del fragmento organometálico. Los factores que determinan este ataque son los controles orbitalario, de carga y estérico. Cuando el fragmento organometálico está cargado positivamente, el control de la carga juega a menudo (pero no siempre) un papel predominante. En ausencia de carga (y a veces incluso cuando el fragmento metálico tiene una carga positiva atenuada por ligandos hidrocarbonados dadores), el control orbitalario predomina. El control estérico juega siempre un papel importante, ya que impone la estereoquímica de la adición. En efecto, en la mayoría de los casos el nucleófilo ataca al ligando en posición exo, es decir, por la cara opuesta al metal. También es frecuente que el efecto estérico juegue un papel importante en al regioselectividad de las reacciones(Astruc, 2007).
Ligandos hidrocarbonados de η2 a η7
Figura 86. Estructura de los ligandos hidrocarbonados más comunes. (Astruc, 2007)
El ataque nucleófilo reduce en una unidad la hapticidad de los ligandos a los que se adiciona. Davies, Mingos y Green establecieron una serie de reglas que nos permiten predecir, cuando se da control de carga, cuál es el lugar donde se producirá la adición, es decir, la regioselectividad del ataque si varios ligandos o posiciones de un ligando están en competición Estas reglas se respetan con el orden de prioridad siguiente:
- Los ligandos pares reaccionan antes que los ligandos impares.
- Los ligandos abiertos reaccionan antes que los ligandos cíclicos.
- En los polienos y polienilos abiertos, la reacción se produce sobre el carbono terminal del ligando.
Reacciones de nucleófilos con ligandos carbonados n1: CO, CNR, CR2
Los ataques de carbaniones a carbonilos metálicos dan lugar a carbenos metálicos. En efecto, los complejos de acilo aniónicos (acilmetalatos) obtenidos son mesómeros de los carbenos.
Los complejos tipo carbeno pueden sufrir una adición nucleófila:
Así, el ligando CO puede ser reducido a ligando metilo, lo que constituye un modelo para la catálisis heterogénea Fischer-Tropsch. En esta reacción se produce la reacción de CO mediante H2 dando lugar a un alcano. Para esta reacción se utiliza un catalizados de hierro(Astruc, 2007):
El ligando CNR (isonitrilo), isoelectrónico de CO, es también muy sensible a los ataques nucleófilos, incluso neutros; por ejemplo, el producto final de la reacción con la anilina es un carbeno.
b. Sustituciones
La adición de un nucleófilo a un compuesto aromático que está coordinado a un fragmento organometálico de 12 electrones como Cr(CO)3, FeCp+ o Mn(CO)3+ da lugar a un complejo de ciclohexadienilo. El átomo de hidrógeno endodel C sp3 no es un buen grupo saliente (como hidruro), por lo que el complejo formado es estable. Sin embargo, en el caso de un halogenoareno, es el carbono ipso el que está unido al halógeno, el que sufre el ataque de nucleófilos oxigenados, nitrogenados o azufrados. El halógeno que se encuentra en posición endoen el complejo de ciclohexadienilo es un buen grupo saliente como haluro. Las sustituciones de halógenos, muy difíciles en química orgánica, pueden tener lugar en condiciones suaves coordinado temporalmente el compuesto aromático a un fragmento organometálico de 12 electrones (activa la reacción)(Astruc, 2007). Estas sustituciones nucleófilas son tanto más fáciles cuanto más electroatrayente sea el fragmento organometálico. Así, tenemos el orden de activación siguiente:
Cr(CO)3
Por ejemplo, una amina primaria no puede reaccionar con [Cr(C6H5Cl)(CO)3], y es necesarios, en este caso, utilizar el amiduro NHR-. Sin embargo, la reacción con la misma amina tiene lugar cuando el aromático está coordinado al fragmento FeCp+, salvo si se trata de una mina aromática (anilina) menos reactiva. En este último caso, es posible efectuar la reacción utilizando un fragmento que activa extremadamente la reacción, como el Mn(CO)3+(Crabtree, 2005).
c. Desprotonaciones
Los complejos catiónicos que poseen un grupo CH3,NH2 u OH en posición β respecto al metal pueden ser fácilmente desprotonados:
Es más fácil desprotonar el complejos sobre el metal o en posición α:
d. Reacción de transferencia de electrones parásita
Para todas las reacciones nucleófilas, se ha supuesto el solapamiento de orbitales adecuado entre los dos reactivos, lo que implica al menos que la diferencia de carga entre los dos reactivos no supere las dos unidades. Si esta diferencia de carga entre los dos sustratos alcanza o sobrepasa las dos unidades, observamos a menudo una transferencia de electrones desde el nucleófilo hacia el electrófilo:
Esta transferencia se evita trabajando a baja temperatura. Las reacciones de transferencia de electrones están favorecidas con la temperatura(Astruc, 2007).
18.2 REACCIONES CON ELECTRÓFILOS
a. Adiciones
Los electrófilos pueden adicionarse:
- A una instauración conjugada con un ligando situada en posición β respecto al metal:
- En γ respecto al metal:
- Directamente al metal (lo que implica una adición oxidante especial):
b. Sustituciones
Estas reacciones tienen lugar sobre los ligandos; sin embargo, algunas veces se producen después de un ataque previo al metal conduciendo a una estereoquímica endo. Según el mecanismo, tendremos, pues, una estereoquímica endooexo, mientras que las adiciones nucleófilas, como ya hemos visto, son siempre exo.
Las sustituciones electrófilas más extendidas conciernen a la química del ferroceno. El ferroceno es un compuesto aromático particularmente reactivo debido a su riqueza electrónica. Por ejemplo, el ferroceno sufre la reacción de acilación debido a su riqueza electrónica. Por ejemplo, el ferroceno sufre la reacción de acilaciónelectrófila 3 * 106 veces más rápido que el benceno. El mecanismo implica el ataque directo a un ciclo en exopor electrófilos “duros”, tales como el ión CH3CO+, y en el caso de los electrófilos “blandos” como el HgII, el ataque tiene lugar en el metal para formar un intermedio de hierro (IV) seguido de un ataqueendo en un ciclo. El mecanismo de las reacciones de acilación se presenta a continuación(Astruc, 2007):
Figura 87. Mecanismo de las reacciones de acilación. (Astruc, 2007)
En presencia de un exceso de ión acilio, el ciclo que ya ha reaccionado está desactivado porque el sustituyente acilo es electroatrayente. El otro ciclo, aunque menos reactivo que el ferroceno, debido a la transmisión del efecto electrónico por el hierro, sufre el segundo ataque. Este segundo ataque es, pues, más lento que el primero, lo que permite obtener selectivamente el monoacetilferroceno si adicionamos el ión acilio CH3CO+AlCl4- gota a gota sobre una disolución de ferroceno. En presencia de un exceso reactivo, la reacción se detiene después de la segunda sustitución. Para obtener selectivamente el diacetilferroceno basta con adicionar una disolución de ferroceno gota a gota sobre una disolución del ión acilio en ligero exceso con relación a la estequiometría, 2CH3CO+/1FeCp2. Esta selectividad no se puede obtener con un halogenuro de alquilo, al ser grupo alquilo electrodador y el ciclo monosustituido todavía un poco más reactivo que el ferroceno. La consecuencia es que la reacción da lugar a una mezcla de productos polialquilados (Crabtree, 2005).
Se conocen un gran número de reacciones de sustitución electrófila en la química del ferroceno, pero existe una limitación importante que impide utilizar electrófilos muy oxidantes. El ferroceno se oxida fácilmente a catión ferrocinio, por ejemplo, con H2SO4 los ciclos del ferrocinio son inertes frente a la sustitución electrófila.
18.3 REACCIONES DE ABSTRACCIÓN
a. Abstracción de hidruro
El catión tritilo, como sal Ph3C+BF4-, es el reactivo clásico que permite arrancar, por ejemplo, un hidruro situado en un carbono en posición β respecto al metal:
A veces, esta abstracción puede hacerse en α, obteniendo de esta forma un complejo alquilideno metálico:
b. Abstracción de un anión inorgánico
De manera análoga, es posible abstraer, con ayuda del catión Ph3C+, otros aniones inorgánicos como F- u OH-:
El compuesto formado, muy estable, se considera como un complejo de fulvalenohexahapto de 18 electrones más que como un carbocatión. El ángulo de pliegue del doble enlace exocíclico hacia el hierro es de 21º, lo que indica claramente que este doble enlace está coordinado al hierro (Rodgers, 2012).
c. Abstracción de grupos alquilo
c. Abstracción de grupos alquilo
Este mismo tipo de reacción ha permitido sintetizar el precursor del complejo de tántalo-metileno de Schrock:
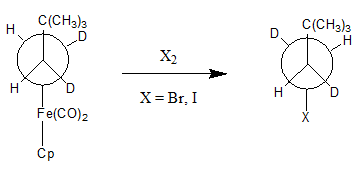


No hay comentarios:
Publicar un comentario