Cantarella
La Cantarella o Acquetta di Perugia es un veneno inodoro, incoloro e insípido; obtenido mezclando arsénico con vísceras de cerdo secas. Presentándose como un polvo blanco similar al azúcar. Se considera un veneno muy tóxico que provoca la muerte, tras atroces tormentos, en veinticuatro horas. Se dice que fue el arma básica utilizada por los Borgia, según la leyenda negra creada por sus enemigos, en torno a la vida de esta familia.
Una supuesta forma de preparación era sacrificando un cerdo y de él se sacaba sus entrañas rociándolas con arsénico, las cuales se colocaban en una vasija de cobre durante treinta días, aguardando su total putrefacción. Cumplido dicho lapso, se sacaba la masa putrefacta y se recogían los líquidos, los mismos que se desecaban para obtener una cristalización, resultando una especie de polvo blanquecino parecido al azúcar. Dicho polvo blanquecino se lo depositaba en una cajita de metal, preferiblemente de oro.
Carbonato de lantano
El carbonato de lantano es la sal formada por el catión de lantano (III) y el anión decarbonato. Es usado como una fuente de lantano para la producción de estado sólido del manganato de estroncio de lantano, primariamente para aplicaciones en celdas de combustible de óxido sólido. También es usado para el teñido de de vidrio y para el tratamiento del agua, o como un catalizador para el craqueo de hidrocarburo. Adicionalmente, junto con la monazita, es un mineral del metal de lantano.
En medicina, el carbonato de lantano es un medicamento de acción quelante conocido como quelante de fosfato, vendido bajo el nombre comercial de Fosrenol por la compañía farmacéutica Shire Pharmaceuticals Group. Se prescribe para el tratamiento de la hiperfosfatemia, primariamente para pacientes con insuficiencia renal crónica. Se toma con las comidas y se enlaza con el fosfato de la dieta, evitando que el fosfato sea absorbido por el intestino.
El carbonato de lantano es un quelante del fósforo, libre de calcio y aluminio, de reciente comercialización en España. Se trata de un metal pesado con nula absorción intestinal que no presenta toxicidad. En la ficha técnica del producto en nuestro país, no se cita el fenómeno de aparición de imágenes radiológicas. No ocurre así en la versión americana, donde se advierte que "pueden aparecer imágenes radioopacas en la radiografía abdominal en pacientes consumidores de lantano"1. Las reacciones adversas notificadas con mayor frecuencia fueron gastrointestinales, pero en los ensayos clínicos no se incluyeron pacientes con obstrucción intestinal ni enfermedad inflamatoria intestinal2.
Presentamos el caso de un hombre de 58 años, con diverticulosis pancolónica y frecuentes episodios de diverticulitis, con ERC secundaria a nefropatía diabética e inicio de programa de hemodiálisis periódica en abril de 2001. Ingresa en julio de 2008 por fiebre y dolor abdominal. Se realiza una TAC abdominal urgente que descarta signos de diverticulitis, pero es informado por el radiólogo como "restos de contraste en todo el colon e íleon terminal" (figura 1), imagen confirmada en una radiografía simple de abdomen (figura 2). Nuestro paciente no había recibido contraste radiológico en ningún momento, pero estaba siendo tratado con 3.000 mg diarios de carbonato de lantano desde febrero de este año por hiperfosforemia grave, con excelentes resultados analíticos y buena tolerancia clínica hasta el momento. El diagnóstico final fue de sepsis por Enterococo avium, de probable origen intestinal. Dado que no se encontraron otros hallazgos en las pruebas de imagen que justificaran el dolor abdominal, se suspendió el tratamiento con lantano, permaneciendo posteriormente asintomático.
Figura 1. TAC abdominal sin contraste que muestra
depósito de carbonato de lantano en los divertículos
del colon sigmoides y en recto.
Figura 2. Radiografía simple de abdomen sin contraste
que muestra múltiples opacidades centriméticas de
distribución irregular en la periferia del marco cólico,
que reflejan depósito de lantano en los divertículos.
De cara a estudiar el hallazgo, se realizó una radiografía simple de abdomen a otra paciente que estaba recibiendo la misma dosis del metal, y que no había manifestado clínica digestiva. También se observó el depósito en todo el marco cólico, pero con un patrón radiológico diferente (figura 3).
Figura 3. Radiografía simple de abdomen sin contraste
que muestra material radioopaco en todo el marco cólico
de distribución difusa. Pertenece a otra paciente consumidora
de la misma dosis de lantano, pero sin clínica abdominal.
Las referencias en la literatura que describen este fenómeno son escasas y con variadas explicaciones. La primera imagen radiológica atribuida al consumo de lantano que hemos encontrado fue mostrada por Cerny y Kunzendorf3 en 2006. En este caso, se suspende el fármaco porque, a la vista de la radiografía, consideran que el dolor abdominal que refiere el paciente podría estar relacionado con el lantano. Posteriormente, se han notificado otros casos4. David et al.5 interpretan la radiología como depósito intestinal de piedras de fosfato cálcico que prueban la eficacia como quelante del lantano, e incluso sugieren que la imagen observada se puede utilizar como test de cumplimiento terapéutico. Esta teoría es desmentida por Pafcugova et al.6, que demuestran la radioopacidad de los comprimidos por sí mismos en un vial, en ausencia de calcio o fósforo. No obstante, dada la corta experiencia con el uso de este fármaco, especialmente en nuestro país, aún no parece estar claro su patrón radiológico de distribución abdominal, ni si se observa en todos los pacientes que reciben esta medicación. Vrigneaud et al.7 estudian a 13 enfermos tratados con lantano; en seis de ellos, la radiología simple de abdomen es completamente normal, mientras que en el resto sí se observa el depósito radioopaco. Sin embargo, diferencian las imágenes habituales de opacidades subcentimétricas regularmente repartidas por todo el marco cólico de 2 casos en los que eran de mayor tamaño y de distribución irregular a lo largo del tracto digestivo: se trataba de un paciente que no masticaba correctamente los comprimidos, y de otro individuo con diverticulosis colónica en el que el patrón sugiere depósito del material en los divertículos, como en el caso que nos ocupa.
Como conclusiones, destacamos que, aunque por el momento todavía existen pocos datos sobre el comportamiento radiológico del depósito intestinal del carbonato de lantano, su radioopacidad es de obligado conocimiento. Además, es probable que en pacientes con patología intestinal debamos utilizar el fármaco con cautela. Por otra parte, tampoco se conoce su tiempo de eliminación, de vital importancia a la hora de realizar otros estudios de imagen para evitar interferencias. Por último, creemos que sería conveniente la inclusión de todo ello en la ficha técnica del fármaco en nuestro país.
Cardiotoxicidad
La cardiotoxicidad1 es una alteración cuantitativa o cualitativa en el corazón debido a los fármacos u otras sustancias tóxicas para este órgano. Puede evolucionar ainsuficiencia cardiaca o arritmias.
Tipos
Existen diferentes tipos de cardiotoxicidad:
- Cardiotoxicidad aguda: Durante el tratamiento. Se manifiesta con taquicardias supraventriculares. Desaparece al interrumpir el tratamiento.
- Cardiotoxicidad crónica: Hasta 30 meses después de la última dosis. A los tres meses desarrolla miocardipatía degenerativa que culmina en insuficiencia cardiaca congestiva (ICC). Dentro de esta existe una subcategoria que es la cardiotoxicidad tardía que aparece de 6 a 12 años después del tratamiento. Se manifiesta como una recaída en recuperados de una cadiotoxicidad aguda.
Mecanismos de producción
La capacidad mecánica del corazoón depende de la potencia del miocardio o músculo cardiaco y del caudal de sangre que puede circular por el lecho vascular. El lecho vascular es afectado por los vasocontrictores, vasodilatadores y vasopermeabilizantes que provocan petiquias, eritemias, sufusiones hemorrágicas y edemas locales o generalizados. El mecanismo de contracción muscular se inicia con un intercambio de Na+, K+, Cl-, Mg2+, Ca2+ entre la célula y el medio. De todos estos cationes los más importantes y abundantes en el miocardio son el Na+ y el K+.
Cuando un estímulo llega al corazón se produce una entrada de cationes de Na+ y una salida de K+.Todo esto es controlado por la Bomba de Sodio. Pero esto no se produciría sin la intervención de las enzimas Na+-ATPasa para la entrada de Na+, y la K+-ATPasa para la salida de K+.
Pero también cuando el estímulo alcanza la fibra muscular, penetran por unos poros Ca2+ que gracias al ATP permite el deslizamiento de la actina sobre la miosina y así producirse la contracción muscular. Los fármacos actúan aumentando la cantidad de iones de Ca2+ libres en el interior de la célula miocárdica, con lo que se incrementa la excitación de la membrana y el rendimiento muscular. Cuando hay una sobrecarga de Ca2+, se produce un trastorno y el producto actúa como cardiotóxico.
Todos estos mecanismos fisiológicos pueden ser alterados por numerosas sustancias químicas originándo:
- Trastornos del ritmo o disritmias, debidos al consumo de alcohol, tabaco, anfetaminas.
- Insuficiencia cardiaca o incapacidad para mantener el flujo sanguíneo. Se produce realmente por una falta de potencia muscular.
- Miocarditis tóxica. Se altera el flujo de calcio.
Toxinas producidas por organismos
Son numerosos péptidos naturales endógenos y exógenos son cardiotóxicos. Por un lado hay péptidos de carácter hormonal que ejercen sobre los mamíferos actividad cardiodepresora y vasocontrictora, y por otro lado, las toxinas que son segregadas por las plantas y los animales inferiores que producen lesiones sobre la membrana y afectan a la captación de Na+ y Ca2+.
- Celentéreos: Intenso dolor pudiendo ocurrir la muerte por paro cardiaco o respiratorio. Retrasan la inactivación de los canales rápidos de Na+, con un incremento de Na+ y Ca2+ intracelulares y pérdida de K+.
- Moluscos: Produce depresión de la contractibilidad del miocardio.
- Artrópodos: Sintetizan toxinas por mordedura o picadura.
- Serpientes: La acción cardiotóxica es realizada por un grupo de polipéptidos muy básicos que producen también el bloqueo de la conducción axonal en nervios periféricos y originan contracturas seguidas de parálisis en los músculos esqueléticos.2
Tipos de tóxicos cardiacos
En este apartado vamos a hablar de los diferentes tipos de tóxicos que afectan al sistema cardiovascular. Se pueden dividir en 3 grupos principales:
- Fármacos
- Sustancias originadas por organismos
- Productos industriales.
Fármacos
Los efectos cardiotóxicos de los fármacos que actúan sobre el sistema cardiovascular suele consistir en una exageración principal de su acción farmacológica sobre el corazón; son capaces de inducir arritmias si estos fármacos se administran en dosis excesivas. En cambio otros agentes pueden ser tóxicos para el corazón a través de mecanismos que no están relacionados necesariamente con el uso terapéutico que se pretende ni con sus efectos farmacológicos principales. Dentro de estos fármacos nos podemos encontrar diferentes tipos:
- Fármacos antiarrítmicos e inotrópicos: Aquí nos encontramos con glucósidos cardíacos que se emplean para tratar la insuficiencia cardíaca congestiva, inhiben laPasa de Na+, K+, y aumentan el sodio intracelular. También están incluidas las catecolamidas y simpaticomiméticos, cuya cardiotoxicidad inducida se manifiesta por aumentos en la frecuencia cardíaca, por la demanda de oxígeno en el miocardio y de la presión arterial sistólica. Y por último, las antraciclinas y otros agentes antineoplásicos que tienen efectos tóxicos agudos como taquicardias y varias arritmias; lo más probable es que se deban a la fuerte liberación de histamina por los mastocitos.
- Fármacos de acción central: Como antidepresivos y antisépticos, que pueden producir reducción del gasto cardíaco, proarritmias, parada cardíaca y otros síntomas debido al bloqueo de los canales de Ca2+, Na+, K+. También encontramos anestésicos generales y anestésicos locales y otros como la cocaína que disminuyen el gasto cardíaco e impiden la conducción nerviosa mediante la inhibición reversible de los canales de Na.
Sustancias producidas por animales
Dentro de este otro grupo nos encontramos distintos tipos de esteroides, estrógenos, progestinas, andrógenos y hormonas tiroideas. Por lo general, estas suelen tener menos manifestaciones tóxicas que los fármacos. Por ejemplo los estrógenos alteran la proliferación de los fibroplastos cardíacos, otros ejercen efectos contrapuestos a estos estrógenos, hipertrofia cardíaca, fibrósis cardíaca e insuficiencia cardíaca.
Productos industriales
- Alcohol: Una intoxicación aguda por este tóxico produce retraso de la conducción y descenso del umbral para entrar en fibrilación ventricular (excitación repetida y rápida de los ventrículos). El consumo prolongado de etanol se asocia a alteraciones miocárdicas, arritmias y un proceso conocido como miocardiopatíaalcohólica.
- Disolventes: que actúan a través del sistema nervioso, que es el responsable de regular la actividad eléctrica del corazón.
- Alcanos halogenados: Sus propiedades intensamente lipófilas les permiten atravesar fácilmente la barrera hematoencefálica, donde producen depresión en el Sistema Nervioso Central (SNC).
- Metales pesados: Estos tienen efectos tóxicos inotrópicos y dromotrópicos negativos y también pueden producir hipertrofia cardíaca.
Introducción
Con el advenimiento de nuevas terapias para el manejo de las neoplasias se ha logrado un gran impacto en la sobrevida de los pacientes con cáncer, convirtiendo a esta enfermedad, en muchos casos, en una patología crónica, tal como la diabetes o la hipertensión. Y a su vez, estos avances han generado otros problemas asociados a los efectos adversos de los fármacos utilizados1.
Las complicaciones cardiovasculares son un efecto ampliamente conocido de la quimioterapia desde 1967, cuando se reportaron los primeros casos de falla cardíaca en niños con leucemia que recibían altas dosis de antraciclinas2. La cardiotoxicidad se define según The National Cancer Institute3 como "la toxicidad que afecta al corazón". Sin embargo, este concepto es muy simple y puede tener muchas interpretaciones por lo que quizás una de las más completas y útiles es la propuesta por los grupos de investigación y supervisión del trastuzumab (anticuerpo monoclonal humanizado IgG1 contra el receptor 2 del factor de crecimiento epidérmico humano -HER2-) los cuales consideran que existe toxicidad cardiovascular si se cumple uno o más de los siguientes criterios (Figura 1)4:
1- Cardiomiopatía con disminución de la fracción de eyección.
2- Presencia de síntomas de falla cardíaca.
3- Presencia de signos de falla cardíaca.
4- Disminución de menos del 5% de la fracción de eyección basal o fracción de eyección del ventrículo izquierdo (FEVI) menor al 55% con síntomas.
5- Disminución de más del 10% de la fracción de eyección basal o FEVI menor al 55% sin síntomas.
Las complicaciones cardiovasculares son un efecto ampliamente conocido de la quimioterapia desde 1967, cuando se reportaron los primeros casos de falla cardíaca en niños con leucemia que recibían altas dosis de antraciclinas2. La cardiotoxicidad se define según The National Cancer Institute3 como "la toxicidad que afecta al corazón". Sin embargo, este concepto es muy simple y puede tener muchas interpretaciones por lo que quizás una de las más completas y útiles es la propuesta por los grupos de investigación y supervisión del trastuzumab (anticuerpo monoclonal humanizado IgG1 contra el receptor 2 del factor de crecimiento epidérmico humano -HER2-) los cuales consideran que existe toxicidad cardiovascular si se cumple uno o más de los siguientes criterios (Figura 1)4:
1- Cardiomiopatía con disminución de la fracción de eyección.
2- Presencia de síntomas de falla cardíaca.
3- Presencia de signos de falla cardíaca.
4- Disminución de menos del 5% de la fracción de eyección basal o fracción de eyección del ventrículo izquierdo (FEVI) menor al 55% con síntomas.
5- Disminución de más del 10% de la fracción de eyección basal o FEVI menor al 55% sin síntomas.
Figura 1. Definición de cardiotoxicidad según los criterios del Grupo de Investigación del trastuzumab.
FEVI: fracción de eyección del ventrículo izquierdo.
Los eventos cardiovasculares secundarios al tratamiento oncológico pueden ocurrir días o semanas después del manejo o algunas veces meses o años, luego de terminada la quimioterapia, por lo cual pueden abarcar un amplio espectro de manifestaciones que incluyen: aumento transitorio de las cifras tensionales, arritmias, isquemia miocárdica, insuficiencia cardíaca, vasculopatía periférica y pericardiopatía. Muchas veces estas manifestaciones son confundidas con las secuelas de los tumores, o con los síntomas asociados al cáncer como la fatiga y las comorbilidades previas, ocasionando que en reiteradas ocasiones sean infra-diagnosticadas y por lo tanto sub-tratadas5.
En el pasado, la cardiotoxicidad era percibida como una complicación muy rara y poco importante del manejo antineoplásico. Actualmente, se sabe que las antraciclinas, el 5-fluorouracilo con su prodroga capecitabine y el trastuzumab se asocian con el desarrollo de insuficiencia cardíaca hasta en un 20% de los pacientes que han recibido estos fármacos6.
En esta revisión se resumen los principales síndromes relacionados con la toxicidad cardíaca, su fisiopatología y cómo poder enfocar adecuadamente cada uno con las ayudas diagnósticas y terapéuticas en la actualidad con un enfoque práctico para el clínico.
En el pasado, la cardiotoxicidad era percibida como una complicación muy rara y poco importante del manejo antineoplásico. Actualmente, se sabe que las antraciclinas, el 5-fluorouracilo con su prodroga capecitabine y el trastuzumab se asocian con el desarrollo de insuficiencia cardíaca hasta en un 20% de los pacientes que han recibido estos fármacos6.
En esta revisión se resumen los principales síndromes relacionados con la toxicidad cardíaca, su fisiopatología y cómo poder enfocar adecuadamente cada uno con las ayudas diagnósticas y terapéuticas en la actualidad con un enfoque práctico para el clínico.
Principios básicos de quimioterapia para entender la cardiotoxicidad
Los primeros fármacos eficaces contra el cáncer aparecieron a principios de la década de 1940, cuando los marineros de un barco se expusieron accidentalmente a la mostaza nitrogenada. Como resultado de esto, presentaron disminución del conteo leucocitario e hipoplasia del tejido linfoide. Este hallazgo fue utilizado posteriormente por Goodman y Gilman para tratar un hombre con linfoma avanzado con respuesta parcial; de ahí en adelante, han aparecido diversas moléculas que interfieren con la biología de las células tumorales (Figura 2)7.
Para comprender adecuadamente los mecanismos de acción de los antineoplásicos es necesario conocer cómo se desarrolla el cáncer y los factores que contribuyen a ello. En primer lugar, es importante mencionar que las neoplasias se originan de alteraciones de uno o más genes en el organismo, éstas pueden ser hereditarias (que pasan de generación en generación) o adquiridas por el daño del material genético. Hay dos tipos de genes responsables de la aparición de tumores: los oncogenes que al mutar promueven una proliferación no controlada de las células y los genes supresores de tumor que normalmente están encargados de evitar una replicación desmedida de las células; por lo que cualquier daño en éstos llevaría a la aparición de cáncer. La identificación de estas anormalidades abre una puerta para el desarrollo de la terapia genética en un futuro, actualmente no existen medicaciones aprobadas para este uso8.
El cáncer aparece a su vez cuando una célula en particular se escapa de los controles habituales, generando la formación de una descendencia igualmente anormal. Los factores de crecimiento y sus receptores en la membrana son fundamentales para la división celular. Algunos genes pueden afectar directamente este sistema, causando sobreproducción o sobreexpresión de estas moléculas lo cual produce un estímulo constante para la replicación. Existen dos familias de receptores importantes en la oncología: los receptores de estrógenos y los receptores tirosin kinasa. Los primeros son utilizados principalmente en el manejo del cáncer de mama y próstata, pero no es frecuente la cardiotoxicidad, a excepción del tamoxifeno que se ha relacionado con eventos trombóticos como se mencionará posteriormente.
El genoma humano contiene alrededor de 100 genes que codifican tirosin kinasas. Estas son una familia de enzimas cuya función es regular la división celular, la apoptosis y otras múltiples funciones. Hay tres tipos de genes pertenecientes a esta familia que son de particular importancia en el manejo actual del cáncer: el receptor del factor de crecimiento epidérmico (RFCE), el receptor del factor de crecimiento del endotelio vascular (RFCEV) y las tirosin kinasas no dependientes del receptor9.
Los RFCE son una familia que se encuentra normalmente en las células epiteliales cuyos principales miembros son el HER2, HER3, HER4 y el RFCE. Estos están formados por un dominio extracelular en donde se une el factor de crecimiento y un dominio intracelular que posee acción enzimática. Una vez que se unen estas proteínas a su receptor, éste se dimeriza (formación de pares) y se produce la activación bioquímica cuyo resultado final es la proliferación. Se han desarrollado anticuerpos monoclonales que se unen directamente al receptor inhibiendo la unión con el factor decrecimiento lo que permite bloquear la proliferación, dentro de estas moléculas se encuentra el trastuzumab utilizado en cáncer de mama y el cetuximab que tiene uso en el cáncer avanzado de colon, mama y ovario10.
Una vez que se inicia el crecimiento de la masa tumoral, ésta requiere una adecuada vascularización. Ello implica que las células tumorales tienen que producir factores que favorezcan la formación de nuevos vasos o la ramificación de los cercanos, proceso conocido como angiogénesis. La principal proteína relacionada es FCEV, por lo cual se ha creado el bevacizumab que es un anticuerpo capaz de bloquear el receptor tirosin kinasa de este factor de crecimiento inhibiendo la angiogénesis10.
Las tirosin kinasas no relacionadas con receptores son enzimas citoplasmáticas que se autoestimulan por anormalidades celulares, como ocurre en la leucemia mieloide crónica en donde la traslocación de cromosomas 9 y 22 produce un gen de fusión conocido como BCR-ABL que lleva a una división celular no controlada. Estas enzimas pueden ser inhibidas por drogas como el imatinib, dasatinib, sunitinib, entre otras12.
Para que se lleve a cabo la replicación celular es fundamental el proceso de mitosis, con la duplicación del material genético y la formación de dos células hijas. En este punto es donde los citotóxicos clásicos actúan interrumpiendo este proceso. Estos medicamentos se dividen en agentes alquilantes, análogos de los platinos, antimetabolitos, inhibidores de la topoisomerasa I y II y agentes anti microtúbulos13.
Los agentes alquilantes fueron los primeros fármacos descubiertos, como se describió previamente. El grupo alquil resulta de la pérdida de un átomo de hidrógeno en un grupo de hidrocarbono alifático o aromático lo cual lleva a formar enlaces covalentes con otros compuestos. La principal acción es atacar el nitrógeno de la guanina en el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). Al encontrarse dos grupos alquil se forman enlaces que no se pueden romper en el momento de la replicación celular, llevando a detener este proceso. Dentro de los principales agentes alquilantes se encuentran la ciclofosfamida, la ifosfamida, la dacarbazina y el clorambucil13.
Los análogos de los platinos se desarrollaron al observar cómo se inhibía el crecimiento bacteriano al pasar una corriente eléctrica a través de dos electrodos de platino. La activación de estos medicamentos lleva a formar puentes cruzados con el ADN de manera similar que los agentes alquilantes, como ejemplo se encuentra el cisplatino y el oxaliplatino13.
Los antimetabolitos fueron la segunda familia de medicamentos en descubrirse. EL ADN está compuesto de miles de subunidades denominadas nucleótidos, que a su vez están formados por tres componentes: un grupo fosfato, una pentosa y una base nitrogenada que puede ser una purina o pirimidina. Para que estas últimas puedan formarse, es fundamental el ácido fólico como co-enzima. El proceso metabólico se inicia con la conversión a ácido folínico posteriormente a dihidrofolato y finalmente a tetrahidrofolato por la enzima dihidrofolato reductasa. El metotrexate inhibe la formación de ácido folínico a partir de ácido fólico. Otros medicamentos como la mecartopurina o la pentostatina detienen la formación de purinas. El fluorouracil, el capecitabine, el gemcitabine y el tegafur impiden la síntesis de pirimidinas13.
La topoisomerasas son enzimas que ayudan en la síntesis de ADN y mantienen su estructura, al inhibirlas se producen rupturas en las cadenas, lo que finalmente lleva a la muerte de la célula. Las antraciclinas como doxorrubicina, epirrubicina y mitoxantrona actúan directamente sobre la topoisomerasa II y son capaces además de producir radicales de oxígeno que finalmente desencadenan la apoptosis13.
Una vez que la célula tumoral ha completado el proceso de síntesis y duplicación del material genético, se produce el proceso de la mitosis el cual requiere la formación del huso mitótico (conjunto de microtúbulos que tiene como función conducir a los cromosomas durante los procesos de reproducción celular a cada una de las células hijas). Esta estructura requiere el ensamblaje de los microtúbulos, proceso que a su vez es inhibido por agentes como los taxanos (paclitaxel) o los alcaloides vinca que va llevar a detener la mitosis13. De esta forma y para tener en mente el tipo de medicamentos utilizados en los tratamientos oncológicos, teniendo en cuenta su mecanismo de acción se clasifican según la Tabla 1.
El cáncer aparece a su vez cuando una célula en particular se escapa de los controles habituales, generando la formación de una descendencia igualmente anormal. Los factores de crecimiento y sus receptores en la membrana son fundamentales para la división celular. Algunos genes pueden afectar directamente este sistema, causando sobreproducción o sobreexpresión de estas moléculas lo cual produce un estímulo constante para la replicación. Existen dos familias de receptores importantes en la oncología: los receptores de estrógenos y los receptores tirosin kinasa. Los primeros son utilizados principalmente en el manejo del cáncer de mama y próstata, pero no es frecuente la cardiotoxicidad, a excepción del tamoxifeno que se ha relacionado con eventos trombóticos como se mencionará posteriormente.
El genoma humano contiene alrededor de 100 genes que codifican tirosin kinasas. Estas son una familia de enzimas cuya función es regular la división celular, la apoptosis y otras múltiples funciones. Hay tres tipos de genes pertenecientes a esta familia que son de particular importancia en el manejo actual del cáncer: el receptor del factor de crecimiento epidérmico (RFCE), el receptor del factor de crecimiento del endotelio vascular (RFCEV) y las tirosin kinasas no dependientes del receptor9.
Los RFCE son una familia que se encuentra normalmente en las células epiteliales cuyos principales miembros son el HER2, HER3, HER4 y el RFCE. Estos están formados por un dominio extracelular en donde se une el factor de crecimiento y un dominio intracelular que posee acción enzimática. Una vez que se unen estas proteínas a su receptor, éste se dimeriza (formación de pares) y se produce la activación bioquímica cuyo resultado final es la proliferación. Se han desarrollado anticuerpos monoclonales que se unen directamente al receptor inhibiendo la unión con el factor decrecimiento lo que permite bloquear la proliferación, dentro de estas moléculas se encuentra el trastuzumab utilizado en cáncer de mama y el cetuximab que tiene uso en el cáncer avanzado de colon, mama y ovario10.
Una vez que se inicia el crecimiento de la masa tumoral, ésta requiere una adecuada vascularización. Ello implica que las células tumorales tienen que producir factores que favorezcan la formación de nuevos vasos o la ramificación de los cercanos, proceso conocido como angiogénesis. La principal proteína relacionada es FCEV, por lo cual se ha creado el bevacizumab que es un anticuerpo capaz de bloquear el receptor tirosin kinasa de este factor de crecimiento inhibiendo la angiogénesis10.
Las tirosin kinasas no relacionadas con receptores son enzimas citoplasmáticas que se autoestimulan por anormalidades celulares, como ocurre en la leucemia mieloide crónica en donde la traslocación de cromosomas 9 y 22 produce un gen de fusión conocido como BCR-ABL que lleva a una división celular no controlada. Estas enzimas pueden ser inhibidas por drogas como el imatinib, dasatinib, sunitinib, entre otras12.
Para que se lleve a cabo la replicación celular es fundamental el proceso de mitosis, con la duplicación del material genético y la formación de dos células hijas. En este punto es donde los citotóxicos clásicos actúan interrumpiendo este proceso. Estos medicamentos se dividen en agentes alquilantes, análogos de los platinos, antimetabolitos, inhibidores de la topoisomerasa I y II y agentes anti microtúbulos13.
Los agentes alquilantes fueron los primeros fármacos descubiertos, como se describió previamente. El grupo alquil resulta de la pérdida de un átomo de hidrógeno en un grupo de hidrocarbono alifático o aromático lo cual lleva a formar enlaces covalentes con otros compuestos. La principal acción es atacar el nitrógeno de la guanina en el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). Al encontrarse dos grupos alquil se forman enlaces que no se pueden romper en el momento de la replicación celular, llevando a detener este proceso. Dentro de los principales agentes alquilantes se encuentran la ciclofosfamida, la ifosfamida, la dacarbazina y el clorambucil13.
Los análogos de los platinos se desarrollaron al observar cómo se inhibía el crecimiento bacteriano al pasar una corriente eléctrica a través de dos electrodos de platino. La activación de estos medicamentos lleva a formar puentes cruzados con el ADN de manera similar que los agentes alquilantes, como ejemplo se encuentra el cisplatino y el oxaliplatino13.
Los antimetabolitos fueron la segunda familia de medicamentos en descubrirse. EL ADN está compuesto de miles de subunidades denominadas nucleótidos, que a su vez están formados por tres componentes: un grupo fosfato, una pentosa y una base nitrogenada que puede ser una purina o pirimidina. Para que estas últimas puedan formarse, es fundamental el ácido fólico como co-enzima. El proceso metabólico se inicia con la conversión a ácido folínico posteriormente a dihidrofolato y finalmente a tetrahidrofolato por la enzima dihidrofolato reductasa. El metotrexate inhibe la formación de ácido folínico a partir de ácido fólico. Otros medicamentos como la mecartopurina o la pentostatina detienen la formación de purinas. El fluorouracil, el capecitabine, el gemcitabine y el tegafur impiden la síntesis de pirimidinas13.
La topoisomerasas son enzimas que ayudan en la síntesis de ADN y mantienen su estructura, al inhibirlas se producen rupturas en las cadenas, lo que finalmente lleva a la muerte de la célula. Las antraciclinas como doxorrubicina, epirrubicina y mitoxantrona actúan directamente sobre la topoisomerasa II y son capaces además de producir radicales de oxígeno que finalmente desencadenan la apoptosis13.
Una vez que la célula tumoral ha completado el proceso de síntesis y duplicación del material genético, se produce el proceso de la mitosis el cual requiere la formación del huso mitótico (conjunto de microtúbulos que tiene como función conducir a los cromosomas durante los procesos de reproducción celular a cada una de las células hijas). Esta estructura requiere el ensamblaje de los microtúbulos, proceso que a su vez es inhibido por agentes como los taxanos (paclitaxel) o los alcaloides vinca que va llevar a detener la mitosis13. De esta forma y para tener en mente el tipo de medicamentos utilizados en los tratamientos oncológicos, teniendo en cuenta su mecanismo de acción se clasifican según la Tabla 1.
Manifestaciones clínicas de la cardiotoxicidad
Los principales agentes quimioterapéuticos asociados a complicaciones cardíacas han sido las antraciclinas. Sin embargo, otros medicamentos como ciclofosfamida, ifosfamida, cisplatino, carmustina, busulfan, mitomicina, paclitaxel, etopósido, tenipósido, los alcaloides de vinca, fluorouracilo, citarabina, amsacrina, asparginasa, treotonina, pentostatina, además de ser múltiples modificadores de la respuesta biológica, pueden también ocasionar lesión a nivel cardiovascular (Figura 3)14.
Medicamentos relacionados con falla cardíacaLas antraciclinas son un grupo de antibióticos citotóxicos que fueron inicialmente extraídos del hongoStreptomyces. Son medicamentos muy efectivos contra un amplio espectro de neoplasias sólidas y hematológicas, haciendo parte de muchos regímenes curativos15. A pesar de lo anterior, la cardiotoxicidad sigue siendo uno de los principales elementos que limitan su utilización, especialmente, en altas dosis con una presentación que va del 4 al 36%. Los principales factores de riesgo para desarrollar falla cardíaca por estos agentes citotóxicos son la dosis acumulada (por ejemplo dosis mayores de 550 mg/m2 de doxorrubicina), edad mayor a 70 años, irradiación temprana o simultánea, uso de otros fármacos que lesionan al miocito como trastuzumab o taxanos y enfermedad cardíaca previa16.
El trastuzumab es un anticuerpo monoclonal dirigido al dominio extracelular del receptor del HER2, el cual es fundamental para la diferenciación y el crecimiento celular. La amplificación del gen HER2/neu ocurre en el 25-30% de las pacientes con diagnóstico de cáncer de mama, esta mutación se asocia a mal pronóstico17,18. Este anticuerpo ha demostrado ser útil en estudios clínicos y preclínicos como monoterapia o como parte del manejo combinado en pacientes con neoplasias de la glándula mamaria, disminuyendo la recurrencia, aumentando las medianas de sobrevida y reduciendo el tamaño tumoral19,20. La incidencia de cardiotoxicidad por trastuzumab varía desde 3-7% si se utiliza como agente único o hasta 27% durante el manejo combinado4,21. La incidencia de disfunción ventricular izquierda en pacientes que reciben este anticuerpo monoclonal se incrementa también en pacientes ancianos con enfermedad cardiovascular previa, con antecedente de quimioterapia y radioterapia previa. Los efectos cardiovasculares han disminuido progresivamente en los estudios recientes dado que hay mejor monitoreo, tanto antes como después del tratamiento, y se evita el uso en combinación con antraciclinas. Por otro lado, es importante destacar que la disfunción cardíaca mediada por trastuzumab es reversible al suspender la medicación, con recuperación casi completa de la fracción de eyección en aproximadamente 1,5 años, convirtiéndose en una diferencia importante con respecto a la toxicidad mediada por antraciclinas.
La ciclofosfamida es un medicamento perteneciente al grupo alquilante, es decir que actúa directamente en el ADN formando enlaces covalentes y por tanto causando inhibición de la replicación celular, por lo cual se considera actualmente la piedra angular en varios esquemas de quimioterapia. Las altas dosis de ciclofosfamida se han relacionado con cardiotoxicidad aguda dentro de los 10 días de la aplicación, especialmente cuando se combina con otros agentes cardiotóxicos22,23. Esta medicación se ha relacionado con la aparición de miopericarditis aguda y complicaciones asociadas como arritmias, taponamiento cardíaco, falla cardíaca, entre otras. El único factor de riesgo reproducible es una dosis total de más 170-180 mg/kg por ciclo. La incidencia es variable, pero en series de casos publicadas se encuentra desde 11 al 22%24,25.
La mitomicina es un agente alquilante que interfiere directamente con la estructura y función del ADN. Este fármaco se ha asociado con el desarrollo de cardiomiopatía con disfunción del ventrículo izquierdo (VI), especialmente cuando se administra al tiempo o después de las antraciclinas y depende directamente de la dosis acumulada26.
Imatinib, dasatinib y nilotinib son moléculas diseñadas para el manejo de la leucemia mieloide crónica que expresa el cromosoma Filadelfia, el cual codifica una proteína de fusión conocida como BCR-ABL (BCR:breakpoint cluster region - ABL: Abelson), estos fármacos compiten con el ATP (adenosina trifosfato) en la enzima ABL kinasa y de esta forma inhiben su acción, induciendo a muerte celular por apoptosis, además de tener efectos negativos en el receptor de factor de crecimiento derivados de las plaquetas y el gen relacionado con ABL. Otras indicaciones de estas medicaciones son la leucemia linfoblástica aguda con expresión de cromosoma Filadelfia, leucemia eosinofílica crónica y tumores del estroma gastrointestinal (GIST)27. Los primeros casos de cardiotoxicidad por imatinib fueron reportados por Kerkela y colaboradores que encontraron, en 10 pacientes que recibían tratamiento con imatinib, una disminución de la función del ventrículo izquierdo asociada a una pérdida de la masa miocárdica. Actualmente, se sabe que la incidencia de los efectos cardiovasculares por estos fármacos es baja, aproximándose al 0,5-1,7%, pero que no debe ser despreciada en la población añosa28-31.
El trastuzumab es un anticuerpo monoclonal dirigido al dominio extracelular del receptor del HER2, el cual es fundamental para la diferenciación y el crecimiento celular. La amplificación del gen HER2/neu ocurre en el 25-30% de las pacientes con diagnóstico de cáncer de mama, esta mutación se asocia a mal pronóstico17,18. Este anticuerpo ha demostrado ser útil en estudios clínicos y preclínicos como monoterapia o como parte del manejo combinado en pacientes con neoplasias de la glándula mamaria, disminuyendo la recurrencia, aumentando las medianas de sobrevida y reduciendo el tamaño tumoral19,20. La incidencia de cardiotoxicidad por trastuzumab varía desde 3-7% si se utiliza como agente único o hasta 27% durante el manejo combinado4,21. La incidencia de disfunción ventricular izquierda en pacientes que reciben este anticuerpo monoclonal se incrementa también en pacientes ancianos con enfermedad cardiovascular previa, con antecedente de quimioterapia y radioterapia previa. Los efectos cardiovasculares han disminuido progresivamente en los estudios recientes dado que hay mejor monitoreo, tanto antes como después del tratamiento, y se evita el uso en combinación con antraciclinas. Por otro lado, es importante destacar que la disfunción cardíaca mediada por trastuzumab es reversible al suspender la medicación, con recuperación casi completa de la fracción de eyección en aproximadamente 1,5 años, convirtiéndose en una diferencia importante con respecto a la toxicidad mediada por antraciclinas.
La ciclofosfamida es un medicamento perteneciente al grupo alquilante, es decir que actúa directamente en el ADN formando enlaces covalentes y por tanto causando inhibición de la replicación celular, por lo cual se considera actualmente la piedra angular en varios esquemas de quimioterapia. Las altas dosis de ciclofosfamida se han relacionado con cardiotoxicidad aguda dentro de los 10 días de la aplicación, especialmente cuando se combina con otros agentes cardiotóxicos22,23. Esta medicación se ha relacionado con la aparición de miopericarditis aguda y complicaciones asociadas como arritmias, taponamiento cardíaco, falla cardíaca, entre otras. El único factor de riesgo reproducible es una dosis total de más 170-180 mg/kg por ciclo. La incidencia es variable, pero en series de casos publicadas se encuentra desde 11 al 22%24,25.
La mitomicina es un agente alquilante que interfiere directamente con la estructura y función del ADN. Este fármaco se ha asociado con el desarrollo de cardiomiopatía con disfunción del ventrículo izquierdo (VI), especialmente cuando se administra al tiempo o después de las antraciclinas y depende directamente de la dosis acumulada26.
Imatinib, dasatinib y nilotinib son moléculas diseñadas para el manejo de la leucemia mieloide crónica que expresa el cromosoma Filadelfia, el cual codifica una proteína de fusión conocida como BCR-ABL (BCR:breakpoint cluster region - ABL: Abelson), estos fármacos compiten con el ATP (adenosina trifosfato) en la enzima ABL kinasa y de esta forma inhiben su acción, induciendo a muerte celular por apoptosis, además de tener efectos negativos en el receptor de factor de crecimiento derivados de las plaquetas y el gen relacionado con ABL. Otras indicaciones de estas medicaciones son la leucemia linfoblástica aguda con expresión de cromosoma Filadelfia, leucemia eosinofílica crónica y tumores del estroma gastrointestinal (GIST)27. Los primeros casos de cardiotoxicidad por imatinib fueron reportados por Kerkela y colaboradores que encontraron, en 10 pacientes que recibían tratamiento con imatinib, una disminución de la función del ventrículo izquierdo asociada a una pérdida de la masa miocárdica. Actualmente, se sabe que la incidencia de los efectos cardiovasculares por estos fármacos es baja, aproximándose al 0,5-1,7%, pero que no debe ser despreciada en la población añosa28-31.
Medicamentos relacionados con isquemiaMuchos agentes desarrollados para el manejo de neoplasias se asocian a desarrollo de un síndrome coronario agudo, por ejemplo las infusiones de cisplatino (medicamento que interfiere directamente con la función y la estructura del ADN), pudiendo producir dolor torácico, palpitaciones y en los casos más severos elevación de las enzimas cardíacas32.
El 5 fluorouracilo (5 FU), medicamento que actúa inhibiendo la síntesis del material genético al ser similar a las pirimidinas, puede también ocasionar un síndrome coronario agudo que puede ir desde una angina inestable hasta un infarto agudo al miocardio (IAM), lo cual es dependientede la dosis y de la velocidad de administración. Una vez suspendida la medicación y con el manejo anti isquémico adecuado, suelen revertirse todos los efectos. La incidencia en pacientes sin enfermedad coronaria previa es del 1,1%, pero puede llegar hasta el 4,5%, cuando existe este antecedente33.
Capecitabine, un derivado del 5 FU utilizado para el manejo de cáncer de colon y mama principalmente, se ha asociado a efectos cardiotóxicos que incluye angina, IAM, arritmias, cambios electrocardiográficos y cardiomiopatía34.
Los agentes antimicrotúbulos como los alcaloides de vinca o los taxanos también se han asociado con el desarrollo de angina con cambios en el electrocardiograma (ECG), isquemia miocárdica e IAM. En ocasiones también, se han asociado con la presencia de angina de Prinzmetal con cambios reversibles, lo cual sugiere como mecanismo de presentación el vasoespasmo coronario35.
Por último, el bevacizumab, un anticuerpo monoclonal cuya función es inhibir la activación del factor de crecimiento derivado del endotelio, se ha asociado recientemente con el desarrollo de eventos trombóticos arteriales, dentro de ellos el IAM36.
El 5 fluorouracilo (5 FU), medicamento que actúa inhibiendo la síntesis del material genético al ser similar a las pirimidinas, puede también ocasionar un síndrome coronario agudo que puede ir desde una angina inestable hasta un infarto agudo al miocardio (IAM), lo cual es dependientede la dosis y de la velocidad de administración. Una vez suspendida la medicación y con el manejo anti isquémico adecuado, suelen revertirse todos los efectos. La incidencia en pacientes sin enfermedad coronaria previa es del 1,1%, pero puede llegar hasta el 4,5%, cuando existe este antecedente33.
Capecitabine, un derivado del 5 FU utilizado para el manejo de cáncer de colon y mama principalmente, se ha asociado a efectos cardiotóxicos que incluye angina, IAM, arritmias, cambios electrocardiográficos y cardiomiopatía34.
Los agentes antimicrotúbulos como los alcaloides de vinca o los taxanos también se han asociado con el desarrollo de angina con cambios en el electrocardiograma (ECG), isquemia miocárdica e IAM. En ocasiones también, se han asociado con la presencia de angina de Prinzmetal con cambios reversibles, lo cual sugiere como mecanismo de presentación el vasoespasmo coronario35.
Por último, el bevacizumab, un anticuerpo monoclonal cuya función es inhibir la activación del factor de crecimiento derivado del endotelio, se ha asociado recientemente con el desarrollo de eventos trombóticos arteriales, dentro de ellos el IAM36.
Medicamentos relacionados con hipertensión arterial e hipotensión arterialEl principal medicamento relacionado con hipertensión arterial severa es el bevacizumab. En muchos de los estudios puede ser tan frecuente como el 5%, pero muy pocas veces se ha asociado a crisis hipertensivas de emergencia. Otra medicación relacionada con hipertensión es el interferón alfa, especialmente, en las primeras 2 a 8 horas de utilización37.
La hipotensión arterial, por otra parte, resulta principalmente de la utilización de algunos agentes quimioterapéuticos como el etopósido e infusiones de anticuerpos monoclonales, también llamada terapia blanco. Dentro de éstos se encuentra el alemtuzumab, un anticuerpo dirigido al CD52 y utilizado en el manejo de la leucemia de células T, cuya infusión se asocia a reacciones de hipotensión, broncoespasmo y rash durante la primera semana de la terapia.
El cetuximab, un anticuerpo quimérico (humano/ratón) que se une al receptor de crecimiento epidérmico y por lo tanto inhibe el crecimiento de muchas neoplasias, produce en el 3% de los pacientes reacciones de hipersensibilidad severa con hipotensión asociada38.
Otros medicamentos pertenecientes a la terapia blanco que se asocia a hipotensión severa son el rituximab, IL2 y el ácido trasretinoico.
La hipotensión arterial, por otra parte, resulta principalmente de la utilización de algunos agentes quimioterapéuticos como el etopósido e infusiones de anticuerpos monoclonales, también llamada terapia blanco. Dentro de éstos se encuentra el alemtuzumab, un anticuerpo dirigido al CD52 y utilizado en el manejo de la leucemia de células T, cuya infusión se asocia a reacciones de hipotensión, broncoespasmo y rash durante la primera semana de la terapia.
El cetuximab, un anticuerpo quimérico (humano/ratón) que se une al receptor de crecimiento epidérmico y por lo tanto inhibe el crecimiento de muchas neoplasias, produce en el 3% de los pacientes reacciones de hipersensibilidad severa con hipotensión asociada38.
Otros medicamentos pertenecientes a la terapia blanco que se asocia a hipotensión severa son el rituximab, IL2 y el ácido trasretinoico.
Medicamentos relacionados a arritmiasEs frecuente encontrar arritmias durante el tratamiento del cáncer, éstas puede abarcar un gran espectro que va desde las bradiarritmias hasta las taquiarritmias ventriculares y supraventriculares. Dentro de los principales fármacos responsables del desarrollo de trastornos del ritmo están las antraciclinas. El primer signo de cardiomiopatía por estos antibióticos, muchas veces, es una taquicardia sinusal; no obstante, no son infrecuentes las arritmias supraventriculares, los cambios en el ST, cambios dinámicos de la onda T, ectopia ventricular y en pocos casos arritmias ventriculares39.
Los taxanos, medicamentos que actúa directamente sobre los microtúbulos, también se han relacionado con el desarrollo de arritmias hasta en un 30% de los casos, especialmente, de bradicardia asintomática que raramente requiere la suspensión de la medicación. Se han reportado también casos de bloqueos aurículo-ventriculares (AV), bloqueo de rama y taquicardia sinusal40.
Otros medicamentos como el trióxido de arsénico, utilizado en el manejo de la leucemia promielocítica, también se ha asociado a la prolongación del intervalo QT41.
Los taxanos, medicamentos que actúa directamente sobre los microtúbulos, también se han relacionado con el desarrollo de arritmias hasta en un 30% de los casos, especialmente, de bradicardia asintomática que raramente requiere la suspensión de la medicación. Se han reportado también casos de bloqueos aurículo-ventriculares (AV), bloqueo de rama y taquicardia sinusal40.
Otros medicamentos como el trióxido de arsénico, utilizado en el manejo de la leucemia promielocítica, también se ha asociado a la prolongación del intervalo QT41.
Mecanismos de cardiotoxicidad
Lesión del miocardioLa lesión del miocardio se produce por 2 tipos de mecanismos: la cardiotoxicidad tipo 1 cuyo ejemplo clásico son las antraciclinas y la cardiotoxicidad tipo 2, principalmente, producida por el trastuzumab (Figura 4).
Figura 4. Mecanismos por los cuales los medicamentos utilizados para la quimioterapia producen lesión cardiovascular.
El mecanismo por el cual las antraciclinas producen daño cardíaco es probablemente multifactorial42. La liberación de radicales libres, la alteración en la homeostasis del hierro, cambios en el calcio intracelular y disfunción mitocondrial son algunos de los efectos producidos por estos antibióticos39.
El mecanismo más conocido es la vía del daño mediado por radicales libres. La reducción del grupo quinona en el anillo B de los antracíclicos lleva a la formación de un radical de semiquinona. Este compuesto se oxida rápidamente generando radicales superóxido los cuales dan lugar a la formación de peróxido de hidrógeno. A su vez, este último va interaccionar con el miocardio que es muy susceptible de daño, dado que tiene menor cantidad de superóxido dismutasa y catalasa que otros tejidos y su única defensa es la glutation peroxidasa que se encuentra reducida por estos medicamentos43.
La formación de un complejo hierro férrico con la doxorrubicina va a catalizar la reacción anterior, aumentando la generación de radicales libres y a su vez éstos van a contribuir en la conversión de hierro ferroso a férrico, lo cual no es más que un círculo vicioso que va llevar a la destrucción de las membranas mitocondriales, nucleares, la membrana celular y del retículo endoplásmico. El daño de este último produce descenso del calcio intracelular, produciendo por lo tanto disminución de la contractibilidad44.
Las citoquinas proinflamatorias también se han relacionado con los efectos cardiovasculares de las antraciclinas, dado que éstas inducen la liberación de histamina, factor de necrosis tumoral alfa e interleucina 2. Estas proteínas inducen cardiomiopatía dilatada además de disfunción beta adrenérgica45.
Por otro lado, la toxicidad cardíaca por trastuzumab no esdel todo entendida. Inicialmente, se consideraba que estaba relacionada con el uso de antraciclinas, pero existen pacientes que nunca recibieron manejo con estos antibióticos y desarrollaron signos de falla cardíaca46. Las complicaciones cardíacas por estos anticuerpos monoclonales a diferencias de las antraciclinas, no ocurren por el medicamento en sí, sino por el bloqueo de las vías de reparación celular que ocurren al inhibir al receptor HER2, llevando fi nalmente a acelerar el proceso de muerte de los miocitos y disminuir la recuperación funcional47.
Otros medicamentos, como los inhibidores de la tirosin kinasa, no producen cardiotoxicidad por los mecanismos previamente descriptos, sino que se han asociado a disfunción mitocondrial. Los cardiomiocitos presentan altas demandas de ATP, por lo cual son susceptibles a cualquier disfunción de la mitocondria. Las principales alteraciones que se han encontrado en estos organelos son la pérdida del potencial de membrana, liberación de citocromo c y disminución importante de los niveles de ATP, lo que fi nalmente conlleva a la muerte de los miocitos. El mecanismo es complejo, pero se inicia con la generación de proteínas no plegadas que estimulan la respuesta de estrés del retículo endoplásmico, activando 2 vías distintas de transducción de señales: PERK y IRE1 cuyo resultado fi nal será la activación de la muerte celular programada48.
El mecanismo más conocido es la vía del daño mediado por radicales libres. La reducción del grupo quinona en el anillo B de los antracíclicos lleva a la formación de un radical de semiquinona. Este compuesto se oxida rápidamente generando radicales superóxido los cuales dan lugar a la formación de peróxido de hidrógeno. A su vez, este último va interaccionar con el miocardio que es muy susceptible de daño, dado que tiene menor cantidad de superóxido dismutasa y catalasa que otros tejidos y su única defensa es la glutation peroxidasa que se encuentra reducida por estos medicamentos43.
La formación de un complejo hierro férrico con la doxorrubicina va a catalizar la reacción anterior, aumentando la generación de radicales libres y a su vez éstos van a contribuir en la conversión de hierro ferroso a férrico, lo cual no es más que un círculo vicioso que va llevar a la destrucción de las membranas mitocondriales, nucleares, la membrana celular y del retículo endoplásmico. El daño de este último produce descenso del calcio intracelular, produciendo por lo tanto disminución de la contractibilidad44.
Las citoquinas proinflamatorias también se han relacionado con los efectos cardiovasculares de las antraciclinas, dado que éstas inducen la liberación de histamina, factor de necrosis tumoral alfa e interleucina 2. Estas proteínas inducen cardiomiopatía dilatada además de disfunción beta adrenérgica45.
Por otro lado, la toxicidad cardíaca por trastuzumab no esdel todo entendida. Inicialmente, se consideraba que estaba relacionada con el uso de antraciclinas, pero existen pacientes que nunca recibieron manejo con estos antibióticos y desarrollaron signos de falla cardíaca46. Las complicaciones cardíacas por estos anticuerpos monoclonales a diferencias de las antraciclinas, no ocurren por el medicamento en sí, sino por el bloqueo de las vías de reparación celular que ocurren al inhibir al receptor HER2, llevando fi nalmente a acelerar el proceso de muerte de los miocitos y disminuir la recuperación funcional47.
Otros medicamentos, como los inhibidores de la tirosin kinasa, no producen cardiotoxicidad por los mecanismos previamente descriptos, sino que se han asociado a disfunción mitocondrial. Los cardiomiocitos presentan altas demandas de ATP, por lo cual son susceptibles a cualquier disfunción de la mitocondria. Las principales alteraciones que se han encontrado en estos organelos son la pérdida del potencial de membrana, liberación de citocromo c y disminución importante de los niveles de ATP, lo que fi nalmente conlleva a la muerte de los miocitos. El mecanismo es complejo, pero se inicia con la generación de proteínas no plegadas que estimulan la respuesta de estrés del retículo endoplásmico, activando 2 vías distintas de transducción de señales: PERK y IRE1 cuyo resultado fi nal será la activación de la muerte celular programada48.
Alteraciones de la coagulaciónEl cáncer, como es sabido desde los primeros reportes del doctor Trosseau en 1865, es un estado de hipercoagulabilidad y el riesgo de presentar eventos está en relación con el estadio de la enfermedad, las comorbilidades y con el tratamiento utilizado49.
La quimioterapia tiene efectos directos en el sistema de coagulación, favoreciendo la trombosis y el tromboembolismo, y como consecuencia eventos cardiovasculares e isquemia cerebrovascular.
Los medicamentos como la talidomida, la lenidomida y el bevacizumab, los cuales inhiben la angiogénesis, se han asociado a eventos trombóticos. El mecanismo exacto no es conocido, pero se ha asociado a daño directo del endotelio especialmente de las uniones de las células y daño de la capa intimal, activando la cascada de coagulación50,51.
Otros medicamentos como los platinos tienen efectos directos en la agregación de las plaquetas, facilitando la formación de tromboxano y activando la vía del ácido araquidónico dentro de éstas52.
La quimioterapia tiene efectos directos en el sistema de coagulación, favoreciendo la trombosis y el tromboembolismo, y como consecuencia eventos cardiovasculares e isquemia cerebrovascular.
Los medicamentos como la talidomida, la lenidomida y el bevacizumab, los cuales inhiben la angiogénesis, se han asociado a eventos trombóticos. El mecanismo exacto no es conocido, pero se ha asociado a daño directo del endotelio especialmente de las uniones de las células y daño de la capa intimal, activando la cascada de coagulación50,51.
Otros medicamentos como los platinos tienen efectos directos en la agregación de las plaquetas, facilitando la formación de tromboxano y activando la vía del ácido araquidónico dentro de éstas52.
Hipertensión arterialLos principales medicamentos asociados a hipertensión arterial, como se describió previamente, son bevacizumab, sorafenib y sunitinib. El mecanismo asociado por el que se produce la hipertensión no es del todo entendido, pero se considera que al inhibir el factor de crecimiento derivado del endotelio disminuye la síntesis de óxido nítrico en las arteriolas y otros vasos de resistencia, lo cual provoca vasoconstricción e hipertensión arterial53.
Principales factores de riesgo para la cardiotoxicidad inducida por quimioterapia y su valoración
La valoración del riesgo cardiovascular en los pacientes que van a ser llevados a quimioterapia debe ser realizada previo al inicio de ésta, con el fi n de realizar las modifi caciones necesarias. Para ello, es importante valorar el esquema de antineoplásicos que recibirá el paciente, las dosis de losfármacos a utilizar, las medidas de prevención utilizadas, además de factores individuales como edad, sexo, antecedentes familiares y personales de enfermedad cardíaca, sin olvidar algunas herramientas como el examen físico que orientara al clínico sobre el riesgo del paciente37,42,54. Con el fin de evaluar el riesgo, podría utilizarse la lista de chequeo que se enuncia en la Tabla 2.
Tabla 2. Lista de chequeo que se debe realizar para evaluar los pacientes que van a recibir o se encuentran en quimioterapia
La cardiotoxicidad puede aparecer a cualquier edad, sin embargo, a mayor edad la probabilidad de presentar complicaciones también asciende55. Las mujeres tienen mayor riesgo de presentar eventos cardiovasculares con el uso de quimioterapia, a pesar de que los hombres tienen mayor posibilidad de desarrollar aterosclerosis, lo cual debe ser tenido en cuenta por los oncólogos, cardiólogos o médicos que valoren a estos pacientes55.
A su vez, a mayor dosis acumulativa también mayor riesgo de desarrollar toxicidad y la velocidad de aplicación, ejemplo claro de esto se da con el uso de antraciclinas como la doxorrubicina por encima de 450 mg/m2, la daunorrubicina en dosis superiores a 900 mg/m2 y la epirrubicina mayor de 935 mg/m2. No debe ser tampoco olvidado que la radioterapia mediastinal concomitante con la quimioterapia facilita la aparición de complicaciones cardiovasculares5.
De un estudio realizado de riesgo cardiovascular en pacientes con cáncer que iban a recibir manejo con inhibidores de la tirosin kinasa, se encontró que el 9,3% de los pacientes presentaba historia de enfermedad cardiovascular. Además, muchos de los pacientes presentaban factores de riesgo como hipertensión arterial (48,8%), diabetes mellitus (22%) o hipertrigliceridemia (12,8%), lo cual revela que la enfermedad cardiovascular es frecuente y subestimada en los pacientes con cáncer; por lo que debe ser indagado en el momento de considerar cualquier esquema de manejo57.
A su vez, a mayor dosis acumulativa también mayor riesgo de desarrollar toxicidad y la velocidad de aplicación, ejemplo claro de esto se da con el uso de antraciclinas como la doxorrubicina por encima de 450 mg/m2, la daunorrubicina en dosis superiores a 900 mg/m2 y la epirrubicina mayor de 935 mg/m2. No debe ser tampoco olvidado que la radioterapia mediastinal concomitante con la quimioterapia facilita la aparición de complicaciones cardiovasculares5.
De un estudio realizado de riesgo cardiovascular en pacientes con cáncer que iban a recibir manejo con inhibidores de la tirosin kinasa, se encontró que el 9,3% de los pacientes presentaba historia de enfermedad cardiovascular. Además, muchos de los pacientes presentaban factores de riesgo como hipertensión arterial (48,8%), diabetes mellitus (22%) o hipertrigliceridemia (12,8%), lo cual revela que la enfermedad cardiovascular es frecuente y subestimada en los pacientes con cáncer; por lo que debe ser indagado en el momento de considerar cualquier esquema de manejo57.
Diagnóstico y detección temprana
A medida que aparecen más agentes antineoplásicos, crece el interés sobre la detección temprana de los efectos tóxicos, entre ellos la cardiotoxicidad tanto temprana como en los sobrevivientes del cáncer56. La mayoría de los métodos diagnósticos han sido evaluados con las antraciclinas y el trastuzumab.
Existen dos métodos no invasivos que se han utilizado en la práctica oncológica para evaluar las complicaciones cardíacas relacionadas con el uso de antineoplásicos: la ecocardiografía y la ventriculografía con radionúclidos.
El ecocardiograma es una técnica de ultrasonografía con la cual se logra evaluar en tiempo real muchas condiciones, dentro de las que se encuentran la movilidad global del miocardio (disfunción sistólica y diastólica), derrames pericárdicos, alteraciones valvulares y cuantificar la fracción de eyección, siendo recomendado por varias asociaciones americanas como American College of Cardiology, American Heart Association y American Society of Echocardiography para monitorizar pacientes que se encuentran en tratamiento con antracíclicos58-60. Aunque la fracción de eyección aportada por el ecocardiograma Doppler es muy utilizada, es de recordar que no es un parámetro muy sensible para detectar alteraciones tempranas en la función miocárdica, y ahora se reconoce que los índices diastólicos representan un signo temprano de la disfunción del VI en pacientes con cáncer, por lo que la evaluación del patrón del flujo diastólico mitral, el índice E/A (velocidad protodiastólica/ telediastólica), el tiempo de desaceleración de la onda E, el tiempo de relajación isovolumétrica, pueden servir para detectar cambios diastólicos del ventrículo izquierdo.
El Doppler tisular del anillo mitral lateral del VI tiene un reconocido papel pronóstico y, en combinación con el Doppler pulsado del llenado de la válvula mitral, suministra una información adecuada acerca de las presiones de llenado del ventrículo izquierdo60. La principal desventaja es que es observador dependiente; y en el caso de los pacientes con neoplasias, las alteraciones en la pared torácica secundarias a manejo quirúrgico o radioterapia o simplemente las complicaciones por el tumor como derrames pleurales o compromiso de la pared, pueden afectar la ventana de observación y por tanto cambiar los resultados obtenidos61,62.
La ventriculografía por radionúclidos es un test funcional de medicina nuclear que se realiza con la aplicación de eritrocitos marcados con un radiomarcardor que posteriormente se visualiza en la cámaragamma, permitiendo evaluar la función sistólica y diastólica; pero no es posible obtener información sobre las estructuras cardíacas. Esta prueba es válida y ha sido utilizada en varios estudios, dado que es reproducible sin ser dependiente del operador, su principal desventaja es la radiación a la cual se somete el paciente62-64.
A su vez han aparecido estudios con marcadores cardíacospara detectar tempranamente la toxicidad, como son la troponina y el péptido natriurético.
Las troponinas son proteínas cardíacas cuya función es la de regular la interacción de la actina y la miosina durante la contracción del miocardio. La detección se realiza mediante anticuerpos monoclonales que detectan las isoformas de troponina I y troponina T, es una prueba muy específica de daño cardíaco, marcador específico y sensible para la detección de isquemia miocárdica. Su elevación se ha informado como predictor de morbilidad cardíaca subclínica y clínica, en pacientes con antraciclinas65-67. Por estos hallazgos se considera que la troponina puede ser un marcador temprano de daño cardíaco.
El péptido natriurético atrial cumple varias funciones fisiológicas como disminuir la tensión arterial, y tiene efecto diurético y natriurético. Se considera actualmente como marcador de pronóstico y respuesta al tratamiento en la falla cardíaca aguda y crónica, pero aún son pocos los estudios que han indicado su utilidad en el manejo de los pacientes con cáncer. Su valor puede tener lugar cuando la falla cardíaca es aún clínicamente inaparente. Sin embargo, nuevos estudios deberán confirmar la sensibilidad y la especificidad de este parámetro.
El estándar de oro para detectar la cardiotoxicidad por quimioterapia sigue siendo la biopsia endomiocárdica68. Los principales hallazgos son la pérdida de miofibrillas, la presencia de vacuolas, la alteración de las líneas Z y la fibrosis69. Existe una relación positiva entre los cambios observados y la dosis acumulada, especialmente de antraciclinas.
Existen dos métodos no invasivos que se han utilizado en la práctica oncológica para evaluar las complicaciones cardíacas relacionadas con el uso de antineoplásicos: la ecocardiografía y la ventriculografía con radionúclidos.
El ecocardiograma es una técnica de ultrasonografía con la cual se logra evaluar en tiempo real muchas condiciones, dentro de las que se encuentran la movilidad global del miocardio (disfunción sistólica y diastólica), derrames pericárdicos, alteraciones valvulares y cuantificar la fracción de eyección, siendo recomendado por varias asociaciones americanas como American College of Cardiology, American Heart Association y American Society of Echocardiography para monitorizar pacientes que se encuentran en tratamiento con antracíclicos58-60. Aunque la fracción de eyección aportada por el ecocardiograma Doppler es muy utilizada, es de recordar que no es un parámetro muy sensible para detectar alteraciones tempranas en la función miocárdica, y ahora se reconoce que los índices diastólicos representan un signo temprano de la disfunción del VI en pacientes con cáncer, por lo que la evaluación del patrón del flujo diastólico mitral, el índice E/A (velocidad protodiastólica/ telediastólica), el tiempo de desaceleración de la onda E, el tiempo de relajación isovolumétrica, pueden servir para detectar cambios diastólicos del ventrículo izquierdo.
El Doppler tisular del anillo mitral lateral del VI tiene un reconocido papel pronóstico y, en combinación con el Doppler pulsado del llenado de la válvula mitral, suministra una información adecuada acerca de las presiones de llenado del ventrículo izquierdo60. La principal desventaja es que es observador dependiente; y en el caso de los pacientes con neoplasias, las alteraciones en la pared torácica secundarias a manejo quirúrgico o radioterapia o simplemente las complicaciones por el tumor como derrames pleurales o compromiso de la pared, pueden afectar la ventana de observación y por tanto cambiar los resultados obtenidos61,62.
La ventriculografía por radionúclidos es un test funcional de medicina nuclear que se realiza con la aplicación de eritrocitos marcados con un radiomarcardor que posteriormente se visualiza en la cámaragamma, permitiendo evaluar la función sistólica y diastólica; pero no es posible obtener información sobre las estructuras cardíacas. Esta prueba es válida y ha sido utilizada en varios estudios, dado que es reproducible sin ser dependiente del operador, su principal desventaja es la radiación a la cual se somete el paciente62-64.
A su vez han aparecido estudios con marcadores cardíacospara detectar tempranamente la toxicidad, como son la troponina y el péptido natriurético.
Las troponinas son proteínas cardíacas cuya función es la de regular la interacción de la actina y la miosina durante la contracción del miocardio. La detección se realiza mediante anticuerpos monoclonales que detectan las isoformas de troponina I y troponina T, es una prueba muy específica de daño cardíaco, marcador específico y sensible para la detección de isquemia miocárdica. Su elevación se ha informado como predictor de morbilidad cardíaca subclínica y clínica, en pacientes con antraciclinas65-67. Por estos hallazgos se considera que la troponina puede ser un marcador temprano de daño cardíaco.
El péptido natriurético atrial cumple varias funciones fisiológicas como disminuir la tensión arterial, y tiene efecto diurético y natriurético. Se considera actualmente como marcador de pronóstico y respuesta al tratamiento en la falla cardíaca aguda y crónica, pero aún son pocos los estudios que han indicado su utilidad en el manejo de los pacientes con cáncer. Su valor puede tener lugar cuando la falla cardíaca es aún clínicamente inaparente. Sin embargo, nuevos estudios deberán confirmar la sensibilidad y la especificidad de este parámetro.
El estándar de oro para detectar la cardiotoxicidad por quimioterapia sigue siendo la biopsia endomiocárdica68. Los principales hallazgos son la pérdida de miofibrillas, la presencia de vacuolas, la alteración de las líneas Z y la fibrosis69. Existe una relación positiva entre los cambios observados y la dosis acumulada, especialmente de antraciclinas.
Monitoreo, prevención y tratamiento
En mayo del 2010 por parte del grupo europeo de oncología60, se publicaron las guías de práctica clínica acerca de cardiotoxicidad de agentes quimioterapéuticos y radioterapia, haciendo las siguientes recomendaciones:
Evaluación cardiovascular de pacientes antes del tratamiento de medicamentos antineoplásicos- Todos los pacientes sometidos a quimioterapia deben tener una evaluación clínica cuidadosa donde se evalúen los factores de riesgo cardiovascular o las comorbilidades [A].
- Recomiendan la monitorización frecuente de signos vitales durante la infusión de los agentes quimioterapéuticos, en particular con 5-FU o paclitaxel [A].
- El ECG y la evaluación clínica cardiovascular son útiles para la detección de signos de cardiomiopatía, trastornos de la conducción, valoración del intervalo QT, previo al inicio de quimioterapéuticos en especial con el uso de antraciclinas, paclitaxel o inhibidores de tirosin kinasa [B].
- El ecocardiograma Doppler se debe solicitar para evaluar la función cardíaca en pacientes sometidos a la terapia con antraciclinas, en particular ante la presencia de factores de riesgo cardiovascular como lo son edad >60 años, enfermedad cardiovascular previa e irradiación del mediastino anterior y en pacientes sometidos a terapia con trastuzumab, en particular en pacientes previamente tratados con antraciclinas [A].
- La fracción de acortamiento de ventrículo izquierdo y la fracción de eyección del ventrículo izquierdo son los índices más comunes para la evaluación de la función cardíaca antes de iniciar el tratamiento oncológico: una FEVI <54 a="" aca="" br="" card="" como="" con="" de="" desarrollo="" el="" en="" factor="" falla="" identifica="" pacientes="" para="" riesgo="" se="" sometidos="" trastuzumab.="" tratamiento="" un="">- La adquisición de imágenes mediante gammagrafía miocárdica permite información de la fracción de eyección, pero su uso es limitado debido a la exposición a la radiación.
- El uso de la resonancia magnética para evaluar la función del miocardio, la perfusión miocárdica y la caracterización de los tejidos, actualmente, no es una prueba de primera línea, pero puede tener potencial en el futuro.
- Recomiendan la monitorización frecuente de signos vitales durante la infusión de los agentes quimioterapéuticos, en particular con 5-FU o paclitaxel [A].
- El ECG y la evaluación clínica cardiovascular son útiles para la detección de signos de cardiomiopatía, trastornos de la conducción, valoración del intervalo QT, previo al inicio de quimioterapéuticos en especial con el uso de antraciclinas, paclitaxel o inhibidores de tirosin kinasa [B].
- El ecocardiograma Doppler se debe solicitar para evaluar la función cardíaca en pacientes sometidos a la terapia con antraciclinas, en particular ante la presencia de factores de riesgo cardiovascular como lo son edad >60 años, enfermedad cardiovascular previa e irradiación del mediastino anterior y en pacientes sometidos a terapia con trastuzumab, en particular en pacientes previamente tratados con antraciclinas [A].
- La fracción de acortamiento de ventrículo izquierdo y la fracción de eyección del ventrículo izquierdo son los índices más comunes para la evaluación de la función cardíaca antes de iniciar el tratamiento oncológico: una FEVI <54 a="" aca="" br="" card="" como="" con="" de="" desarrollo="" el="" en="" factor="" falla="" identifica="" pacientes="" para="" riesgo="" se="" sometidos="" trastuzumab.="" tratamiento="" un="">- La adquisición de imágenes mediante gammagrafía miocárdica permite información de la fracción de eyección, pero su uso es limitado debido a la exposición a la radiación.
- El uso de la resonancia magnética para evaluar la función del miocardio, la perfusión miocárdica y la caracterización de los tejidos, actualmente, no es una prueba de primera línea, pero puede tener potencial en el futuro.
Recomendaciones para monitoreo de cardiotoxicidad- Los pacientes sometidos a terapia oncológica deben ser educados para la reducción de riesgo cardiovascular, a través del control de la presión arterial, la reducción de niveles de lípidos, dejar de fumar y realizar modificaciones en el estilo de vida.
- El control periódico de la función cardíaca con ecocardiograma Doppler es sugerido en pacientes que reciban especialmente antraciclinas y sus derivados, o anticuerpos monoclonales.
- La evaluación clínica basal con ECG se recomienda en todos los pacientes sometidos a terapia con antraciclinas [III, A].
- La evaluación de la función cardíaca basal sistólica y diastólica con ecocardiograma Doppler debe llevarse a cabo antes del tratamiento con anticuerpos monoclonales [III, A] o antraciclinas y sus derivados en los pacientes mayores de 60 años, o con factores de riesgo cardiovascular como hipertensión, dislipidemia, diabetes, obesidad o tratamiento previo con agonistas 5 hidroxitriptamina 2B (usados en el Parkinson o la obesidad) dado que potencialmente pueden inducir valvulopatías [III, A].
- Otras evaluaciones de la FEVI se recomiendan, incluso en pacientes asintomáticos, de acuerdo con los siguientes tiempos: después de la administración de la mitad de la dosis prevista de antraciclina, o después de la administración de la dosis acumulada de doxorrubicina 300 mg/m2, epirubicina 450 mg/m2mitoxantrona 60 mg/ m2 [III, A] o después de la administración de una dosis acumulada de 240 mg/m2 de doxorrubicina o epirrubicina 360 mg/m2 en pacientes <15 a="" os="">60 años [III, B]. Antes de cada administración de ciclo de antraciclinas [III, A], después de 3, 6 y 12 meses de la finalización deterapia con antraciclinas [III, B].
- Durante el seguimiento de variables ecocardiográficas, los patrones del Doppler pulsado del tracto de entrada del ventrículo izquierdo y el Doppler tisular del anillo mitral deberían ser evaluados para detectar signos de disfunción ventricular izquierda que se pueden presentar antes de la disminución de la fracción de eyección.
- El control periódico (cada 12 semanas) de la función cardíaca es sugerido también a los pacientes que recibieron anticuerpos monoclonales, sobre todo si previamente habían sido tratados con antraciclinas [III, A].
- La evaluación de la función cardíaca se recomienda 4 y 10 años después del tratamiento con antraciclinas en pacientes que fueron tratados <15 a="" b="" de="" edad="" incluso="" la="" o="" os="">15 años, pero con dosis acumulativa de doxorubicina de> 240 mg/m2 o epirubicina >360 mg/ m2 [III, B].
- La reducción de la FEVI <20 a="" adecuada="" basal="" br="" cl="" de="" declinaci="" del="" estricto.="" fevi="" funci="" la="" n="" nico="" o="" pesar="" reevaluaci="" requiere="" seguimiento="" suspensi="" tratamiento="" una="" ventricular="" y="">- No hay un papel predictivo de biomarcadores de cardiotoxicidad causado por la terapia oncológica bien definido, como para ser medidor de rutina. Sin embargo, un aumento persistente de troponina I o del péptido natriurético cerebral (BNP) parece identificar pacientes con riesgo de cardiotoxicidad (excepto en pacientes que presentan síndrome de secreción inadecuada de la hormona antidiurética -HAD para el último), un enfoque útil, pero controvertido por lo costoso, es la medición basal de estos biomarcadores durante el tratamiento (troponina I al final de la administración de quimioterapia, después de 12, 24, 36,72 horas y 1 mes después) y el BNP al finalizar la infusión de medicamento y a las 72 horas; para identificar los pacientes que necesitan más evaluación cardíaca [III, C].
- El control periódico de la función cardíaca con ecocardiograma Doppler es sugerido en pacientes que reciban especialmente antraciclinas y sus derivados, o anticuerpos monoclonales.
- La evaluación clínica basal con ECG se recomienda en todos los pacientes sometidos a terapia con antraciclinas [III, A].
- La evaluación de la función cardíaca basal sistólica y diastólica con ecocardiograma Doppler debe llevarse a cabo antes del tratamiento con anticuerpos monoclonales [III, A] o antraciclinas y sus derivados en los pacientes mayores de 60 años, o con factores de riesgo cardiovascular como hipertensión, dislipidemia, diabetes, obesidad o tratamiento previo con agonistas 5 hidroxitriptamina 2B (usados en el Parkinson o la obesidad) dado que potencialmente pueden inducir valvulopatías [III, A].
- Otras evaluaciones de la FEVI se recomiendan, incluso en pacientes asintomáticos, de acuerdo con los siguientes tiempos: después de la administración de la mitad de la dosis prevista de antraciclina, o después de la administración de la dosis acumulada de doxorrubicina 300 mg/m2, epirubicina 450 mg/m2mitoxantrona 60 mg/ m2 [III, A] o después de la administración de una dosis acumulada de 240 mg/m2 de doxorrubicina o epirrubicina 360 mg/m2 en pacientes <15 a="" os="">60 años [III, B]. Antes de cada administración de ciclo de antraciclinas [III, A], después de 3, 6 y 12 meses de la finalización deterapia con antraciclinas [III, B].
- Durante el seguimiento de variables ecocardiográficas, los patrones del Doppler pulsado del tracto de entrada del ventrículo izquierdo y el Doppler tisular del anillo mitral deberían ser evaluados para detectar signos de disfunción ventricular izquierda que se pueden presentar antes de la disminución de la fracción de eyección.
- El control periódico (cada 12 semanas) de la función cardíaca es sugerido también a los pacientes que recibieron anticuerpos monoclonales, sobre todo si previamente habían sido tratados con antraciclinas [III, A].
- La evaluación de la función cardíaca se recomienda 4 y 10 años después del tratamiento con antraciclinas en pacientes que fueron tratados <15 a="" b="" de="" edad="" incluso="" la="" o="" os="">15 años, pero con dosis acumulativa de doxorubicina de> 240 mg/m2 o epirubicina >360 mg/ m2 [III, B].
- La reducción de la FEVI <20 a="" adecuada="" basal="" br="" cl="" de="" declinaci="" del="" estricto.="" fevi="" funci="" la="" n="" nico="" o="" pesar="" reevaluaci="" requiere="" seguimiento="" suspensi="" tratamiento="" una="" ventricular="" y="">- No hay un papel predictivo de biomarcadores de cardiotoxicidad causado por la terapia oncológica bien definido, como para ser medidor de rutina. Sin embargo, un aumento persistente de troponina I o del péptido natriurético cerebral (BNP) parece identificar pacientes con riesgo de cardiotoxicidad (excepto en pacientes que presentan síndrome de secreción inadecuada de la hormona antidiurética -HAD para el último), un enfoque útil, pero controvertido por lo costoso, es la medición basal de estos biomarcadores durante el tratamiento (troponina I al final de la administración de quimioterapia, después de 12, 24, 36,72 horas y 1 mes después) y el BNP al finalizar la infusión de medicamento y a las 72 horas; para identificar los pacientes que necesitan más evaluación cardíaca [III, C].
Tratamiento
El tratamiento médico agresivo de aquellos pacientes que incluso asintomáticos, muestran disfunción del VI en el ecocardiograma después de la terapia con antraciclinas, es obligatorio; especialmente, si la neoplasia podría tener una supervivencia a largo plazo, y consiste en inhibidores de la enzima convertidora de angiotensina (IECA) y beta bloqueadores.
Una vez desarrollados los síntomas debe añadirse al manejo: diuréticos, antagonistas de aldosterona, digoxina o nitratos, según las pautas internacionales. En el momento no existen estudios que muestren beneficio del manejo anterior para prevenir la progresión de la cardiopatía y muy pocos han demostrado beneficios terapéuticos a largo plazo70.
Con el fin de evitar las complicaciones cardiovasculares asociadas a estos antibióticos, se han desarrollado estrategias preventivas. Dentro de las principales, se ha considerado el cambio en el esquema de administración: se modificó la aplicación de bolos por infusiones prolongadas, lo cual ha disminuido el riesgo de cardiotoxicidad, pero no ha mostrado beneficios en la tasa de respuesta y la supervivencia global71.
Otro mecanismo que se diseñó fue cubrir las antraciclinas con una cápsula liposomal, lo cual tiene efectos directos en la farmacocinética, dado que el mayor tamaño le impide atravesar el endotelio normal y el miocardio, pero sí puede difundir al tumor. Esto aporta a estas moléculas una eficacia similar, pero menor riesgo de desarrollar falla cardíaca, lo cual es demostrado en biopsias donde se observan menos cambios miocárdicos al comparar estos compuestos con la doxorrubicina72.
Otros análogos como la epirrubicina y la mitoxantrona han demostrado tener menos potencia terapéutica que la doxorrubicina, pero a su vez con menos cardiotoxicidad73,74. La mitoxantrona se asocia a disfunción cardíaca con dosis acumulada de 140 mg/m2, pero responde muy bien a la terapia estándar de falla cardíaca74.
El dexrazoxane es un agente similar al ácido etilendiaminotetracetico (EDTA) que actúa como quelador del hierro y por tanto inhibe la peroxidación de las membranas lipídicas; por este efecto actualmente se utiliza para prevenir la cardiotoxicidad inducida por antraciclinas75. El dexrazoxane puede ser administrado de dos maneras: la primera al iniciar el tratamiento o al completar la dosis acumulada de 300 mg/m2. Muchos estudios han demostrado que el uso concomitante con estos antibióticos puede reducir el daño a nivel cardiovascular76. A pesar de este beneficio, su uso continúa siendo controversial por la posibilidad de disminuir la respuesta a la quimioterapia y incrementa la inmunosupresión inducida por las antraciclinas77,78.
Por tanto la recomendación final de un manejo multidisciplinario en el que la interrelación del oncólogo, cardiólogo y la monitorización permanente desde el punto de vista clínico cardiológico y ecocardiográfico, sería un paso importante en la identificación temprana de los pacientes con toxicidad cardíaca secundaria a la quimioterapia79,80.
Una vez desarrollados los síntomas debe añadirse al manejo: diuréticos, antagonistas de aldosterona, digoxina o nitratos, según las pautas internacionales. En el momento no existen estudios que muestren beneficio del manejo anterior para prevenir la progresión de la cardiopatía y muy pocos han demostrado beneficios terapéuticos a largo plazo70.
Con el fin de evitar las complicaciones cardiovasculares asociadas a estos antibióticos, se han desarrollado estrategias preventivas. Dentro de las principales, se ha considerado el cambio en el esquema de administración: se modificó la aplicación de bolos por infusiones prolongadas, lo cual ha disminuido el riesgo de cardiotoxicidad, pero no ha mostrado beneficios en la tasa de respuesta y la supervivencia global71.
Otro mecanismo que se diseñó fue cubrir las antraciclinas con una cápsula liposomal, lo cual tiene efectos directos en la farmacocinética, dado que el mayor tamaño le impide atravesar el endotelio normal y el miocardio, pero sí puede difundir al tumor. Esto aporta a estas moléculas una eficacia similar, pero menor riesgo de desarrollar falla cardíaca, lo cual es demostrado en biopsias donde se observan menos cambios miocárdicos al comparar estos compuestos con la doxorrubicina72.
Otros análogos como la epirrubicina y la mitoxantrona han demostrado tener menos potencia terapéutica que la doxorrubicina, pero a su vez con menos cardiotoxicidad73,74. La mitoxantrona se asocia a disfunción cardíaca con dosis acumulada de 140 mg/m2, pero responde muy bien a la terapia estándar de falla cardíaca74.
El dexrazoxane es un agente similar al ácido etilendiaminotetracetico (EDTA) que actúa como quelador del hierro y por tanto inhibe la peroxidación de las membranas lipídicas; por este efecto actualmente se utiliza para prevenir la cardiotoxicidad inducida por antraciclinas75. El dexrazoxane puede ser administrado de dos maneras: la primera al iniciar el tratamiento o al completar la dosis acumulada de 300 mg/m2. Muchos estudios han demostrado que el uso concomitante con estos antibióticos puede reducir el daño a nivel cardiovascular76. A pesar de este beneficio, su uso continúa siendo controversial por la posibilidad de disminuir la respuesta a la quimioterapia y incrementa la inmunosupresión inducida por las antraciclinas77,78.
Por tanto la recomendación final de un manejo multidisciplinario en el que la interrelación del oncólogo, cardiólogo y la monitorización permanente desde el punto de vista clínico cardiológico y ecocardiográfico, sería un paso importante en la identificación temprana de los pacientes con toxicidad cardíaca secundaria a la quimioterapia79,80.
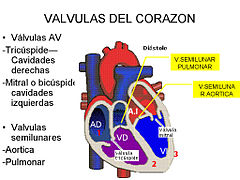
No hay comentarios:
Publicar un comentario