Ecuaciones
ecuación de Henderson-Hasselbalch es una expresión utilizada en química para calcular el pH de una disolución reguladora, o tampón, a partir del pKa o el pKb(obtenidos de la constante de disociación del ácido o de la constante de disociación de la base) y de las concentraciones de equilibrio del ácido o base y de sus correspondientes base o ácido conjugado, respectivamente.
![\mbox{pH} = \mbox{p}K_a + \log \left ( \frac{[base]}{[acido]} \right )](https://upload.wikimedia.org/math/0/e/f/0ef52dd24ee1864e8fa638e8d11ab948.png)
![\mbox{pOH} = \mbox{p}K_b + \log \left ( \frac{[sal]}{[base]} \right )](https://upload.wikimedia.org/math/8/8/e/88e2e9dd1d1df2e8613efd5a17964a1b.png)
![\mbox{pH} = \mbox{p}K_x + \log \left ( \frac{[S]}{[A]} \right )](https://upload.wikimedia.org/math/3/d/1/3d11e20b05075ead68457a83c09eb477.png)
donde:
- S es la sal o especie básica, y
- A es el ácido o especie ácida
Observaciones
La ecuación implica el uso de las concentraciones de equilibrio del ácido y su base conjugada. Para el cálculo del pH en soluciones buffer, generalmente se hace una simplificación y se utilizan las concentraciones iniciales del ácido y la sal, por lo tanto se debe tener en cuenta que el valor obtenido es una aproximación y que el error será mayor cuanto mayor sea la diferencia de las concentraciones de equilibrio con las de partida (constante de equilibrio alta). En la misma aproximación, tampoco se considera el aporte del agua, lo cual no es válido para soluciones muy diluidas.
Desarrollo
Supóngase un ácido AH con disociación parcial. El equilibrio es:

y la constante de disociación asociada será:
![K_{a} = \frac{[A^-][\mathrm{H_{3}O^+}]}{[A\mathrm{H}]}](https://upload.wikimedia.org/math/6/4/6/646c1681d14b50927531fb25a98c178b.png)
Despejando ![[\mathrm{H_{3}O^+}]](https://upload.wikimedia.org/math/2/6/f/26fb4669b93825c55ddb1ea5c52ed294.png) de la constante de disociación:
de la constante de disociación:
![[\mathrm{H_{3}O^+}]](https://upload.wikimedia.org/math/2/6/f/26fb4669b93825c55ddb1ea5c52ed294.png) de la constante de disociación:
de la constante de disociación:![[\mathrm{H_{3}O^+}] = \frac{K_{a}[A\mbox{H}]}{[A^-]}](https://upload.wikimedia.org/math/6/d/3/6d3d46215d5a71d6ac9fb79c15e3a797.png)
Tomando logaritmos a ambos lados y aplicando la propiedad de los logaritmos para un producto se llega a:
![- \log_{10} \left ( [\mathrm{H_{3}O^+}] \right ) = - \log_{10} \left ( K_{a} \right ) - \log_{10} \left ( \frac{[A\mbox{H}]}{[A^-]} \right )](https://upload.wikimedia.org/math/f/c/4/fc41c40b7fdf80d723221d556ba6cb29.png)
E invirtiendo el cociente:
![\mbox{pH} = pK_{a} + \log_{10} \left ( \frac{[A^-]}{[A\mbox{H}]} \right )](https://upload.wikimedia.org/math/3/0/0/30051eaf01dae0eceda5effd857dcba2.png)
Aplicación Farmacológica en Medicina
La fórmula de Henderson-Hasselbalch es empleada para medir el mecanismo de absorción de los fármacos en la economía corpórea. Dicho de otra manera, la absorbción es la transferencia de un fármaco desde un sitio de administración hacia el sangre. Los rangos de rapidez y eficacia de la absorción farmacológica dependen de una ruta específica de administración, sea esta en su disposición farmacológica traslocarse al interior de la membrana celular para estimular el efecto organísmico deseado, por lo que la administración farmacéutica por diferentes rutas mucosas dependen de su biodisponibilidad farmacológica. Para ello se requiere que para la translocación del fármaco se necesite que este, desde su formulación farmacéutica no se disocie al llegar a la membrana celular, sea de carácter liposoluble, y de bajo peso molecular por lo que debe de ser de características de ácidos y bases débiles.
- El efecto del pH en la absorción farmacológica se media estudiando el pH de las presentaciones farmacéuticas:
- Fármacos Ácidos Débiles [HA]: Liberan un [H+] causando una carga aniónica [A-], para formar: [HA] <-> [H+] + [A-].
- Fármacos Alcalinos Débiles [BH+]: Liberan también un [H+]. La forma ionizada de los fármacos base son usualmente cargados, y pierden un protón que produce una base sin carga [B], para formar: [BH+] <-> [B] + [H+].
- Tomando el pH de ciertas mucosas, por ejem:
- Cavidad Oral: 5 a 6 pH.
- Mucosa Gástrica: 1 a 3 pH.
- Mucosa Intestinal: 4 a 5 pH.
- Y Tomando el pK de ciertos fármacos, por ejem:
- Morfina: (Base) 9 pK.
- Acetaminofeno: (Ácido) 8 pK.
- Diazepam: (Ácido) 4 pK.
- Aspirina: (Ácido) 1.4 pK.
- Ejecutando la fórmula de Henderson-Hasselbalch para el ejemplo de:
- Aspirina administrada vía enteral, absorbida en la mucosa gástrica:
![\mbox{pH} = pK_a + \log \left ( \frac{[A^-]}{[A\mbox{H}]} \right )](https://upload.wikimedia.org/math/1/d/5/1d5b7af8b16dd0e0e8f57cb308dc1502.png)
Despeje:
- D
3= 1+log [A-]/[AH]
3-1= log [A-]/[AH]
2= log [A-]/[AH]
antilog 2= [A-]/[AH]
100= [A-]/[AH]
100/1= [A-]/[AH]
101-100% = 1 = 100-x%; x= 99% Quiere decir, que la administración enteral de la aspirina, alcanza una absorción casi al 100%, logrando una efectividad de translocación mayor.
ECUACIÓN DE HENDERSON-HASSELBALCH
| El pH de una mezcla amortiguadora se puede conocer mediante la ecuación de Henderson-Hasselbalch. En la disociación del ácido acético: Teniendo en cuenta que el ácido acético es muy débil y, por tanto, el equilibrio de disociación está casi totalmente desplazado hacia la izquierda (desplazamiento favorecido por la presencia de cantidades notables de acetato) podremos sustituir en la ecuación de Henderson-Hasselbalch, sin introducir errores, la concentración de acético libre por la de acético total ([AcH]=[ácido]). Análogamente, como el acetato sódico está completamente disociado podemos considerar que la concentración del ión acetato coincide con la concentración de sal ([Ac-]=[sal]). Con estas modificaciones podemos expresar la ecuación de Henderson-Hasselbalch de una forma válida para todos los amortiguadores (no sólo para el acético/acetato): 1.- El pH de una disolución amortiguadora depende de la naturaleza del ácido débil que lo integra (de su pK), de modo que para cantidades equimoleculares de sal y de ácido, el pH es justamente el pK de este ácido. Dicho de otra forma, se puede definir el pK de un ácido débil como el pH del sistema amortiguador que se obtiene cuando [sal] = [ácido] (Figura de la derecha). 2.- El pH del sistema amortiguador depende de la proporción relativa entre la sal y el ácido, pero no de las concentraciones absolutas de estos componentes. De aquí se deduce que añadiendo agua al sistema, las concentraciones de sal y ácido disminuyen paralelamente, pero su cociente permanece constante, y el pH no cambia. Sin embargo, si la dilución llega a ser muy grande, el equilibrio de disociación del ácido se desplazaría hacia la derecha, aumentando la [sal] y disminuyendo [ácido], con lo cual el cociente aumenta y el pH también, de forma que se iría acercando gradualmente a la neutralidad (pH 7). 3.- Cuando se añaden ácidos o bases fuertes a la disolución amortiguadora, el equilibrio se desplaza en el sentido de eliminar el ácido añadido (hacia la izquierda) o de neutralizar la base añadida (hacia la derecha). Este desplazamiento afecta a las proporciones relativas de sal y ácido en el equilibrio. Como el pH varía con el logaritmo de este cociente, la modificación del pH resulta exigua hasta que uno de los componentes está próximo a agotarse.
ecuación de Langevin (Paul Langevin, 1908) es una ecuación diferencial estocástica que describe elmovimiento browniano en un potencial.
Las primeras ecuaciones de Langevin que fueron estudiadas fueron aquellas en las que el potencial es constante, de forma tal que la aceleración
 de una partícula browniana de masa de una partícula browniana de masa 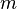 se expresa como la suma de la fuerza viscosa que es proporcional a la velocidad de la partícula se expresa como la suma de la fuerza viscosa que es proporcional a la velocidad de la partícula  (ley de Stokes), un término de "ruido" (ley de Stokes), un término de "ruido"  (el nombre que se le da en un contexto físico a términos en ecuaciones diferenciales estocásticas que son procesos estocásticos), que representa el efecto de una serie continua de choques con los átomos del fluido que forma el medio, y (el nombre que se le da en un contexto físico a términos en ecuaciones diferenciales estocásticas que son procesos estocásticos), que representa el efecto de una serie continua de choques con los átomos del fluido que forma el medio, y  que es la fuerza de interacción sistemática producida por las interacciones intramoleculares eintermoleculares: que es la fuerza de interacción sistemática producida por las interacciones intramoleculares eintermoleculares:
Ecuaciones esencialmente similares se aplican a otros sistemas brownianos, tales como ruido de Johnson-Nyquist (también conocido como ruido térmico) en una resistencia eléctrica:
Se pueden obtener numerosos resultados interesantes aún sin resolver la ecuación de Langevin, a partir del teorema de disipación de fluctuación.
El método principal para hallar una solución, si es que se requiere una solución, es utilizar la ecuación de Fokker-Planck, que presenta una ecuación determinista que es satisfecha por la densidad de probabilidad dependiente del tiempo. Soluciones numéricas alternativas se pueden obtener mediante simulación de Montecarlo. También se han usado otras técnicas, tales como integración de camino, que se basan en la analogía entre física estadística y mecánica cuántica (por ejemplo la ecuación de Fokker-Planck puede ser transformada en la ecuación de Schrödinger si se transforman algunas variables).
La ecuación de Langevin se utiliza también en la dinámica molecular como un termostato, obteniendo así una temperatura promedio constante en la simulación.
La ecuaci´on de Fokker-Planck y la
ecuaci´on de Langevin .- ................................................:http://www.ugr.es/~jtorres/leccion5.pdf
|

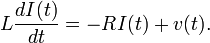
No hay comentarios:
Publicar un comentario