Agentes antineoplásicos
Los antineoplásicos son sustancias que impiden el desarrollo, crecimiento, o proliferación de células tumorales malignas. Estas sustancias pueden ser de origen natural, sintético o semisintético.
Según el mecanismo de acción se clasifican básicamente de dos tipos, aquellos que actúan contra la célula tumoral en un determinado ciclo de la división celular denominados ciclo-específicos y aquellos ciclo-inespecífico que afectan a la célula durante todo su ciclo de desarrollo.
Muchos de los antineoplásicos son profármacos, es decir, se administra un medicamento que es menos tóxico, o tiene mejores características farmacodinámicas, y una vez en el organismo se convierte en otro fármaco más eficaz, seguro y selectivo frente a su diana terapéutica.
Clasificación de los antineoplásicos
Se realiza según el mecanismo de acción y dentro de éste según la estructura química del antineoplásico.
Citostáticos que actúan sobre el ADN
1. Agentes alquilantes
Mostazas nitrogenadas
Fueron los primeros agentes alquilantes creados y el prototipo de ellos,1 en general todos son depresores de la médula ósea porque es su principal efecto tóxico. También producen con frecuencia vómitos y alopecia. Hay una complicación característica de laciclofosfamida y de la ifosfamida, que es la cistitis hemorrágicas y se debe a la formación de un metabolito, la acroleína. En mayor grado la produce la ifosfamida.2 Esta cistitis hemorrágica se evita hidratando al paciente y usando MESNA (Uromitexan® amp) que es un protector de las células de la vejiga. Con la ifosfamida es obligatorio y con la ciclofosfamida no, aunque hay quien lo pone.
- Ciclofosfamida; Genoxal® amp, vial. Es muy útil por su amplio espectro combinado con otros fármacos en linfomas,leucemias, cáncer de mama y otros tumores sólidos.1
- Ifosfamida; Tronoxal® vial. Se emplea sola o asociada en sarcomas (óseos o de tejidos blandos), cáncer de ovario, de cérvix uterino y en cáncer de pulmón entre otros.
- Melfalan® comp., vial.
- Bendamustina, utilizada en el tratamiento de la leucemia linfática crónica y linfomas.
Nitrosoureas
En dosis altas pueden producir toxicidad pulmonar en forma de fibrosis. También puede afectar en la orina.
- Carmustina; Nitrourean® amp. Es muy lipófilo y alcanza fácilmente el SNC, por lo tanto se emplea en tumores cerebrales, enfermedad de Hodgkin.
2. Platinos
Todos son inyectables, no existen VO. Son complejos de metales pesados que actúan de forma semejante a los agentes alquilantes.
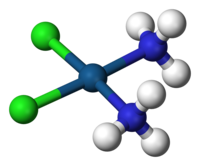
- Cisplatino. Neoplatin®. Su reacción adversa más llamativa es la nefrotóxica y produce náuseas y vómitos de gran intensidad. Se utiliza en cáncer de células microcíticas de pulmón, estómago, testículo, ovario y linfoma de no Hodgkin.
- Carboplatino. Paraplatin®. Produce menor nefrotoxicidad que el cisplatino pero produce mayor mielotoxicidad, lo que va a limitar su dosis. Se utiliza fundamentalmente en el cáncer avanzado de ovario.
- Oxaliplatino. Eloxatin®. Se utiliza en el cáncer colorectal metastásico asociado al fluorouracilo (5-Fu).3 Produce menor nefrotoxicidad y hematotoxicidad que los anteriores, sin embargo su neurotoxicidad, caracterizada por parestesia y disestesia exacerbada o disparada por exposición a bajas temperaturas, limita su dosis.
3. Antimetabolitos
Todos son depresores de la médula ósea.... y su toxicidad depende de la dosis y el tiempo de administración.4
Análogos del ácido fólico
- Metotrexato® comp., iny. Su actividad se ve contrarrestada por la leucovorina o folinato cálcico, que se utiliza en la terapia de rescate. Produce mielosupresión, mucositis gastrointestinal y hepatitis. A dosis bajas se utiliza en la psoriasis, artritis reumatoide, leucemia linfocítica y cáncer de mama. También a dosis bajas en los embarazos ectópicos. A dosis altas se utiliza en el linfoma maligno. En este caso entra la terapia de rescate.
Análogos de la pirimidina
- Fluorouracilo® comp., vial. Su reacción adversa más frecuente es sobre la médula ósea, produce leucopenia, y también produce alteraciones gastrointestinales. Se utiliza en cáncer de colon, mama, ovario.
- capecitabina Administración oral. Utilizado para el tratamiento del cáncer de mama y el cáncer de colon.
- Citarabina® iny. Se emplea en el tratamiento de las leucemias.
- Gemcitabina. Gemzar® iny. Se emplea en el cáncer de pulmón no microcítico metastásico, en el carcinoma de páncreas y en el de vejiga, en este caso se asocia a cisplatino.
Análogos de la purina
- Cladribina. Leustatin® iny. Está indicada en el tratamiento de la tricoleucemia activa y en la leucemia linfocítica crónica que no haya respondido a otros tratamientos. Es un medicamento con elevada toxicidad. Las alteraciones más graves que produce son hematológicas.
- Mercaptopurina® comp. Se utiliza en distintos tipos de leucemia. Es útil en la enfermedad inflamatoria intestinal.
- Fludarabina. Beneflur® iny. Se utiliza también en la leucemia linfocítica crónica que no haya respondido a un tratamiento estándar con agentes alquilantes. Produce neutropenia y trombocitopenia.
4. Antibióticos antitumorales
- Doxorubicina o Adriamicina. Farmiblastina® iny. Se utiliza asociada con otros antineoplásicos en leucemias, linfomas de Hodgkin y no Hodgkin, cáncer de mama metastásico, de pulmón, etc.4 Existe una preparación comercial, Caelyx®, que es doxorubicina liposomal (en liposomas), que se emplea en el tratamiento del sarcoma de Kaposi en pacientes con sida.
- Epirubicina. Farmorubicina® iny. Se utiliza en linfomas malignos, carcinoma de pulmón, mama, gástrico, hígado, páncreas, etc. El problema es que es todavía más cardiotóxica que la doxorubicina.5 Tanto es así que no se deben aplicar dosis superiores a 1000mg/ porque aparece insuficiencia cardiaca congestiva.
- Bleomicina. Bleomicina® iny. Produce unas reacciones características en la piel, como ulceraciones e hiperpigmentación. Se emplea en cáncer de testículo, enfermedad de Hodgkin y otros linfomas.6
- Mitomicina. Mitomycin® iny. Tiene poco uso porque es muy tóxica. Produce náuseas, vómitos, trombocitopenia e insuficiencia renal. Puede tener utilidad en melanomas, cáncer de estómago y de páncreas.
- Mitoxantrona. Novantrone® iny. Se utiliza en leucemias y linfomas no Hodgkin. También en cáncer de próstata y hepatocelular. Sus efectos adversos más característicos son cardiovasculares, gastrointestinales y hematológicos o sanguíneos.
5. Inhibidores de las topoisomerasas
Las topoisomerasas son enzimas que controlan las estructuras del ADN en la replicación.
- Irinotecan. Campto® iny (Topoisomerasa I).3 Se emplea en el cáncer colorrectal avanzado combinado con 5-Fluorouracilo en pacientes sin quimioterapia anterior o bien en monoterapia para pacientes que han fracasado a un régimen anterior con 5-Fluorouracilo.3 Su principal reacción adversa son las diarreas. También puede producir síndrome colinérgico con calambres abdominales, bradicardia, hipersalivación, etc. Este síndrome puede evitarse si previamente se administra atropina.
- Etoposido. Vepesid® cap, iny. (Topoisomerasa II). Se utiliza en tumores testiculares, leucemias, cáncer microcítico de pulmón y linfoma tanto Hodgkin como no Hodgkin. Produce mielodepresión, náuseas y vómitos.
- Teniposido. Vumon® iny. (Topoisomerasa II). Se emplea en algunos tipos de leucemias y linfomas así como en los tumores intracraneales malignos.
6. Enzimas
- L- ASPARAGINASA. Kindrolase® (Med Extr). Produce reacciones de hipersensibilidad, hipoalbuminemia y disminución de los factores de coagulación. Se utiliza en el tratamiento de la leucemia linfoblástica aguda en niños.
Fármacos que actúan sobre la mitosis celular sin afectar al ADN
1. Alcaloides de la vinca
Todos producen alopecia total, son muy tóxicas para los folículos pilosos. Son agentes vesicantes que provocan ulceraciones locales cuando hay extravasación.
- Vinblastina.8 Como efecto adverso destaca la neurotoxicidad de carácter periférico y afecta también a la médula pero en menor medida.
- Vincristina.8 Vincrisul®. Produce mielodepresión en forma de leucopenia y también neurotoxicidad pero en menor medida.
- Vindesina. Enison®. Produce mielodepresión y neurotoxicidad pero más moderada.
- Vinorelbina. Navelbine®. Se utiliza en el cáncer de pulmón de células no microcíticas y en el carcinoma de mama avanzado. También produce mielodepresión, neurotoxicidad y alopecia.
Las tres primeras se emplean en la enfermedad de Hodgkin y otro tipo de linfomas y leucemias. La que más espectro tiene es la vindesina, que se utiliza también en el cáncer colorectal, pulmonar, de mama, etc.
2. Taxanos
Producen leucopenia y neutropenia de corta duración y dan lugar con bastante frecuencia reacciones de hipersensibilidad.
El paclitaxel se utiliza en el cáncer de ovario asociado a cisplatino, en cáncer de mama metastásico en pacientes que han fracasado o no son candidatos al grupo de antraciclinas y en cáncer de pulmón no microcítico avanzado.9
Otros fármacos
Otros fármacos que se utilizan en los tumores malignos (sin ser antitumorales propiamente dichos).
1. Agentes hormonales
- Antiestrogénicos
- Tamoxifeno® comp. Se utiliza en el cáncer de mama.
- Megestrol acetato. Megace® comp. Se utiliza en el cáncer de mama y en el de endometrio.
- Inhibidores de la aromatasa
- Aminoglutemida. Orimeten® comp. Carcinoma de mama y de próstata metastásico.
- Análogos de LH-RH
- Goserelina. Zoladex® iny. Cáncer de mama y próstata.
- Leuprolida. Procrin® iny. Cáncer de próstata.
- Antiandrogénicos
- Flutamida. Eulexin® comp. Cáncer de próstata.
- Ciproterona. Androcur® comp. Cáncer de próstata.
2. Sistema inmunitario
- Interleucinas. Promueven la proliferación de linfocitos T citotóxicos, linfocitos B y timocitos.
- Interferones. Como el α-2a y el α-2b, que intensifican la función de las células inmunológicas.
- Anticuerpos monoclonales. Como el Rituximab (Mabthera®), que se utiliza en el tratamiento de linfomas.
- Vacuna de la BCG. Son cepas atenuadas de Mycobacterium bovis. Se emplea en el cáncer de vejiga. Actúa a nivel local mediante la activación de macrófagos.
Efectos secundarios de los citostáticos
El cáncer se caracteriza por la existencia de células que han sufrido una alteración en los mecanismos de control que regulan su capacidad de diferenciación y proliferación. El tratamiento del tumor se puede realizar mediante métodos quirúrgicos, radioterapia o fármacos antineoplásicos o citostáticos.
En general, los citostáticos son más tóxicos para las células tumorales que para las normales, por ser más activos sobre células en fase de reproducción. Una de las principales características de los tumores malignos es su continua división celular sin fases de reposo, lo que los hace muy sensibles a los citostáticos. Sin embargo, algunas células normales, como las de la médula ósea, las de la mucosa del aparato digestivo o las células de los folículos pilosos se dividen también con relativa rapidez por lo que son más sensibles a los citostáticos.
El principal problema de estos fármacos es su elevada toxicidad debido a la incapacidad para diferenciar las células tumorales de las células sanas. Es muy frecuente administrar 2 ó 3 citostáticos juntos. Estas asociaciones tienen la ventaja de que se pueden reducir la resistencia de las células tumorales a los citostáticos y se puede ampliar la potencia al emplear fármacos con diferente mecanismo de acción. El inconveniente es que se pueden sumar los efectos tóxicos. Para evitarlo se procura asociar citostáticos con distinta toxicidad.
La mayoría se administran por vía intravenosa y debido a que son muy tóxicos es necesario ajustar la dosis con la mayor precisión posible. Se ajusta por la superficie corporal que deriva del peso y talla. Se administran normalmente en ciclos con períodos de descanso. Con estos periodos de descanso se intenta que las células normales, por ejemplo las de la médula ósea, se recuperen del efecto tóxico del citostático mientras que las tumorales se recuperan en menor cuantía. De esta forma y repitiendo los ciclos se pretende reducir progresivamente el número de células tumorales hasta conseguir su erradicación completamente mientras que las células normales se mantienen al recuperarse después de cada ciclo.
Depresión de la médula ósea
Es uno de los más comunes y graves de muchos citostáticos. Aparecen precozmente a los pocos días de tratamiento y es global ( hay anemia, leucopenia y trombopenia).
Estas alteraciones se pueden paliar, por ejemplo:
- La anemia y la trombopenia se corrigen con transfusiones de hematíes y plaquetas.
- La leucopenia mejora con los fármacos estimulantes de las colonias de granulocitos y las complicaciones infecciosas secundarias a la leucopenia se tratan conantibióticos y medidas de aislamiento.
La depresión medular es con frecuencia un factor limitante en el uso terapéutico de citostáticos.
Afectación de las mucosas del aparato digestivo.
Aunque se puede producir en cualquier zona, lo más frecuente es una intensa inflamación de la mucosa bucofaríngea (estomatitis o mucositis). Si se produce una mucositis son útiles los lavados con una solución de anestésico local extremando las medidas higiénicas de la boca. También suele aplicarse una solución de unantifúngico (Nistatina) para evitar la infección por Candida. Cuando se afecta la mucosa yeyunal puede haber diarrea y hemorragia digestiva.
Afectación de los folículos pilosos
Es frecuente la alopecia total que generalmente se resuelve al finalizar el tratamiento.
Alteración de las gónadas
En las mujeres es frecuente la amenorrea durante la administración de citostáticos pero habitualmente se recuperan los ciclos al interrumpir el tratamiento. En varones puede producir [oligoespermia] y en algunos casos [esterilidad] permanente. Los citostáticos pueden inducir malformaciones u otras enfermedades congénitas, por eso durante el tratamiento y hasta 6 meses después se debe evitar tener descendencia.
Vómitos
Para los cuales los antieméticos clásicos no suelen ser efectivos. El fármaco de elección es el Ondansetron y similares.
Normas para la administración de citostáticos.
Preparación de las soluciones de citostáticos
La manipulación y preparación de estas soluciones entraña un riesgo para la persona encargada de realizarlas, especialmente si este es su trabajo habitual, ya que estas soluciones son irritantes para la piel y las mucosas y en algunos casos pueden absorberse lo suficiente como para producir toxicidad general. Por lo tanto deben tomarse las siguientes precauciones.
- Se preparan en una zona dedicada exclusivamente a ello, provista de una campana de flujo laminar vertical. Esta cabina se ha de limpiar diariamente con alcohol de 70 y semanalmente se hace una descontaminación con una solución de pH básico.
- Se coloca un toalla estéril desechable, absorbente e impermeable en la superficie de la campana para trabajar sobre ella y también se coloca allí todo el material necesario para la manipulación (jeringas, sueros, viales, etc.)
- El personal debe llevar una bata estéril impermeable, de un solo uso, cerrada por delante y con puños elásticos. Se emplean también guantes quirúrgicos de látex estériles que se colocan por debajo de los puños de la bata. Estos guantes se deben cambiar cada hora como máximo y en caso de rotura o contaminación. El gorro y la mascarilla son opcionales excepto que no exista campana, entonces son obligatorios.
- Lavar cuidadosamente las manos antes de la colocación de los guantes y al terminar la preparación.
- Si el citostático se presenta en vial primero se desinfecta el tapón con alcohol de 70, dejándolo evaporar. A continuación se introduce la aguja con un ángulo de 45º con la superficie del tapón y el bisel hacia arriba. Cuando haya penetrado la mitad del bisel entonces se coloca la aguja perpendicularmente siguiendo una técnica que mantenga siempre una presión negativa en el interior del vial. Se puede evitar la formación de aerosoles con filtros de venteo.
- Si el citostático se presenta en una ampolla, antes de abrirla hay que vigilar que no quede líquido en la parte superior. A continuación se protege el cuello con una gasa estéril empapada en alcohol de 70. La ampolla se ha de abrir en la dirección contraria a la del operador. Se recomienda utilizar jeringas de tamaño adecuado porque no se debe ocupar más de las ¾ partes de la capacidad.
- Debe existir un recipiente adecuado, que estará dentro de la campana, para desechar los excesos de solución y todo el material contaminado, que luego se incinera.
- En caso de exposiciones agudas se deben quitar y reemplazar inmediatamente los guantes y las prendas contaminadas y luego lavar las manos con abundante agua y jabón.
- Si nos ha afectado a alguna mucosa se lavará con solución salina (si afecta al ojo ir directamente al oftalmólogo).
- Las mujeres embarazadas no deben preparar citostáticos.
Infusión del citostático
Requiere personal especializado que esté entrenado en el manejo de estos medicamentos debido a los riesgos que puede sufrir el paciente y a la posibilidad de contaminación, tanto del ambiente como del manipulador.
La infusión se hace a través de una cánula corta o de un catéter largo. Lo más frecuente es canalizar una vena en cada tratamiento con una cánula corta de teflón que se retira al terminar la infusión.
Hay que tomar una serie de precauciones:
- Extremar las medidas de asepsia porque estos enfermos en general tienen leucopenia y la inmunidad deprimida.
- Evitar las venas muy finas, inflamadas, en zonas con edemas o en zonas que hayan sido previamente radiadas.
- Asegurarse de que la cánula está bien situada en la vía venosa. Para ello hay que llevar a cabo una prueba con una infusión de solución salina, con el fin de comprobar que hay buen flujo y no hay escapes. El retorno de sangre al aspirar es un dato deseable pero no siempre garantiza que la cánula está bien colocada, especialmente si se han hecho varios intentos para colocarla. En cada tratamiento de citostático se debe cambiar de vena.
- Para la expulsión de posibles burbujas en jeringa se debe colocar una gasa estéril alrededor e impregnada en alcohol.
- Si el citostático es en infusión siempre hay que vigilarlas. Al finalizar la administración del citostático hay que lavar el equipo y la vena con el suero de infusión.
- Todo el material utilizado se debe depositar en envase adecuado para ellos con el rótulo “citostático”. Luego se incinera.
Si el tratamiento con citostáticos va a ser prolongado o resulta difícil obtener una vía venosa cada vez que hay que administrar se suele insertar un catéter largo de teflón o silicona que permanece in situ durante días, semanas o incluso meses. Al terminar la infusión del citostático, el catéter se rellena con una solución de heparina y se cierra. En algunos casos se usan catéteres cuyo extremo proximal termina en un reservorio que se colocan subcutáneos.
Extravasación de soluciones de citostáticos
La extravasación, que es le instilación en el espacio perivascular de agentes citostáticos, es una de las complicaciones que puede ocurrir durante la administración. Puede producir dolor prolongado, infección, artritis (cuando la vena está sobre una articulación), necrosis de la piel y tejido subcutáneo. Los citostáticos más peligrosos son los del grupo de antibióticos y también los cuatro del grupo de la vinca. Todos pueden producir necrosis extensas.
Aun así, casi todos los citostáticos producen molestias locales en el punto de infusión con sensación de quemazón y calor que suele mejorar con aplicación local de frío. Sólo una persona experta puede distinguir estos síntomas con los de una extravasación, que son dolor, hinchazón de la zona alrededor del punto o en sus inmediaciones. La comprobación de la sospecha puede hacerse aspirando con una jeringa a través de la cánula. Si no sale sangre hay extravasación. Si se produce, de deben tomar las siguientes medidas:
- Detener la administración inmediatamente sin retirar la aguja e inmovilizar la extremidad.
- Intentar aspirar por la cánula con un a jeringa para recuperar parte de la solución extravasada.
- Aplicar medidas generales, como infiltrar 50-100 mg de hidrocortisona o aplicar una pomada de hidrocortisona al 1% o bien utilizar el antídoto específico según el citostático implicado.
- Retirar la vía de administración y elevar la extremidad a nivel superior al corazón para mejorar el retorno venoso.
- Vigilar la evolución de la zona afectada, ya que a pesar de todas las medidas se puede producir necrosis que a veces necesita los cuidados de cirugía plástica.
Antineoplásicos
Los medicamentos antineoplásicos, llamados anteriormente citotóxicos o anticancerosos, tienen la capacidad de matar o detener el crecimiento de las células vivas. Se usan en la quimioterapia del cáncer, tratamiento que se realiza generalmente en centros especializados. Es sumamente improbable que formen parte de una donación en situaciones de emergencia. Sin embargo, si no se desea aprovechar estos fármacos, su descarga en el ambiente pueden tener efectos muy graves, como la interferencia con los procesos reproductivos de diversas formas de vida. Por consiguiente, su eliminación debe realizarse con suma atención.
Los antineoplásicos deberán separarse de otros fármacos y guardarse en recipientes de paredes rígidas claramente marcados9. Idealmente deberán envasarse siguiendo estrictas medidas de seguridad y devolverse al proveedor para su eliminación.
Si esto no fuese posible deberán destruirse en un incinerador de dos cámaras a alta temperatura (por lo menos 1200°C en la cámara secundaria) con equipo de limpieza de gases. Es muy importante que tenga una cámara secundaria para destruir los desechos citotóxicos, porque las soluciones antineoplásicas podrían convertirse en un aerosol después de la combustión inicial en la cámara primaria. Si no existiese una cámara secundaria que opera a una temperatura más alta, podría escapar material antineoplásico degradado de la chimenea. La cámara secundaria de combustión asegura la incineración total de las sustancias antineoplásicas.
Nunca deberán arrojarse medicamentos ni desechos antineoplásicos en un vertedero sin encapsular o inertizar. El personal que manipula estos medicamentos deberá evitar aplastar las cajas o extraer el producto de sus envases. Sólo podrán descargarse en el sistema de alcantarillado después de su descomposición química. No deberán descargarse sin tratar en los drenes de agua superficial ni en corrientes de agua naturales.
Drogas Antineoplásicas
5.1 Drogas Antineoplásicas:
-
Alquilantes:
Los agentes de alquilación de uso en quimioterapia tienen en común la propiedad de formar enlaces covalentes con grupos alquilo que sustituyen un átomo de hidrógeno. De esta manera, forman puentes de unión entre las cadenas de ADN (inter-intracatenarios), impidiendo su replicación y explicando los efectos mutágenos y citotóxicos de los agentes de alquilación. Se desconoce la causa última de muerte celular en relación con el daño del ADN. Entre las respuestas celulares específicas están la detención del ciclo celular, la reparación de ADN y la apoptosis.
Los efectos farmacológicos más importantes de los agentes de alquilación son los que alteran los mecanismos fundamentales que intervienen durante todo el ciclo celular, en especial en las fases G1 y S.
Estos fármacos difieren en su patrón de actividad antineoplásica y en los sitios e intensidad de sus efectos adversos. Cabe destacar los siguientes:
Los agentes de alquilación de uso en quimioterapia tienen en común la propiedad de formar enlaces covalentes con grupos alquilo que sustituyen un átomo de hidrógeno. De esta manera, forman puentes de unión entre las cadenas de ADN (inter-intracatenarios), impidiendo su replicación y explicando los efectos mutágenos y citotóxicos de los agentes de alquilación. Se desconoce la causa última de muerte celular en relación con el daño del ADN. Entre las respuestas celulares específicas están la detención del ciclo celular, la reparación de ADN y la apoptosis.
Los efectos farmacológicos más importantes de los agentes de alquilación son los que alteran los mecanismos fundamentales que intervienen durante todo el ciclo celular, en especial en las fases G1 y S.
Estos fármacos difieren en su patrón de actividad antineoplásica y en los sitios e intensidad de sus efectos adversos. Cabe destacar los siguientes:
•
Mielosupresión: variable según el fármaco, especialmente leucopenia.
•
Inmunosupresión reversible: tanto de tipo celular como humoral, por lo que se utilizan también para tratar diferentes enfermedades autoinmunitarias.
•
Oligo/azoospermia: permanente.
•
Amenorrea: temporal.
•
Teratogenicidad: en el primer trimestre del embarazo. Ha de usarse con cautela en etapas ulteriores de la gestación.
•
Carcinogénesis: Leucemias en pacientes tratados por enfermedad de Hodgkin.
-
Tipos de agentes alquilantes:
•
Alquilantes clásicos:
-
Mostaza Nitrogenada (Mecloretamina): derivada de la mostaza sulfurada, sintetizada en 1854, durante la Primera Guerra Mundial. Después de la Segunda Guerra Mundial se descubrió su notable acción citotóxica en el tejido linfoide y en 1943 se trató por primera vez un linfoma con esta droga. Las reacciones locales intensas de los tejidos expuestos, obligaron a la inyección intravenosa de mecloretamina para casi todos los usos clínicos, que incluyen el régimen MOPP (Mecloretamina, ONCOVIN - vincristina -, Procarbazina y Prednisona). Las principales manifestaciones tóxicas agudas son náuseas, vómitos, epífora y mielosupresión, con leucopenia y trombocitopenia.
-
Ciclofosfamida: forma parte de múltiples esquemas terapéuticos pues su espectro clínico de actividad de la ciclofosfamida es muy amplio y se puede administrar por vía oral e intravenosa. También se consideran potentes propiedades inmunosupresoras: este fármaco nos ayuda a controlar el rechazo de órganos transplantados y el control de otros cuadros de naturaleza no neoplásica, que conllevan trastornos de la reactividad inmunitaria, como serían la granulomatosis de Wegener, la artritis reumatoide y el síndrome nefrótico en niños.
Su toxicidad incluye las náuseas y los vómitos frecuentes, tanto si se administra el fármaco por vía parenteral como por vía oral. También puede provocar efectos tóxicos como úlceras en la mucosa, mareos breves, hiperpigmentación cutánea y, con menor frecuencia, fibrosis pulmonar intersticial. En el 5-20% de los pacientes aparece una cistitis hemorrágica estéril y se atribuye a la irritación química por un metabolito secundario e inactivo, la acroleína. Su incidencia disminuye con la administración conjunta de MESNA (un componente sulfhidrílico que reacciona fácilmente con este metabolito en la vejiga). En cuanto a la mielosupresión, presenta diferencias notables respecto a los otros agentes alquilantes, puesto que la trombocitopenia es menos intensa. Hay que tener gran cautela si utilizamos el fármaco en los trastornos de reactividad inmunitaria, no solo por sus efectos tóxicos agudos, sino por la posibilidad de inducir esterilidad, efectos teratógenos y leucemia. La Ifosfamida es un análogo de la ciclofosfamida y aunque produce menor aplasia medular, la grave toxicidad para las vías urinarias (cistitis hemorrágica estéril y nefrotoxicidad) ha limitado su uso. En cuanto a las propiedades farmacocinéticas, se metaboliza de manera similar a la ciclofosfamida aunque se administra solo por vía intravenosa.
Su toxicidad incluye las náuseas y los vómitos frecuentes, tanto si se administra el fármaco por vía parenteral como por vía oral. También puede provocar efectos tóxicos como úlceras en la mucosa, mareos breves, hiperpigmentación cutánea y, con menor frecuencia, fibrosis pulmonar intersticial. En el 5-20% de los pacientes aparece una cistitis hemorrágica estéril y se atribuye a la irritación química por un metabolito secundario e inactivo, la acroleína. Su incidencia disminuye con la administración conjunta de MESNA (un componente sulfhidrílico que reacciona fácilmente con este metabolito en la vejiga). En cuanto a la mielosupresión, presenta diferencias notables respecto a los otros agentes alquilantes, puesto que la trombocitopenia es menos intensa. Hay que tener gran cautela si utilizamos el fármaco en los trastornos de reactividad inmunitaria, no solo por sus efectos tóxicos agudos, sino por la posibilidad de inducir esterilidad, efectos teratógenos y leucemia. La Ifosfamida es un análogo de la ciclofosfamida y aunque produce menor aplasia medular, la grave toxicidad para las vías urinarias (cistitis hemorrágica estéril y nefrotoxicidad) ha limitado su uso. En cuanto a las propiedades farmacocinéticas, se metaboliza de manera similar a la ciclofosfamida aunque se administra solo por vía intravenosa.
-
Melfalan (L-pam): alquilante no vesicante, que se puede administrar por vía oral. Es insoluble en agua y ofrece resistencia por alteraciones en el transporte. El espectro general de acción parece similar al de otras mostazas nitrogenadas en altas dosis de quimioterapia por vía intravenosa. La ventaja de su administración oral, lo hace útil para el tratamiento del mieloma múltiple. Su toxicidad es de tipo hematológico con nadir tardío, digestiva y leucemogénica, pero en pocas ocasiones induce náuseas y vómitos.
-
Clorambucil: su uso clínico incluye leucemias y linfomas (específicamente leucemia linfocítica crónica y macroglobulinemia de Waldenström) y cáncer de ovario. Su absorción es adecuada y fiable por la vía oral.
-
Busulfán: se trata de un alquisulfonato y también es un agente alquilante. Se absorbe adecuadamente por vía oral. Este fármaco se distingue por tener pocos efectos farmacológicos en las dosis habituales, excepto la inmunosupresión. En dosis bajas es evidente la depresión selectiva de la granulocitopoyesis y es por esto por lo que se utiliza en la fase crónica de la leucemia granulocítica crónica. Si se aumentan la dosis puede provocar aplasia medular y así una pancitopenia intensa y duradera. Su toxicidad a dosis altas se manifiesta como fibrosis pulmonar intersticial y enfermedad venooclusiva hepática.
•
Nitrosoureas: Tienen importancia en el tratamiento de los tumores cerebrales puesto que son fármacos liposolubles, capaces de atravesar la BHE. Su acción antineoplásica es independiente de la fase del ciclo. Ofrecen resistencia por incremento de la síntesis y la actividad de la glutatión-S-transferasa. Como ocurre en otros agentes de alquilación, las nitrosoureas son altamente son carcinógenas y mutágenas y producen toxicidad gastrointestinal y hematológica.
-
Carmustina (BCNU): el espectro de actividad es semejante al de otros agentes de alquilación, pero por su capacidad de atravesar la BHE, este fármaco se utiliza en esquemas que involucran el tratamiento de astrocitomas malignos, metástasis cerebrales, linfomas de Hodgkin y en el mieloma. Hoy en día se está usando como implantes intersticiales en pacientes con recidivas de glioblastoma multiforme. Produce depresión hematológica tardía y en dosis altas, fibrosis pulmonar e insuficiencia renal. Se administra por vía intravenosa. La Lomustina (CCNU) es muy semejante a la BCNU y se administra por vía oral.
-
Estreptozocina: se trata de una nitrosourea natural producida por el Streptomyces acromogenes. Es particularmente útil para tratar carcinoides (tumores funcionales) y malignos de células insulares del páncreas. Afecta a las células en todas las etapas del ciclo celular. La Clorozotocina es un análogo de menor toxicidad hematológica.
•
Alquitriazenos:
-
Dacarbazina (DTIC): actúa como agente metilante después de su activación metabólica por el hígado. Destruye células en todas las fases de su ciclo. Se administra por vía intravenosa y su extravasación puede ocasionar daño tisular y dolor intenso. Actúa sinérgicamente con la adriamicina. Su uso clínico incluye regímenes de combinación para el melanoma maligno, linfomas y sarcomas de partes blandas. En cuanto su toxicidad, es característica su capacidad emetógena (náuseas y vómitos en más del 90% de los enfermos). También se han señalado reacciones de fotosensibilidad.
•
Antibióticos:
Se trata de sustancias naturales producidas por microorganismos (hongos) con capacidad de interferir con el crecimiento de otras células, ya sean eucariotas o procariotas.
Se trata de sustancias naturales producidas por microorganismos (hongos) con capacidad de interferir con el crecimiento de otras células, ya sean eucariotas o procariotas.
-
Antraciclinas:
Doxorrubicina (adriamicina): es uno de los agentes antitumorales más importantes. Está producido por el hongo Streptomyces peucetius varcaesius. Estos compuestos se intercalan entre las bases de ADN y de ese modo afectan muchas funciones de éste, que inhiben la síntesis de ADN y ARN. Producen roturas simples o dobles en filamentos de ADN, a través de alteraciones en aquellas reacciones mediadas por la topoisomerasa II, que mantiene la estructura terciaria del ADN. Además, la reducción de estos compuestos dentro de la célula, induce la formación de radicales libres. Por ello, se puede considerar que estos fármacos son mutágenos y, por consiguiente, carcinógenos. Además, los radicales libres dan lugar a la peroxidación de lípidos de la membrana celular. Las defensas enzimáticas como la SOD y la catalasa contribuyen notablemente a proteger a la célula contra la toxicidad de las antraciclinas, y dichas defensas pueden ser intensificadas por antioxidantes exógenos como el a-tocoferol o por quelantes de hierro. Las antraciclinas también interactúan directamente con las membranas celulares y alteran sus funciones, lo cual pueden tener importancia en los efectos antitumorales y la toxicidad cardiaca de dichos medicamentos. La administración es intravenosa, se metabolizan en el hígado y no atraviesan la BHE.
La doxorrubicina se usa en muchas combinaciones para tratar tumores sólidos, en particular el cáncer de mama, carcinoma de ovario y el de células pequeñas de pulmón y otros. Si bien la toxicidad hematológica en forma de mielosupresión, especialmente leucopenia, limita frecuentemente en términos de dosis/tiempo la administración de los ciclos de quimioterapia.
La adriamicina presenta una toxicidad característica cardiaca que limita la dosis total a administrar. Se presenta de forma aguda y crónica.
Es preciso mantener una dosis límite y máxima de 550 mg/m2 aunque hay pacientes que con dosis menores desarrollan cardiotoxicidad. El 10% de los pacientes que toman esta medicación mostrarán datos de cardiopatía. Otros fármacos, análogos de la doxorrubicina son la Epirrubicina de uso más extendido debido a la menor toxicidad cardiaca y la Daunorrubicina, utilizada en tumores hematológicos.
Actinomicina D (Dactinomicina): el empleo clínico más importante está en el tratamiento del rabdomiosarcoma y el tumor de Wilms en niños. Su toxicidad incluye anorexia, náuseas y vómitos, mielosupresión y manifestaciones dermatológicas, con alopecia, además de eritema, descamación, mayor inflamación y pigmentación de áreas sometidas a radiación. La extravasación local puede ocasionar lesión grave.
Mitomicina C: Derivada del Streptomyces caepitosus. Se utiliza como parte de regímenes de combinación para tratar el cáncer de colon, estómago y cáncer de pulmón. También se usa en instilación directa en la vejiga para tratar carcinomas superficiales de este órgano. Es eficaz en las fases G1 y S ya que actúa como un agente alquilante. Su principal efecto tóxico es la mielosupresión, pero también produce problemas gastrointestinales, fibrosis pulmonar intersticial y síndrome urémico-hemolítico.
Bleomicina: Derivada del Streptomyces verticillos. Tiene una notable actividad antitumoral frente a tumores testiculares, linfomas y carcinomas escamosos de cabeza y cuello y pulmón. No produce toxicidad hematológica lo que permite su fácil combinación con otros fármacos. Fragmentan el ADN al producir complejos catalíticos bleomicina/hierro que al interactuar con el oxígeno producen radicales libres. Al romper las cadenas de ADN, se acumulan células en G2 y muchas de estas muestran aberraciones cromosómicas que incluyen rotura de cromátides, huecos y fragmentos, siendo eficaces en las fases G2 y M. Se administra por vía intravenosa o intramuscular y su extravasación no resulta vesicante. Se degrada por enzimas hepáticos (hidrolasas). También puede instilarse en las cavidades naturales (por ejemplo derrames pleurales malignos). La bleomicina ocasiona poca mielosupresión. La reacción adversa más grave es la fibrosis pulmonar. La sufren el 10% de los enfermos y resulta mortal en un 1%. Esta neumonitis comienza con tos seca, estertores finos e infiltrados en vasos pulmonares. Se trata de una fibrosis progresiva e irreversible. Este fármaco también puede dar lugar a una reacción de hipersensibilidad aguda. Los factores de riesgo para padecer toxicidad incluyen: edad, dosis, administración concomitante de otros fármacos antineoplásicos, radioterapia o patología de base. Además, la administración de grandes concentraciones de oxígeno puede agravar o desencadenar toxicidad pulmonar en individuos que recibieron el fármaco.
Doxorrubicina (adriamicina): es uno de los agentes antitumorales más importantes. Está producido por el hongo Streptomyces peucetius varcaesius. Estos compuestos se intercalan entre las bases de ADN y de ese modo afectan muchas funciones de éste, que inhiben la síntesis de ADN y ARN. Producen roturas simples o dobles en filamentos de ADN, a través de alteraciones en aquellas reacciones mediadas por la topoisomerasa II, que mantiene la estructura terciaria del ADN. Además, la reducción de estos compuestos dentro de la célula, induce la formación de radicales libres. Por ello, se puede considerar que estos fármacos son mutágenos y, por consiguiente, carcinógenos. Además, los radicales libres dan lugar a la peroxidación de lípidos de la membrana celular. Las defensas enzimáticas como la SOD y la catalasa contribuyen notablemente a proteger a la célula contra la toxicidad de las antraciclinas, y dichas defensas pueden ser intensificadas por antioxidantes exógenos como el a-tocoferol o por quelantes de hierro. Las antraciclinas también interactúan directamente con las membranas celulares y alteran sus funciones, lo cual pueden tener importancia en los efectos antitumorales y la toxicidad cardiaca de dichos medicamentos. La administración es intravenosa, se metabolizan en el hígado y no atraviesan la BHE.
La doxorrubicina se usa en muchas combinaciones para tratar tumores sólidos, en particular el cáncer de mama, carcinoma de ovario y el de células pequeñas de pulmón y otros. Si bien la toxicidad hematológica en forma de mielosupresión, especialmente leucopenia, limita frecuentemente en términos de dosis/tiempo la administración de los ciclos de quimioterapia.
La adriamicina presenta una toxicidad característica cardiaca que limita la dosis total a administrar. Se presenta de forma aguda y crónica.
Aguda: es independiente de la dosis, se presenta en el plazo de horas o días y se caracteriza por datos en ECG anormales, con alteraciones del intervalo ST, onda T y bloqueos. Estos cambios se acompañan de una disminución de la fracción de eyección. No obstante, se trata de un cuadro breve que rara vez constituye un problema grave.
Crónica: la toxicidad crónica acumulativa relacionada con las dosis se manifiesta por ICC que no mejora con digitálicos. En microscopía electrónica, se identifican alteraciones inespecíficas producidas por alteraciones de la membrana por radicales libres lo que conlleva apoptosis en las células del miocardio. La probabilidad de esta complicación está incrementada en cardiópatas, por lo que en éstos siempre hay que medir la fracción de eyección previamente al inicio del tratamiento. Además, la edad avanzada, la administración concomitante de radioterapia u otros fármacos antineoplásicos incrementan el riesgo de padecer este cuadro.
Actinomicina D (Dactinomicina): el empleo clínico más importante está en el tratamiento del rabdomiosarcoma y el tumor de Wilms en niños. Su toxicidad incluye anorexia, náuseas y vómitos, mielosupresión y manifestaciones dermatológicas, con alopecia, además de eritema, descamación, mayor inflamación y pigmentación de áreas sometidas a radiación. La extravasación local puede ocasionar lesión grave.
Mitomicina C: Derivada del Streptomyces caepitosus. Se utiliza como parte de regímenes de combinación para tratar el cáncer de colon, estómago y cáncer de pulmón. También se usa en instilación directa en la vejiga para tratar carcinomas superficiales de este órgano. Es eficaz en las fases G1 y S ya que actúa como un agente alquilante. Su principal efecto tóxico es la mielosupresión, pero también produce problemas gastrointestinales, fibrosis pulmonar intersticial y síndrome urémico-hemolítico.
Bleomicina: Derivada del Streptomyces verticillos. Tiene una notable actividad antitumoral frente a tumores testiculares, linfomas y carcinomas escamosos de cabeza y cuello y pulmón. No produce toxicidad hematológica lo que permite su fácil combinación con otros fármacos. Fragmentan el ADN al producir complejos catalíticos bleomicina/hierro que al interactuar con el oxígeno producen radicales libres. Al romper las cadenas de ADN, se acumulan células en G2 y muchas de estas muestran aberraciones cromosómicas que incluyen rotura de cromátides, huecos y fragmentos, siendo eficaces en las fases G2 y M. Se administra por vía intravenosa o intramuscular y su extravasación no resulta vesicante. Se degrada por enzimas hepáticos (hidrolasas). También puede instilarse en las cavidades naturales (por ejemplo derrames pleurales malignos). La bleomicina ocasiona poca mielosupresión. La reacción adversa más grave es la fibrosis pulmonar. La sufren el 10% de los enfermos y resulta mortal en un 1%. Esta neumonitis comienza con tos seca, estertores finos e infiltrados en vasos pulmonares. Se trata de una fibrosis progresiva e irreversible. Este fármaco también puede dar lugar a una reacción de hipersensibilidad aguda. Los factores de riesgo para padecer toxicidad incluyen: edad, dosis, administración concomitante de otros fármacos antineoplásicos, radioterapia o patología de base. Además, la administración de grandes concentraciones de oxígeno puede agravar o desencadenar toxicidad pulmonar en individuos que recibieron el fármaco.
•
Alcaloides derivados de las plantas:
-
Alcaloides de la Vinca: se consideran "venenos del huso", ya que estos compuestos se unen a la tubulina e interfieren con la formación del huso mitótico, bloqueando la facultad de esta proteína para polimerizarse en microtúbulos. Los microtúbulos, además de su intervención en la formación de los husos mitóticos, intervienen en otras funciones celulares tales como los movimientos de fagocitosis y transporte axónico, lo que explicaría su neurotoxicidad. De esta manera estos compuestos alteran la división celular bloqueando las células que están llevando a cabo la mitosis. Existen cuatro alcaloides naturales extraídos de la vinca. La Vincristina es un componente estándar de regímenes para tratar leucemias y tumores sólidos en niños, y se usa a menudo en el tratamiento de linfomas en adultos. La Vinblastina se utiliza para tratar carcinomas o linfomas testiculares, y como terapia de segunda línea de varios tumores sólidos. La Vinorelbina posee una gran actividad como monofármaco contra cánceres distintos del pulmonar de células pequeñas y de mama. La Vindesina se ha utilizado ante todo en protocolos experimentales con cisplatino en el tratamiento del cáncer de pulmón y melanomas. La acción mielosupresora limitada de la vincristina la convierte en un componente útil de diversos regímenes de combinación, en tanto que la falta de neurotoxicidad de la vinblastina constituye una ventaja neta en los linfomas recidivantes y en combinación con el cisplatino. La vincristina tiene efectos neurotóxicos acumulativos predecibles. Los signos más frecuentes y tempranos son:
• • Insensibilidad y parestesias en las extremidades.
• • Pérdidas de reflejos tendinosos profundos.
• • Debilidad de los músculos distales de las extremidades.
• • Dolores neuríticos.
Las dosis altas de vincristina ocasionan estreñimiento y obstrucción intestinal. Sin embargo, tanto estas complicaciones como las anteriormente mencionadas son reversibles en una gran parte de los fármacos. La pérdida de la función motora debe obligar al clínico a reevaluar el plan terapéutico, y en casi todos los fármacos interrumpir el uso del mismo.
-
Epidofilotoxinas: Derivan de Podophylum peltatum (podofilotoxina). Se han obtenido dos glucósidos semisintéticos del principio activo podofilotoxina, el Etopósido (VP-16) y el Tenipósido (VM-26). La Podofilotoxina se liga a la tubulina en un sitio diferente a aquél en que ocurre la interacción por los alcaloides de la vinca, pero el
Neurotoxicidad
|
Alopecia
|
Leucopenia
|
Mucositis
| |
Vincristina
Vinblastina Vindesina Vinorelbina |
Alta
Baja Baja Muy Baja |
Alta
Baja Moderada Moderada |
Baja
Muy Alta Moderada Alta |
Muy Baja
Moderada Baja Moderada |
etopósido y el tenipósido no tienen efectos en la estructura y función microtubulares en las concentraciones usuales. Estos compuestos forman un complejo terciario con la topoisomerasa III y el ADN, lo que ocasiona roturas en el ADN, que se acumulan y provocan la muerte celular. Las células que están en las fases G2 y S del ciclo son más sensibles al etopósido y al tenipósido. También se han relacionado su acción con activaciones de los sistemas de oxidorreducción.
En individuos con insuficiencia renal, debe disminuirse la dosis en proporción a la reducción de la depuración de creatinina. La vía de administración es intravenosa para los dos fármacos y además el VP-16 puede administrarse por vía oral.
El Etopósido halla sus principales aplicaciones en el tratamiento de tumores testiculares, en combinación con bleomicina y cisplatino, y en el de carcinoma de células pequeñas de pulmón, en combinación con cisplatino solo. También es activo contra linfomas no Hodgkin, leucemia no linfocítica aguda, carcinoma de mama y sarcoma de Kaposi. El Tenipósido se usa en el tratamiento de la leucemia linfoblástica aguda infantil refractaria.
Su toxicidad incluye neutropenia, que limita la dosificación, y síntomas inespecíficos. La neurotoxicidad es reducida.
En individuos con insuficiencia renal, debe disminuirse la dosis en proporción a la reducción de la depuración de creatinina. La vía de administración es intravenosa para los dos fármacos y además el VP-16 puede administrarse por vía oral.
El Etopósido halla sus principales aplicaciones en el tratamiento de tumores testiculares, en combinación con bleomicina y cisplatino, y en el de carcinoma de células pequeñas de pulmón, en combinación con cisplatino solo. También es activo contra linfomas no Hodgkin, leucemia no linfocítica aguda, carcinoma de mama y sarcoma de Kaposi. El Tenipósido se usa en el tratamiento de la leucemia linfoblástica aguda infantil refractaria.
Su toxicidad incluye neutropenia, que limita la dosificación, y síntomas inespecíficos. La neurotoxicidad es reducida.
-
Alcaloides del tejo:
Paclitaxel (Taxol): Deriva del Taxus brevifolia. Induce polimerización de los microtúbulos creando uniones estables no funcionantes que impiden la posterior despolimerización, interfiriendo con la división normal de la célula y los procesos que se desarrollan en la interfase. Afecta a la subunidad ß de la tubulina. En la actualidad su uso clínico es muy amplio incluyendo, el carcinoma de ovario, mama, pulmón y cabeza y cuello. Entre su toxicidad se incluye la afectación de la médula ósea. No obstante, es la neuropatía sensitiva periférica el factor limitante de la dosis, siendo reversible.
Taxotere (Docetaxol): Deriva del Taxus baccata. Su mecanismo de acción es similar al del taxol, aunque éste es más potente y más mielosupresivo. Su uso clínico está menos extendido, incluye ovario, mama y pulmón.
Camptotecinas: alcaloide vegetal derivado de Camptotheca accuminata. Se distinguen dos derivados el Topotecan y el Irinotecan (CPT-11). Su mecanismo de acción es la inhibición de la topoisomerasa I, enzima relacionada con la reparación y síntesis del DNA. Actúan sobre las células en fase S y G2. Se usa como fármaco de primera línea del cáncer colorrectal avanzado. Entre las toxicidades mas relevantes están la hematológica, digestiva y síndrome colinérgico precoz.
Paclitaxel (Taxol): Deriva del Taxus brevifolia. Induce polimerización de los microtúbulos creando uniones estables no funcionantes que impiden la posterior despolimerización, interfiriendo con la división normal de la célula y los procesos que se desarrollan en la interfase. Afecta a la subunidad ß de la tubulina. En la actualidad su uso clínico es muy amplio incluyendo, el carcinoma de ovario, mama, pulmón y cabeza y cuello. Entre su toxicidad se incluye la afectación de la médula ósea. No obstante, es la neuropatía sensitiva periférica el factor limitante de la dosis, siendo reversible.
Taxotere (Docetaxol): Deriva del Taxus baccata. Su mecanismo de acción es similar al del taxol, aunque éste es más potente y más mielosupresivo. Su uso clínico está menos extendido, incluye ovario, mama y pulmón.
Camptotecinas: alcaloide vegetal derivado de Camptotheca accuminata. Se distinguen dos derivados el Topotecan y el Irinotecan (CPT-11). Su mecanismo de acción es la inhibición de la topoisomerasa I, enzima relacionada con la reparación y síntesis del DNA. Actúan sobre las células en fase S y G2. Se usa como fármaco de primera línea del cáncer colorrectal avanzado. Entre las toxicidades mas relevantes están la hematológica, digestiva y síndrome colinérgico precoz.
-
Antimetabolitos:
•
Antifólicos:
-
Metrotexate: tiene un amplio espectro de acción. Se une de forma competitiva a la dihidrofolato reductasa. Esta enzima cataliza la conversión de dihidrofolato a tetrahidrofolato. Este compuesto es un transportador de los grupos monocarbonados que son necesarios para la síntesis de purinas y pirimidinas, y por ende del ADN. Dado su mecanismo de acción actúa en la fase S del ciclo. Se puede administrar por vía intravenosa, intramuscular, oral e intratecal (muy importante para tratar la diseminación leptomeningea de leucemias y tumores sólidos). Sus toxicidades más comunes son mielosupresión, mucositis y fibrosis pulmonar.
•
Tomudex: Es un fármaco que inhibe de forma específica la timidilato sintetasa. Esta enzima convierte el ácido uridílico en timidilato, uno de los deoxinucleótidos necesarios para la síntesis de ADN. Su bloqueo impide la síntesis de ADN, actuando en la fase S del ciclo celular. El fármaco se administra por vía intravenosa. Su uso clínico fundamental es el cáncer de colon. Entre sus efectos secundarios destacan la toxicidad gastrointestinal y la leucopenia.
•
Análogos de las purinas Mercaptopurina, Tioguanina, Azatioprina.
•
Análogos de las pirimidinas
-
5-Fluorouracilo: este fármaco compite por la timidilato sintetasa, desplazando al sustrato principal que es el ácido uridílico, impidiendo la síntesis de timidina y por tanto la síntesis del ADN. Actúa en la fase S del ciclo celular. Se administra por vía intravenosa, intracavitaria y tópica como tratamiento paliativo en tumores cutáneos. Su toxicidad fundamental es la gastrointestinal y la hematológica. El Ftorafur y el UFT son fármacos similares al 5-Fu que se administran por vía oral. La Floxuridina, se utiliza en esquemas de quimioterapia intratarterial.
-
Arabinósido de citosina: este fármaco es un análogo de la citidina y deoxicitidina. Su forma intracelular activa (trifosfato) inhibe la ADN polimerasa. Se utiliza por via parenteral e intratecal y es útil en el tratamiento de las leucemias. Su toxicidad fundamental es hematológica y gastrointestinal
-
Gemcitabina: es un análogo de la desoxicitidina, con una estructura similar a la del arabinósido de citosina. Tiene actividad frente a tumores sólidos especialmente pulmón y páncreas. Inhibe la síntesis de ADN.
-
Análogos de la adenosina:Fludarabina, Pentostatina, Clorodeoxiadenosina.
-
Cisplatino y derivados
El Cisplatino es un fármaco que formación de enlaces covalentes intra o intercatenarios en el ADN, inhibiendo su síntesis. Además, puede alterar el transporte a través de membrana de aminoácidos y alterar los canales de calcio, por unión a proteínas citoplasmáticas. Es un agente no ciclo específico aunque es más efectivo sobre células en fase G1. Se administra por vía intravenosa y su eliminación es fundamentalmente renal.
Es un fármaco que se usa en una gran variedad de neoplasias, que incluye entre otros tumores epidermoides de cualquier localización, en tumores de cabeza y cuello y en tumores testiculares y de ovario. Es un importante agente radiosensibilizante, usándose de forma estándar en el tratamiento de tumores de cervix y cabeza y cuello, de forma concomitante con la irradiación radical.
Los efectos secundarios más importantes incluyen la toxicidad renal importante, produciendo esclerosis glomerular, fibrosis intersticial, necrosis tubular. Estas lesiones levan a insuficiencia renal. Por lo tanto, es muy importante asegurar una adecuada unción renal previa al tratamiento y mantener un estado de hidratación adecuada del aciente. Es por otra parte uno de las drogas antineoplásicas más emetógenas, especialmente a dosis altas. Otros efectos secundarios son la neuro y ototoxicidad. Produce leucopenia y trombocitopenia moderada.
El Carboplatino tiene el mismo mecanismo de acción pero con menor toxicidad renal, lo que ha incrementado su uso en sustitución del cisplatino. Se administra también por vía intravenosa y su eliminación es renal. Su principal efecto secundario es la trombopenia, aunque también produce toxicidad digestiva y renal, en menor medida. Otro análogo es el Oxaliplatino, muy útil en tumores de colon.
El Cisplatino es un fármaco que formación de enlaces covalentes intra o intercatenarios en el ADN, inhibiendo su síntesis. Además, puede alterar el transporte a través de membrana de aminoácidos y alterar los canales de calcio, por unión a proteínas citoplasmáticas. Es un agente no ciclo específico aunque es más efectivo sobre células en fase G1. Se administra por vía intravenosa y su eliminación es fundamentalmente renal.
Es un fármaco que se usa en una gran variedad de neoplasias, que incluye entre otros tumores epidermoides de cualquier localización, en tumores de cabeza y cuello y en tumores testiculares y de ovario. Es un importante agente radiosensibilizante, usándose de forma estándar en el tratamiento de tumores de cervix y cabeza y cuello, de forma concomitante con la irradiación radical.
Los efectos secundarios más importantes incluyen la toxicidad renal importante, produciendo esclerosis glomerular, fibrosis intersticial, necrosis tubular. Estas lesiones levan a insuficiencia renal. Por lo tanto, es muy importante asegurar una adecuada unción renal previa al tratamiento y mantener un estado de hidratación adecuada del aciente. Es por otra parte uno de las drogas antineoplásicas más emetógenas, especialmente a dosis altas. Otros efectos secundarios son la neuro y ototoxicidad. Produce leucopenia y trombocitopenia moderada.
El Carboplatino tiene el mismo mecanismo de acción pero con menor toxicidad renal, lo que ha incrementado su uso en sustitución del cisplatino. Se administra también por vía intravenosa y su eliminación es renal. Su principal efecto secundario es la trombopenia, aunque también produce toxicidad digestiva y renal, en menor medida. Otro análogo es el Oxaliplatino, muy útil en tumores de colon.






No hay comentarios:
Publicar un comentario