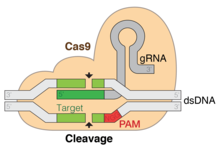
La edición del gen CRISPR es un método por el cual se pueden editar los genomas de los organismos vivos. Se basa en una versión simplificada del sistema de defensa antiviral bacteriano CRISPR / Cas (CRISPR-Cas9). Al administrar la nucleasa Cas9 complejada con un ARN guía sintético (gRNA) a una célula, el genoma de la célula se puede cortar en una ubicación deseada, lo que permite eliminar los genes existentes y / o agregar otros nuevos. [1] El complejo Cas9-gRNA se corresponde con el complejo CAS III CRISPR-RNA en el diagrama adjunto.
Si bien la edición genómica en células eucariotas ha sido posible utilizando varios métodos desde la década de 1980, los métodos empleados demostraron ser ineficientes y poco prácticos de implementar a gran escala. La edición genómica conduce a cambios irreversibles en el gen. Trabajando como tijeras genéticas, la nucleasa Cas9 abre ambas cadenas de la secuencia de ADN dirigida para introducir la modificación por uno de dos métodos. Las mutaciones de Knock-in, facilitadas a través de Homology Directed Repair (HDR), es la vía tradicional de los enfoques de edición genómica dirigida. [2] Esto permite la introducción de daños y reparaciones específicos del ADN. HDR emplea el uso de secuencias de ADN similares para impulsar la reparación de la rotura a través de la incorporación de ADN exógeno para funcionar como la plantilla de reparación. [2]Este método se basa en la aparición periódica y aislada de daños en el ADN en el sitio objetivo para que comience una reparación. Las mutaciones de Knock-out causadas por Cas9 / CRISPR dan como resultado la reparación de la rotura de doble cadena por medio de NHEJ (Unión de extremos no homóloga). El NHEJ a menudo puede dar como resultado eliminaciones o inserciones aleatorias en el sitio de reparación que interrumpen o alteran la funcionalidad del gen. Por lo tanto, la ingeniería genómica de CRISPR-Cas9 permite a los investigadores la capacidad de generar alteraciones genéticas aleatorias dirigidas.
Debido a esto, la precisión de la edición genómica es una gran preocupación. Con el descubrimiento de CRISPR y específicamente la molécula de nucleasa Cas9, la edición eficiente y altamente selectiva es ahora una realidad. Cas9 permite un método confiable para crear una ruptura dirigida en un lugar específico como lo designan las cadenas guía crRNA y tracrRna. [3] Cas9 derivado de Streptococcus pyogenesLas bacterias han facilitado la modificación genómica dirigida en las células eucariotas. La facilidad con la que los investigadores pueden insertar Cas9 y el ARN de plantilla para silenciar o causar mutaciones puntuales en loci específicos ha demostrado ser invaluable para el mapeo rápido y eficiente de modelos genómicos y procesos biológicos asociados con varios genes en una variedad de eucariotas. Se ha desarrollado una nueva variante de ingeniería de la nucleasa Cas9 que reduce significativamente la manipulación fuera del objetivo. Llamado spCas9-HF1 (Streptococcus pyogenes Cas9 High Fidelity 1), tiene una tasa de éxito de modificación in vivo del 85% y manipulaciones no detectables fuera del objetivo según lo medido por la captura de ruptura de genoma y los métodos de secuenciación específicos utilizados para medir los cambios genómicos totales. [4] [5]
Las técnicas de edición del genoma de CRISPR-Cas tienen muchas aplicaciones potenciales, incluidas la mejora de la medicina y las semillas de cultivos. El uso del complejo CRISPR-Cas9-gRNA para la edición del genoma [6]fue la elección de AAAS para el avance del año en 2015. [7] Se han planteado preocupaciones bioéticas sobre la posibilidad de utilizar CRISPR para la edición de la línea germinal .
Predecesores [ editar ]
A principios de la década de 2000, los investigadores desarrollaron nucleasas de dedos de zinc (ZFN), proteínas sintéticas cuyos dominios de unión al ADN les permiten crear rupturas de doble cadena en el ADN en puntos específicos. En 2010, las nucleasas sintéticas llamadas nucleasas efectoras de tipo activador de la transcripción(TALEN, por sus siglas en inglés) proporcionaron una manera más fácil de dirigir una ruptura de doble cadena a una ubicación específica en la cadena de ADN. Tanto las nucleasas de dedo de zinc como las TALEN requieren la creación de una proteína personalizada para cada secuencia de ADN dirigida, que es un proceso más difícil y lento que el de los ARN de guía. Los CRISPR son mucho más fáciles de diseñar porque el proceso requiere hacer solo una secuencia corta de ARN. [9]
Considerando que la interferencia de ARN (RNAi) no suprime totalmente la función del gen, CRISPR, ZFNs y Talens proporcionar completo irreversible gen knockout . [10] CRISPR también puede apuntar a varios sitios de ADN simultáneamente al simplemente introducir diferentes ARNg. Además, los costos de CRISPR son relativamente bajos. [10] [11] [12]
La ingeniería del genoma [ editar ]
La edición del genoma CRISPR-Cas9 se lleva a cabo con un sistema CRISPR Tipo II . Cuando se utiliza para la edición del genoma, este sistema incluye Cas9 , crRNA, tracrRNA junto con una sección opcional de plantilla de reparación de ADN que se utiliza en la unión de extremos no homólogos (NHEJ) o en la reparación dirigida por homología (HDR).
Componentes principales [ editar ]
| Componente | Función |
|---|---|
| ARNm | Contiene la guía de ARN que localiza la sección correcta del ADN del huésped junto con una región que se une a tracrRNA (generalmente enforma de bucle de horquilla ) formando un complejo activo. |
| tracrRNA | Se une al crRNA y forma un complejo activo. |
| sgRNA | Los ARN de guía única son un ARN combinado que consiste en untracrRNA y al menos un crRNA |
| Cas9 | Proteína cuya forma activa es capaz de modificar el ADN. Existen muchas variantes con funciones diferentes (es decir, corte de una sola hebra, rotura de doble hebra, unión al ADN) debido a la función de reconocimiento del sitio del ADN de Cas9. |
| Plantilla de reparación | ADN que guía el proceso de reparación celular y permite la inserción de una secuencia de ADN específica |
CRISPR-Cas9 a menudo emplea un plásmido para transfectar las células diana. [13] Los componentes principales de este plásmido se muestran en la imagen y se enumeran en la tabla. El crRNA debe diseñarse para cada aplicación ya que esta es la secuencia que utiliza Cas9 para identificar y unirse directamente al ADN de la célula. El crRNA debe unirse solo donde se desea la edición. La plantilla de reparación está diseñada para cada aplicación, ya que debe superponerse con las secuencias a cada lado del corte y el código para la secuencia de inserción.
Múltiples crRNAs y tracrRNA se pueden empaquetar juntos para formar un ARN de guía única (sgRNA). [14] Este sgRNA se puede unir junto con el gen Cas9 y convertirse en un plásmido para transfectarse en las células.
Estructura [ editar ]
CRISPR-Cas9 ofrece un alto grado de fidelidad y una construcción relativamente simple. Depende de dos factores para su especificidad: la secuencia de destino y el PAM. La secuencia objetivo tiene una longitud de 20 bases como parte de cada locus CRISPR en la matriz crRNA. [13] Una matriz de crRNA típica tiene múltiples secuencias diana únicas. Las proteínas Cas9 seleccionan la ubicación correcta en el genoma del huésped mediante la utilización de la secuencia para unirse con pares de bases en el ADN del huésped. La secuencia no es parte de la proteína Cas9 y, como resultado, es personalizable y se puede sintetizar de forma independiente . [15] [16]
La secuencia PAM en el genoma del hospedador es reconocida por Cas9. Cas9 no se puede modificar fácilmente para reconocer una secuencia PAM diferente. Sin embargo, esto no es demasiado limitante, ya que es una secuencia corta y no específica (por ejemplo, la secuencia PAM de SpCas9 es 5'-NGG-3 'y en el genoma humano ocurre aproximadamente cada 8 a 12 pares de bases). [13]
Una vez que estos se han ensamblado en un plásmido y se han transfectado en células, la proteína Cas9 con la ayuda del crRNA encuentra la secuencia correcta en el ADN de la célula huésped y, según la variante de Cas9, crea una ruptura de cadena simple o doble en el ADN. [17]
Las roturas de una sola hebra correctamente espaciadas en el ADN del host pueden desencadenar una reparación dirigida por homología , que es menos propensa a errores que la unión final no homóloga que normalmente sigue a una ruptura de doble hebra. Proporcionar una plantilla de reparación de ADN permite la inserción de una secuencia de ADN específica en una ubicación exacta dentro del genoma. La plantilla de reparación debe extenderse de 40 a 90 pares de bases más allá de la ruptura del ADN inducida por Cas9. [13] El objetivo es que el proceso HDR de la célula utilice la plantilla de reparación provista y, por lo tanto, incorpore la nueva secuencia en el genoma. Una vez incorporada, esta nueva secuencia ahora es parte del material genético de la célula y pasa a las células hijas.
Muchas herramientas en línea están disponibles para ayudar en el diseño de secuencias de sgRNA eficaces. [18] [19]
Entrega [ editar ]
El suministro de Cas9, sgRNA y complejos asociados a las células puede ocurrir a través de sistemas virales y no virales. La electroporación de ADN, ARN o ribonucleocomplejos es una técnica común, aunque puede producir efectos dañinos en las células diana. [20] Las técnicas de transfección química que utilizan lípidostambién se han utilizado para introducir ARNgc en complejo con Cas9 en las células. [21] Las células difíciles de transfectar (por ejemplo, células madre, neuronas y células hematopoyéticas) requieren sistemas de administración más eficientes, como los basados en lentivirus (LV), adenovirus (AdV) y virus adenoasociados(AAV). [22] [23]
Edición genoma controlado [ editar ]
Varias variantes de CRISPR-Cas9 permiten la activación de genes o la edición del genoma con un disparador externo, como moléculas ligeras o pequeñas. [24] [25] [26] Estos incluyen sistemas CRISPR fotoactivables desarrollados mediante la fusión de proteínas asociadas que responden a la luz con un dominio activador y un dCas9 para la activación génica, [27] [28] o que fusionan dominios similares que responden a la luz con dos construcciones de división -Cas9, [29] [30] o incorporando aminoácidos no naturales enjaulados en Cas9, [31] o modificando los ARN de guía con complementos que se pueden fotocopiar para la edición del genoma. [32]
Los métodos para controlar la edición del genoma con moléculas pequeñas incluyen un Cas9 alostérico, sin edición de fondo detectable, que activará la unión y la escisión al agregar 4-hidroxitamoxifeno (4-HT), [24] Cas9s ligado a inteína sensible a 4-HT [ 33] o un Cas9 que responde a 4-HT cuando se fusiona con cuatro dominios ERT2. [34] Intein inducible split-Cas9 permite la dimerización de los fragmentos Cas9 [35] y el sistema split-Cas9 inducible por rapamicina , desarrollado mediante la fusión de dos construcciones de Cas9 dividido con los fragmentos FRB y FKBP . [36]Además, otros estudios han demostrado inducir la transcripción de Cas9 con una molécula pequeña, la doxiciclina . [37] [38] Las moléculas pequeñas también se pueden usar para mejorar la Reparación Dirigida por Homología (HDR), [39] a menudo al inhibir la vía de la Unión de Extremos No Homóloga (NHEJ). [40] Estos sistemas permiten el control condicional de la actividad CRISPR para mejorar la precisión, la eficiencia y el control espaciotemporal.
Aplicaciones [ editar ]
Modelos de enfermedad [ editar ]
La modificación genómica de Cas9 ha permitido la generación rápida y eficiente de modelos transgénicos dentro del campo de la genética. Cas9 se puede introducir fácilmente en las células diana a través de la transfección de plásmidos junto con sgRNA para modelar la propagación de enfermedades y la respuesta y defensa de la célula a la infección. [41] La capacidad de Cas9 para introducirse in vivo permite la creación de modelos más precisos de la función de los genes, los efectos de las mutaciones, mientras se evitan las mutaciones fuera del objetivo que se suelen observar con los métodos más antiguos de ingeniería genética. La revolución de CRISPR y Cas9 en el modelado genómico no se extiende solo a los mamíferos. Modelos genómicos tradicionales como Drosophila melanogaster,Una de las primeras especies modelo, ha visto un mayor refinamiento en su resolución con el uso de Cas9. [41] Cas9 utiliza promotores específicos de células que permiten un uso controlado de Cas9. Cas9 es un método preciso para tratar enfermedades debido a la orientación de la enzima Cas9 que solo afecta ciertos tipos de células. Las células que se someten a la terapia Cas9 también pueden eliminarse y reintroducirse para proporcionar efectos amplificados de la terapia. [42]
CRISPR-Cas9 se puede utilizar para editar el ADN de organismos in vivo y se pueden eliminar los cromosomas completos de un organismo en cualquier punto de su desarrollo. Los cromosomas que se han eliminado in vivoson los cromosomas Y y los cromosomas X de ratones de laboratorio adultos y cromosomas humanos 14 y 21, en líneas de células madre embrionarias y ratones aneuploides , respectivamente. Este método podría ser útil para el tratamiento de enfermedades genéticas aneuploides como el síndrome de Down y los trastornos intersexuales . [43]
La edición exitosa del genoma in vivo con CRISPR-Cas9 se ha demostrado en varios organismos modelo, como Escherichia coli , [44] Saccharomyces cerevisiae , [45] Candida albicans , [46] Caenorhadbitis elegans , [47]Arabidopsis , [48] Danio rerio , [49] Mus musculus . [50] [51] Se han logrado éxitos en el estudio de la biología básica, en la creación de modelos de enfermedades [47] y en el tratamiento experimental de modelos de enfermedades. [52]
Se ha expresado la preocupación de que los efectos fuera del objetivo (edición de genes además de los previstos) pueden oscurecer los resultados de un experimento de edición del gen CRISPR (el cambio fenotípico observado no puede deberse a la modificación del gen objetivo, sino a algún otro gen). Se han realizado modificaciones a CRISPR para minimizar la posibilidad de efectos fuera del objetivo. Además, se recomiendan los experimentos CRISPR ortogonales para confirmar los resultados de un experimento de edición de genes. [53] [54]
CRISPR simplifica la creación de animales para la investigación que simula una enfermedad o muestra lo que sucede cuando un gen se destruye o se muta. CRISPR puede usarse a nivel de la línea germinal para crear animales donde el gen se cambia en todas partes, o puede estar dirigido a células que no son de la línea germinal. [55] [56] [57]
CRISPR puede utilizarse para crear modelos celulares humanos de enfermedades. Por ejemplo, aplicado a células madre pluripotentes humanas, CRISPR introdujo mutaciones dirigidas en genes relevantes para la enfermedad renal poliquística (PKD) y la glomeruloesclerosis focal segmentaria (FSGS). [58] Estas células madre pluripotentes modificadas por CRISPR se cultivaron posteriormente en organoides de riñón humano que mostraron fenotipos específicos de la enfermedad. Los organoides renales de células madre con mutaciones de PKD formaron grandes estructuras de quistes translúcidos de los túbulos renales. Los quistes eran capaces de alcanzar dimensiones macroscópicas, de hasta un centímetro de diámetro. [59]Los organoides renales con mutaciones en un gen vinculado a FSGS desarrollaron defectos de unión entre los podocitos , las células filtrantes afectadas en esa enfermedad. Esto se debió a la incapacidad de la capacidad de los podocitos para formar microvilos entre las células adyacentes. [60] Es importante destacar que estos fenotipos de la enfermedad estaban ausentes en los organoides de control con antecedentes genéticos idénticos, pero que carecían de las modificaciones CRISPR. [58]
Se adoptó un enfoque similar para modelar el síndrome de QT largo en cardiomiocitos derivados de células madre pluripotentes. [61] Estos modelos celulares generados por CRISPR, con controles isogénicos, proporcionan una nueva forma de estudiar enfermedades humanas y probar fármacos.
Biomedicina [ editar ]
La tecnología CRISPR-Cas se ha propuesto como un tratamiento para múltiples enfermedades humanas, especialmente aquellas con una causa genética. [62] Su capacidad para modificar secuencias específicas de ADN lo convierte en una herramienta con potencial para corregir mutaciones causantes de enfermedades. Las primeras investigaciones en modelos animales sugieren que las terapias basadas en la tecnología CRISPR tienen el potencial de tratar una amplia gama de enfermedades, [63] incluido el cáncer, [64] beta-talasemia, [65]enfermedad de células falciformes, [66] hemofilia, [67] fibrosis quística, [68] distrofia muscular de Duchenne, [69]enfermedad de Huntington, [70] [71] y enfermedad cardíaca. [72]CRISPR puede tener aplicaciones en ingeniería de tejidos y medicina regenerativa, como la creación de vasos sanguíneos humanos que carecen de expresión de proteínas MHC de clase II , que a menudo causan el rechazo del trasplante. [73]
CRISPR en el tratamiento de la infección [ editar ]
Las "nucleasas guiadas por ARN" basadas en CRISPR-Cas pueden usarse para dirigirse a factores de virulencia, genes que codifican resistencia a antibióticos y otras secuencias de interés médicamente relevantes. Esta tecnología representa así una forma novedosa de terapia antimicrobiana y una estrategia mediante la cual manipular poblaciones bacterianas. [74] [75] Estudios recientes sugirieron una correlación entre la interferencia del locus CRISPR-Cas y la adquisición de resistencia a los antibióticos [76] Este sistema proporciona protección de bacterias contra el ADN extraño invasor, como transposones, bacteriófagos y plásmidos. Este sistema demostró ser una fuerte presión selectiva para la adquisición de resistencia a los antibióticos y el factor de virulencia en patógenos bacterianos. [76]
Las terapias basadas en la tecnología de edición de genes CRISPR-Cas3 administradas por bacteriófagosdiseñados podrían utilizarse para destruir el ADN dirigido en patógenos. [77] Cas3 es más destructivo que el Cas9 más conocido [78] [79]
La investigación sugiere que CRISPR es una forma efectiva de limitar la replicación de múltiples herpesvirus . Fue capaz de erradicar el ADN viral en el caso del virus de Epstein-Barr (EBV). Los CRISPRs anti-herpesvirus tienen aplicaciones prometedoras, como eliminar el EBV de las células tumorales que causan cáncer, ayudar a eliminar los órganos donados para pacientes inmunocomprometidos de invasores virales, o prevenir brotes de herpes labial e infecciones recurrentes de los ojos mediante el bloqueo de la reactivación del VHS-1 . A partir de agosto de 2016 , estos estaban en espera de pruebas. [80]
CRISPR puede revivir el concepto de trasplante de órganos animales en personas. Los retrovirus presentes en los genomas animales podrían dañar a los receptores de trasplantes. En 2015, un equipo eliminó 62 copias del ADN de un retrovirus del genoma de cerdo en una célula epitelial de riñón. [81] Los investigadores demostraron recientemente la capacidad de dar a luz especímenes de cerdos vivos después de eliminar estos retrovirus de su genoma usando CRISPR por primera vez. [82]
CRISPR y el cáncer [ editar ]
A partir de 2016, CRISPR se había estudiado en modelos animales y líneas celulares de cáncer, para saber si se puede usar para reparar o frustrar los genes mutados que causan cáncer . [83]
El primer ensayo clínico con CRISPR comenzó en 2016. Se trató de eliminar las células inmunitarias de las personas con cáncer de pulmón, usar CRISPR para eliminar el gen expresado PD-1 y luego administrar las células alteradas a la misma persona. Otros 20 ensayos estaban en marcha o casi listos, principalmente en China, a partir de 2017 . [64]
En 2016, la Administración de Drogas y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) aprobó un ensayo clínico en el que se usaría CRISPR para alterar las células T extraídas de personas con diferentes tipos de cáncer y luego administrar esas células T modificadas por ingeniería genética a las mismas personas. [84]
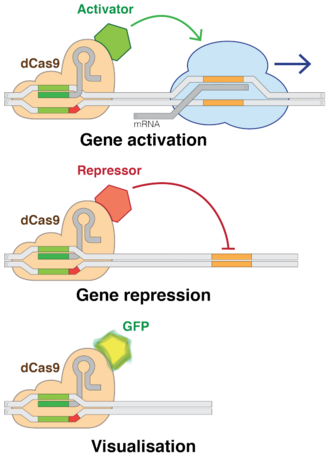
Knockdown / activación [ editar ]
El uso de versiones "muertas" de Cas9 ( dCas9 ) elimina la capacidad de corte de ADN de CRISPR, al tiempo que conserva su capacidad de dirigirse a secuencias deseables. Varios grupos agregaron diversos factores reguladores a los dCas9, lo que les permite activar o desactivar casi cualquier gen o ajustar su nivel de actividad. [81] Al igual que el ARNi, la interferencia CRISPR (CRISPRi) desactiva los genes de manera reversible al apuntar, pero no cortar un sitio. El sitio objetivo es metilado, epigenéticamente.Modificando el gen. Esta modificación inhibe la transcripción. Estas modificaciones colocadas con precisión se pueden usar para regular los efectos sobre las expresiones genéticas y la dinámica del ADN después de la inhibición de ciertas secuencias genómicas dentro del ADN. En los últimos años, se han investigado exhaustivamente las marcas epigenéticas en diferentes células humanas y se ha encontrado que ciertos patrones dentro de las marcas se correlacionan con todo, desde el crecimiento del tumor hasta la actividad cerebral. [6] Por el contrario, la activación mediada por CRISPR (CRISPRa) promueve la transcripción de genes. [85] Cas9 es una forma efectiva de apuntar y silenciar genes específicos a nivel de ADN. [86]En bacterias, la presencia de Cas9 solo es suficiente para bloquear la transcripción. Para aplicaciones en mamíferos, se agrega una sección de proteína. Su guía ARN se dirige a secuencias reguladoras de ADN llamadas promotores que preceden inmediatamente al gen objetivo. [87]
Cas9 se utilizó para transportar factores de transcripción sintéticos que activaban genes humanos específicos. La técnica logró un fuerte efecto al dirigir múltiples construcciones CRISPR a ubicaciones ligeramente diferentes en el promotor del gen. [87]
Edición de ARN [ editar ]
En 2016, los investigadores demostraron que CRISPR de una bacteria de la boca común podría usarse para editar el ARN . Los investigadores buscaron en las bases de datos que contenían cientos de millones de secuencias genéticas para aquellas que se parecían a los genes Crispr. Consideraron las fusobacterias Leptotrichia shahii . Tenía un grupo de genes que se parecían a los genes CRISPR, pero con diferencias importantes. Cuando los investigadores equiparon otras bacterias con estos genes, que llamaron C2c2, encontraron que los organismos obtuvieron una defensa novedosa. [88]
Muchos virus codifican su información genética en ARN en lugar de ADN que se reutilizan para crear nuevos virus. El VIH y el poliovirus son tales virus. Las bacterias con C2c2 producen moléculas que pueden desmembrar el ARN, destruyendo el virus. La adaptación de estos genes abrió cualquier molécula de ARN para su edición. [88]
Los sistemas CRISPR-Cas también pueden emplearse para la edición de genes de micro-ARN y ARN de larga codificación en plantas. [89]
Unidad de genes [ editar ]
Las unidades genéticas pueden proporcionar una herramienta poderosa para restablecer el equilibrio de los ecosistemas mediante la eliminación de especies invasoras. Las preocupaciones con respecto a la eficacia, las consecuencias no intencionadas en las especies objetivo y en las especies no objetivo se han planteado, particularmente en el potencial de liberación accidental de laboratorios en el medio silvestre. Los científicos han propuesto varias salvaguardas para asegurar la contención de unidades genéticas experimentales, incluidas las moleculares, reproductivas y ecológicas. [90] Muchos recomiendan que se desarrollen unidades de inmunización e inversión en conjunto con unidades genéticas para sobrescribir sus efectos si es necesario. [91]Sigue habiendo consenso en que los efectos a largo plazo deben estudiarse más a fondo, particularmente en el potencial de alteración ecológica que no se puede corregir con unidades de reversión. [92]
In vitro agotamiento genético [ editar ]
Las bibliotecas de secuenciación no enriquecidas a menudo tienen abundantes secuencias no deseadas. Cas9 puede agotar específicamente las secuencias no deseadas con la rotura de doble cadena con una eficiencia de hasta el 99% y sin efectos significativos fuera del objetivo como se ve con las enzimas de restricción . El tratamiento con Cas9 puede agotar el ARNr abundante al tiempo que aumenta la sensibilidad del patógeno en las bibliotecas de RNA-seq. [93]
Las patentes y comercialización [ editar ]
A partir de noviembre de 2013 , SAGE Labs (parte del grupo Horizon Discovery ) tenía derechos exclusivos de una de esas compañías para producir y vender ratas genéticamente modificadas y derechos no exclusivos para modelos de ratón y conejo. [94] Para 2015 , Thermo Fisher Scientific tenía licencia de propiedad intelectual de ToolGen para desarrollar kits de reactivos CRISPR. [95]
A partir de diciembre de 2014 , los derechos de patente de CRISPR fueron impugnados. Varias empresas se formaron para desarrollar medicamentos relacionados y herramientas de investigación. [96] A medida que las empresas aumentan el financiamiento, surgieron dudas sobre si CRISPR se puede monetizar rápidamente. [97]En febrero de 2017, la Oficina de Patentes de EE. UU. Dictaminó sobre un caso de interferencia de patentepresentado por la Universidad de California con respecto a las patentes emitidas al Instituto Broad , y encontró que las patentes amplias, con reclamos que cubren la aplicación de CRISPR-Cas9 en células eucarióticas , fueron distintos de los inventos reivindicados por la Universidad de California. [98] [99] [100] Poco después, la Universidad de California presentó una apelación de este fallo. [101] [102]
En marzo de 2017, la Oficina Europea de Patentes (EPO) anunció su intención de permitir reclamaciones amplias para la edición de todo tipo de células al Instituto Max-Planck en Berlín, la Universidad de California y la Universidad de Viena, [103] [104] y en agosto. 2017, la EPO anunció su intención de permitir reclamaciones CRISPR en una solicitud de patente que MilliporeSigma había presentado. [103] A partir de agosto de 2017, la situación de las patentes en Europa era compleja, con MilliporeSigma, ToolGen, Vilnius University y Harvard compitiendo por reclamaciones, junto con University of California and Broad. [105]
La sociedad y la cultura [ editar ]
Modificación de la línea germinal humana [ editar ]
Hasta marzo de 2015, varios grupos habían anunciado investigaciones en curso con la intención de sentar las bases para aplicar CRISPR a embriones humanos para la ingeniería de la línea germinal humana , incluidos laboratorios en los EE. UU., China y el Reino Unido, así como a la empresa de biotecnología de los EE . UU . [106] Los científicos, incluido un co-descubridor de CRISPR, instaron a una moratoria mundial en la aplicación de CRISPR a la línea germinal humana, especialmente para uso clínico. Dijeron que "los científicos deberían evitar incluso intentar, en jurisdicciones laxas, la modificación del genoma de la línea germinal para la aplicación clínica en humanos" hasta que se discutan todas las implicaciones "entre las organizaciones científicas y gubernamentales". [107] [108]Estos científicos apoyan la investigación de bajo nivel en CRISPR y no consideran que CRISPR esté lo suficientemente desarrollado para cualquier uso clínico en la realización de cambios hereditarios en humanos. [109]
En abril de 2015, científicos chinos informaron sobre los resultados de un intento de alterar el ADN de embriones humanos no viables utilizando CRISPR para corregir una mutación que causa la talasemia beta , un trastorno hereditario letal. [110] [111] El estudio había sido rechazado previamente por Nature y Science en parte debido a preocupaciones éticas. [112] Los experimentos dieron como resultado el cambio exitoso de solo algunos de los genes previstos y tuvieron efectos fuera del objetivo en otros genes. Los investigadores declararon que CRISPR no está listo para la aplicación clínica en medicina reproductiva . [112]En abril de 2016, se informó que científicos chinos hicieron un segundo intento fallido de alterar el ADN de embriones humanos no viables utilizando CRISPR, esta vez para alterar el gen CCR5 para hacer que el embrión sea resistente al VIH. [113]
En diciembre de 2015, se llevó a cabo una cumbre internacional sobre la edición de genes humanos en Washington bajo la dirección de David Baltimore . Los miembros de las academias científicas nacionales de América, Gran Bretaña y China discutieron la ética de la modificación de la línea germinal. Acordaron apoyar la investigación básica y clínica bajo ciertas pautas legales y éticas. Se hizo una distinción específica entre las células somáticas , donde los efectos de las ediciones se limitan a un solo individuo, frente a las células de la línea germinal, donde los descendientes podrían heredar los cambios en el genoma. Las modificaciones hereditarias podrían tener consecuencias no deseadas y de gran alcance para la evolución humana, genéticamente (por ejemplo, interacciones gen / ambiente) y cultural (por ejemplo, darwinismo social ). Alteración de los gametocitos.y los embriones para generar cambios heredables en humanos se definieron como irresponsables. El grupo acordó iniciar un foro internacional para abordar dichas inquietudes y armonizar las regulaciones en todos los países. [114]
En noviembre de 2018, Jiankui anunció que había editado dos embriones humanos para intentar deshabilitar el gen para CCR5 , que codifica un receptor que el VIH utiliza para ingresar a las células. Dijo que las niñas gemelas, Lulu y Nana, habían nacido unas semanas antes. Dijo que las niñas todavía llevaban copias funcionales de CCR5 junto con CCR5 ( mosaicismo ) discapacitado y aún eran vulnerables al VIH. El trabajo fue ampliamente condenado como no ético, peligroso y prematuro. [115] Un grupo internacional de científicos pidió una moratoria global sobre la edición genética de embriones humanos. [116]
Los obstáculos normativos a la ingeniería genética [ editar ]
Las regulaciones de políticas para el sistema CRISPR-Cas9 varían alrededor del mundo. En febrero de 2016, los reguladores dieron permiso a los científicos británicos para modificar genéticamente embriones humanosmediante el uso de CRISPR-Cas9 y técnicas relacionadas. Sin embargo, a los investigadores se les prohibió implantar los embriones y los embriones serían destruidos después de siete días. [117]
Los Estados Unidos tienen un elaborado sistema de regulación interdepartamental para evaluar los nuevos alimentos y cultivos modificados genéticamente. Por ejemplo, la Ley de Protección de Riesgos para la Agricultura de 2000 otorga al USDA la autoridad para supervisar la detección, control, erradicación, supresión, prevención o retraso de la propagación de plagas de plantas o malezas nocivas para proteger la agricultura, el medio ambiente y la economía de los Estados Unidos. . La ley regula cualquier organismo modificado genéticamente que utiliza el genoma de una "plaga vegetal" predefinida o cualquier planta no categorizada previamente. [118] En 2015, Yinong Yang desactivó con éxito 16 genes específicos en el hongo botón blanco, para que no se doraran. Como no había añadido ninguna especie extraña ( transgénica) ADN a su organismo, el hongo no podía ser regulado por el USDA bajo la Sección 340.2. [119] El hongo botón blanco de Yang fue el primer organismo modificado genéticamente con el sistema de proteínas CRISPR-Cas9 para pasar la regulación de los EE. UU. [120] En 2016, el USDA patrocinó un comité para considerar la futura política regulatoria para las próximas técnicas de modificación genética. Con la ayuda de las Academias Nacionales de Ciencias, Ingeniería y Medicina de los EE. UU. , Grupos de intereses especiales se reunieron el 15 de abril para contemplar los posibles avances en ingeniería genética dentro de los próximos cinco años y cualquier nueva regulación que pueda ser necesaria como resultado. [121] La FDAen 2017, propuso una regla que clasificaría las modificaciones de ingeniería genética a los animales como "drogas animales", sometiéndolas a una regulación estricta si se ofrecieran para la venta, y reduciendo la capacidad de individuos y pequeñas empresas para hacerlas rentables. [122] [123]
En China, donde las condiciones sociales contrastan fuertemente con Occidente, las enfermedades genéticas conllevan un gran estigma. [124] Esto deja a China con menos barreras políticas para el uso de esta tecnología. [125] [126]
Reconocimiento [ editar ]
En el año 2012, y 2013, CRISPR fue un segundo puesto en la revista Science 's Revelación del Año premio. En 2015, fue el ganador de ese premio. [81] CRISPR fue nombrada como una de las 10 tecnologías de vanguardia de MIT Technology Review en 2014 y 2016. [127] [128] En 2016, Jennifer Doudna , Emmanuelle Charpentier , junto con Rudolph Barrangou, Philippe Horvath y Feng ZhangGanó el premio internacional Gairdner. En 2017, Jennifer Doudna y Emmanuelle Charpentier fueron galardonadas con el Premio Japón por su invento revolucionario de CRISPR-Cas9 en Tokio, Japón. En 2016, Emmanuelle Charpentier, Jennifer Doudna y Feng Zhang ganaron el Premio Tang en ciencia biofarmacéutica.



No hay comentarios:
Publicar un comentario