La metoclopramida es un antiemético y agente procinético. Se utiliza comúnmente para tratar la náusea y elvómito, para facilitar el vaciamiento gástrico en pacientes con gastroparesis y como un tratamiento para la estasis gástrica a menudo asociado con la migraña.
Farmacocinética
La metoclopramida se absorbe con rapidez y por completo por la vía oral, pero el metabolismo hepático de primer paso reduce su biodisponibilidad a cerca de 75%. Los niveles plasmáticos máximos se alcanzan entre 0,5 y las 2 horas. El fármaco se distribuye pronto hacia la mayor parte de los tejidos (volumen de distribución: 3,5 litros/Kg) y cruza con facilidad la barrera hematoencefálica y la placenta. Su concentración en la leche materna puede sobrepasar a la del plasma. Su unión a proteínas plasmáticas es de un 13-30%. Hasta 39% de la metoclopramida se excreta sin cambios por la orina y el resto se elimina en ésta y en la bilis después de su conjugación con sulfato oácido glucurónico, siendo el sulfoconjugado N-4 el metabolito principal. La vida media del fármaco en la circulación es de cinco a seis horas, pero puede ser de hasta 24 horas en los pacientes con trastornos de la función renal.
Farmacodinámica
Mecanismo de acción
La actividad antiemética resulta de dos mecanismos de acción:
- Antagonismo de los receptores dopaminérgicos D2 de estimulación quimicoceptora y en el centro emético de la médula implicada en la apomorfina (vómito inducido).
- Antagonismo de los receptores serotoninérgicos 5-HT3 y agonismo de los receptores 5-HT4 implicados en el vómito provocado por la quimioterapia.
También posee una actividad procinética:
- Antagonismo de los receptores D2 al nivel periférico y acción anticolinérgica indirecta que facilita la liberación de acetilcolina.
Interacciones
| Fármaco | Resultados de la interacción |
|---|---|
| Levodopa | Antagonismo |
| Alcohol | Potencia el efecto sedante. |
| Anticolinérgicos | Efectos antagónicos. |
| Morfínicos | Efectos antipropulsivos. |
| Depresores del SNC | Aumenta el efecto sedante. |
| Neurolépticos | Riesgo de crisis extrapiramidal. |
| Digoxina | Disminuye la biodisponibilidad de la digoxina. |
| Ciclosporina | Aumenta la biodisponibilidad de la ciclosporina. |
| Cimetidina | Disminuye el efecto antiulceroso. |
| ISRS | Riesgo de crisis extrapiramidal |
Efectos
La metoclopramida estimula la motilidad del tracto gastrointestinal superior sin estimular las secreciones gástrica, biliar o pancreática. Por otra parte, aumenta el tono y la amplitud de las contracciones gástricas (especialmente antrales). Relaja el esfínter pilórico y el bulbo duodenal, y aumenta el peristaltismo del duodeno y yeyuno, lo que acelera el vaciado gástrico y el tránsito intestinal. Las propiedades antieméticas parecen ser el resultado de su antagonismo central y periférico de los receptores de la dopamina. Por ello puede producir sedación y reacciones extrapiramidales.
Uso clínico
Indicaciones
- Tratamiento sintomático de náuseas y vómitos.
- Trastornos funcionales de la motilidad digestiva.
- Preparación de exploraciones del tubo digestivo.
- Prevención y tratamiento de las náuseas y de la emesis provocadas por radioterapia, cobaltoterapia y quimioterapia antineoplásica.
- Prevención de náuseas y vómitos postoperatorios.
Contraindicaciones
- Hipersensibilidad a la metoclopramida o alguno de los excipientes de las presentaciones comerciales.
- Hemorragia gastrointestinal, obstrucción mecánica o perforación gastro-intestinal para los que la estimulación de la motilidad gastrointestinal constituye un riesgo.
- Historial previo de disquinesia tardía provocada por neurolépticos o metoclopramida.
- Confirmación o sospecha de la existencia de feocromocitoma, debido al riesgo de episodios graves de hipertensión.
- Combinación con levodopa a causa de su mutuo antagonismo.
- Combinación con otros fármacos que produzcan reacciones extrapiramidales como fenotiazinas y butirofenonas.
- Lactancia. En caso de que sea necesario, se puede valorar el uso de metoclopramida durante el embarazo.
- No se recomienda la administración de metoclopramida en pacientes que padecen epilepsia, ya que las benzamidas pueden disminuir el umbral epiléptico.
- Se recomienda una reducción de la dosis en pacientes con insuficiencia renal o insuficiencia hepática.
- Al igual que con los neurolépticos, puede producirse Síndrome neuroléptico maligno (SNM) caracterizado por hipertermia, alteraciones extrapiramidales, inestabilidad autónoma nerviosa y aumento de CPK. Por lo tanto, se deben tomar precauciones si aparece fiebre, uno de los síntomas del SNM, y se debe suspender el tratamiento con metoclopramida si se sospecha un SNM.
- Se han comunicado casos de metahemoglobinemia que podrían ser relacionados con una deficiencia en la citocromo b5 reductasa. En este caso, la metoclopramida deberá ser retirada inmediatamente y permanentemente, y se iniciarán medidas apropiadas.
Efectos Adversos.
Para la valoración de las reacciones adversas (RAM) se tendrán en cuenta los criterios de la CIOSM.
| Sistema implicado. | Grupo CIOSM. | Tipo de reacción. |
| Sistema nervioso central | Muy frecuentes. | Somnolencia, confusión, |
| Frecuentes. | Depresión. | |
| Poco frecuentes. | Discinesia tardía | |
| Raros. | Convulsiones, Síndrome neuroléptico maligno | |
| Trastornos gastrointestinales. | Frecuentes | Diarrea. |
| Trastornos de la sangre | Raros | Metahemoglobinemia, sulfohemoglobinemia. |
| Trastornos endocrinos. | Raros | Hiperprolactinemia (amenorrea, galactorrea,ginecomastia). |
| Trastornos cardíacos y vasculares. | Frecuente | Hipotensión, bradicardia. |
| Otros trastornos. | Frecuentes | Astenia. |
| Raros | Reaciones alérgicas | |
Presentaciones
Las formas comerciales comunes son:
- Solución oral: 100 mg de metoclopramida por cada 100 ml y 260 mg de metoclopramida por cada 100 ml.
- Comprimidos: 10 mg de metoclopramida por comprimido.
- Solución Inyectable: ampollas conteniendo 10, 50, 100 y 150 mg de metoclopramida.
Dadas sus características fisicoquímicas, los excipientes que más habitualmente suelen acompañarlo en las presentaciones comerciales son:
| Excipiente | Número E | Compr. | Gotas | Sol. oral |
|---|---|---|---|---|
| Ácido cítrico anhidro | E-330 | Sí | ||
| Agua purificada | Sí | Sí | ||
| Almidón de maíz | Sí | |||
| Celulosa microcristalina | E-460 | Sí | ||
| Ciclamato de sodio | Sí | |||
| Esencia de albaricoque-naranja | E-161 | Sí | ||
| Estearato de magnesio | Sí | |||
| Hidroxietilcelulosa | Sí | |||
| Lactosa monohidrato | Sí | |||
| Metil p-hidroxibenzoato | E-218 | Sí | Sí | |
| Para-hidroxibenzoato de propilo | E-217 | Sí | Sí | |
| Sacarina sódica | E-954 | Sí | Sí | |
| Sílice coloidal anhidra | Sí |
Metoclopramida
Solución inyectable y tabletas
Gastrocinético, antiemético central y periférico
Cada ampolleta contiene:
Clorhidrato de metoclopramida......................................... 10 mg
Vehículo, c.b.p. 2 ml.
Cada TABLETA contiene:
Clorhidrato de metoclopramida......................................... 10 mg
INDICACIONES TERAPÉUTICAS: Coadyuvante en el tratamiento de reflujo gastroesofágico, esofagitis, hernia hiatal, gastritis y gastroparesia.
Náusea y vómito (incluye los producidos durante el postoperatorio y los inducidos por medicamentos).
Profilaxis de náuseas y vómitos producidos por quimioterápicos, radioterapia y cobaltoterapia.
Tratamiento coadyuvante en la radiografía gastrointestinal.
Disminuye las molestias de la endoscopia.
CONTRAINDICACIONES: METOCLOPRAMIDA no se debe usar si es que la estimulación de la motilidad gastrointestinal puede ser peligrosa; por ejemplo, en presencia de hemorragia gastrointestinal, obstrucción mecánica o perforación.
La administración de METOCLOPRAMIDA está contraindicada en pacientes con feocromocitoma, ya que el medicamento puede causar crisis hipertensivas, probablemente asociadas a la liberación de catecolaminas por el tumor.
METOCLOPRAMIDA está contraindicada en pacientes con sensibilidad conocida e intolerancia al medicamento; no se debe usar en pacientes epilépticos, o que se les esté administrando otros medicamentos que puedan causar reacciones extrapiramidales, ya que se pueden aumentar.
PRECAUCIONES GENERALES: En un estudio en pacientes hipertensos la administración del clorhidrato de METOCLOPRAMIDA demostró la liberación de catecolaminas; por tanto, se debe tener precaución cuando se use el medicamento en pacientes con hipertensión.
Las inyecciones intravenosas del clorhidrato de METOCLOPRAMIDA se deben realizar en forma lenta durante 1 a 2 minutos para una dosis de 10 mg, debido a que una administración rápida genera un sentimiento temporal pero intenso de ansiedad e intranquilidad, seguido de mareo. La administración intravenosa del clorhidrato de METOCLOPRAMIDA diluida en una solución parenteral se debe realizar durante un periodo de no menos de 15 minutos.
Debido a que los medicamentos promocionales como el clorhidrato de METOCLOPRAMIDA podrían, en teoría, contribuir con una elevada presión sobre las líneas de sutura después de una anastomosis intestinal o una clausura (aunque los eventos adversos relacionados con esta posibilidad no se han reportado hasta la fecha), se debe considerar la posibilidad y sopesarla cuando se decida usar el medicamento o una succión nasogástrica en la prevención de la náusea y el vómito postoperatorios. El clorhidrato de METOCLOPRAMIDA puede alterar las capacidades mentales y/o físicas requeridas para el desempeño de tareas peligrosas como operar maquinaria o conducir un automóvil.
Al paciente ambulatorio se le debe hacer consciente de estos peligros.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Categoría de riesgo B: Este medicamento se debe usar en el embarazo sólo si es claramente necesario.
El clorhidrato de METOCLOPRAMIDA se excreta en la leche humana, por lo que se deben tomar precauciones si se administra en mujeres lactando.
REACCIONES SECUNDARIAS Y ADVERSAS:
En general, la incidencia de reacciones adversas se correlaciona con la dosis y la duración de la administración del clorhidrato de METOCLOPRAMIDA.
Efectos sobre SNC: Cansancio, decaimiento, fatiga y lasitud; insomnio, cefalea, confusión, mareos, con menos frecuencia se le asocia con depresión mental con tendencias suicidas.
Reacciones extrapiramidales: Las más comunes son reacciones distónicas agudas, incluyendo movimiento involuntario de piernas, gesticulación, tortícolis, crisis oculogíricas, protrusión rítmica de la lengua, habla de tipo bulbar, trismus, opistótonos y, raramente, estridor o apnea. En general, estos síntomas se contrarrestan en forma rápida con difenhidramina.
Síntomas semejantes a Parkinson: Bradicinesia, tremor, facias semejantes a máscara, discinesia tardía que por lo general se caracteriza por movimientos involuntarios de la lengua, cara, boca o mandíbula, y algunas veces, movimientos involuntarios del tronco y/o extremidades; los movimientos pueden ser en apariencia coreoatetósicos.
Síntomas motores: Ansiedad, agitación, insomnio, así como también incapacidad para permanecer sentado, estos síntomas pueden desaparecer de manera espontánea, o responder a la reducción de la dosis.
Reacciones endocrinas: Galactorrea, amenorrea, ginecomastia, impotencia secundaria a hiperprolactinemia, retención de líquidos secundaria a la elevación transitoria de aldosterona.
Reacciones cardiovasculares: Hipotensión, hipertensión supraventricular, taquicardia, bradicardia.
Reacciones gastrointestinales: Náusea, diarrea primaria.
Reacciones renales: Frecuencia urinaria e incontinencia.
Reacciones hematológicas: Metahemoglobinemia en especial con sobredosis en los neonatos. Existen algunos casos reportados de neutropenia, leucopenia y agranulocitosis sin relación clara con la administración de METOCLOPRAMIDA.
Reacciones alérgicas: En pocas ocasiones edema angioneurótico, incluyendo edema laríngeo o glótico.
Diversos: Trastornos visuales, porfiria, se ha reportado una rara ocurrencia de síndrome neuroléptico maligno.
Eritema transitorio de la cara y parte superior del cuerpo, sin alteraciones en signos vitales después de la administración de dosis altas por vía I.V.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Los efectos de METOCLOPRAMIDA sobre la motilidad gastrointestinal son antagonizados por medicamentos anticolinérgicos y analgésicos narcóticos. Los efectos aditivos sedativos pueden ocurrir si METOCLOPRAMIDA es administrada conjuntamente con alcohol, sedantes, hipnóticos, narcóticos o tranquilizantes.
Se debe tener cautela en pacientes a los que se les está administrando inhibidores de la monoaminooxidasa.
Puede disminuir la absorción gástrica de medicamentos, por ejemplo, digoxina; mientras que puede aumentar la absorción o la extensión de la absorción en el intestino delgado. Como la acción de METOCLOPRAMIDA influye en el tránsito del bolo alimenticio hacia el intestino, y en su tasa de absorción, se requiere ajustar la dosis de insulina, o el tiempo de administración en los diabéticos. El cloranfenicol, ácido acetilsalicílico, desimipramina, doxorrubicina y propantelina, disminuyen la velocidad de absorción de METOCLOPRAMIDA.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Como METOCLOPRAMIDA aumenta los niveles de prolactina, y considerando que cerca de un tercio de los tumores malignos de mama son sensibles a esta hormona, se debe considerar esta característica en pacientes con antecedentes de cáncer de mama.
Se desconoce la significancia clínica de la elevación de los niveles séricos de prolactina en la mayoría de los pacientes. Sin embargo, hasta la fecha no se ha demostrado por medio de estudios clínicos, ni epidemiológicos la asociación entre la administración crónica de METOCLOPRAMIDA y la tumorogénesis mamaria, la evidencia disponible es limitada para poder concluir en este respecto. Al parecer METOCLOPRAMIDA no tiene potencial mutagénico.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Oral: Adultos: 10 mg/8 horas, 30 minutos antes de las comidas.
I.M e I.V.:
Síntomas asociados con gastroparesia diabética: Dosis de 10 mg por vía I.V. administrados lentamente.
Para la prevención de náusea y vómito asociado con quimioterapia antineoplásica emetogénica: 10 mg diluidos en 50 ml de solución parenteral. La infusión intravenosa se debe suministrar lentamente durante un periodo no menor de 15 minutos; 30 minutos antes de comenzar la quimioterapia antineoplásica y repetirla cada 2 horas por dos dosis.
Cuando se vaya a utilizar una combinación de medicamentos altamente emetogénicos (cisplatino, dacarbazina) se puede usar una dosis inicial de 2 mg/kg.
Para la prevención de la náusea y vómito posquirúrgico: Se debe administrar METOCLOPRAMIDA inyectable por vía intramuscular cerca del final de la cirugía. La dosis usual para adultos es de 10 mg; sin embargo, es posible usar dosis de hasta 20 mg.
Para ayudar al examen radiográfico: En pacientes en donde el vaciamiento gástrico retrasado interfiere con los estudios de imagen del estómago o intestino delgado, es posible administrar una dosis única por vía intravenosa en un periodo de 1-2 minutos.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Sedación, mareo, reacciones extrapiramidales (tortícolis, trismus, crisis oculogíricas) que son reversibles al suspender la medicación o con la aplicación de diacepam y/o difenhidramina.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30° C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica.
No se deje al alcance de los niños. El empleo de este medicamento
durante el embarazo queda bajo responsabilidad del médico.
NOMBRE Y DOMICILIO DEL LABORATORIO:No se deje al alcance de los niños. El empleo de este medicamento
durante el embarazo queda bajo responsabilidad del médico.
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:
El Ondansetrón (DCI), desarrollado y comercializado por primera vez porGlaxoSmithKline como Zofran®) es un antagonista del receptor de serotonina 5-HT 3, utilizado principalmente como un antiemético (para el tratamiento de náuseas y vómitos), a menudo después de quimioterapia. Afecta a los nervios periféricos y centrales.1 El Ondansetrón reduce la actividad del nervio vago, que desactiva el centro del vómito en el bulbo raquídeo, y también bloquea los receptores de serotonina en el la zona gatillo quimiorreceptora. Tiene poco efecto sobre los vómitos causados por mareo por movimiento, y no tiene ningún efecto sobre los receptores de dopamina o receptores muscarínicos.
Ondansetrón
Solución inyectable y tabletas
Cada ampolleta contiene:
Ondansetrón (clorhidrato dihidratado).................................. 8 mg
Agua inyectable, c.b.p. 4 ml.Cada TABLETA contiene:
Ondansetrón........................................................................ 8 mg
INDICACIONES TERAPÉUTICAS:Prevención y tratamiento de la náusea y vómito inducidos por la radioterapia y la quimioterapia citotóxicas.
Prevención y tratamiento de la náusea y el vómito postoperatorios (NAVPO).
CONTRAINDICACIONES: Hipersensibilidad a alguno de los componentes de la fórmula.
PRECAUCIONES GENERALES:
Se han reportado reacciones de hipersensibilidad en pacientes que también han mostrado hipersensibilidad a otros receptores agonistas de 5HT3.
Debido a que el ONDANSETRÓN prolonga el tiempo del tránsito intestinal, debe monitorearse a los pacientes con signos sugestivos de oclusión intestinal.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No se ha establecido la seguridad del uso de ONDANSETRÓN en el embarazo.
La evaluación de estudios experimentales en animales no ha demostrado efectos adversos directos o indirectos sobre el desarrollo del embrión o feto humanos ni sobre el curso de la gestación y desarrollos peri/postnatal.
Sin embargo, dado que los estudios en animales no son siempre predictivos de la respuesta en humanos, no se recomienda su empleo durante el embarazo.
Lactancia: No se recomienda la administración de ONDANSETRÓN durante la lactancia, debido a que éste es excretado por la leche.
Las madres en tratamiento con ONDANSETRÓN no deben lactar a sus hijos.
REACCIONES SECUNDARIAS Y ADVERSAS:
Se han descrito: cefalea, sensación localizada de aumento de temperatura en la cabeza y epigastrio e hipo; elevaciones ocasionales, transitorias y subclínicas de las aminotransferasas.
El ONDANSETRÓN prolonga el tránsito intestinal, por lo que puede ocasionar constipación en algunos pacientes.
Hay reportes poco frecuentes de reacciones de hipersensibilidad inmediata; algunas veces severas que incluyen anafilaxia.
Raramente se han observado reacciones extrapiramidales como crisis oculógiras, convulsiones y movimientos involuntarios sin evidencia de secuelas clínicas.
Muy raramente se han observado convulsiones.
Hay reportes de dolor torácico con o sin depresión del segmento ST; arritmias, hipotensión y bradicardia.
La administración I.V. se ha relacionado con alteraciones visuales transitorias (visión borrosa) y mareos, reportados por la administración rápida I.V.
Ocasionalmente se han reportado reacciones locales en el sitio de aplicación I.V.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
No hay evidencia de que el ONDANSETRÓN induzca o inhiba el metabolismo de otros medicamentos con los que comúnmente se coadministra.
Los estudios específicos no han mostrado interacciones farmacocinéticas cuando el ONDANSETRÓN se administra con alcohol, temazepan, furosemida o propofol.
El ONDANSETRÓN es metabolizado por múltiples enzimas del sistema hepático del citocromo P-450: CYP3A4, CYP2D6 y CYP1A2.
Debido a la multiplicidad de enzimas capaces de metabolizar al ONDANSETRÓN, la inhibición enzimática o actividad reducida de una enzima (por ejemplo, deficiencia genética de CYP2D6) es normalmente compensada por otras enzimas y sólo debería resultar en alguna leve alteración del aclaramiento total del ONDANSETRÓN o modificación de los requerimientos de dosis.
Fenitoína (DFH) carbamazepina y rifampicina: En pacientes tratados con inductores potentes del CYP3A4 (por ejemplo, la DFH, la carbamazepina y la rifampicina), aumentó el aclaramiento oral del ONDANSETRÓN y disminuyeron las concentraciones sanguíneas.
Tramadol: Datos de estudios limitados, sugieren que el ONDANSETRÓN puede reducir el efecto analgésico del tramadol.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No hay evidencia de efectos teratogénicos en animales. Hasta la fecha, no se han reportado este tipo de efectos.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Intramuscular (I.M.), intravenosa (I.V.)
ONDANSETRÓN para quimioterapia y/o radioterapia emetogénicas en adultos:
El potencial emetogénico de los tratamientos para el cáncer varía de acuerdo con las dosis y combinaciones de medicamentos utilizados en la quimioterapia (Qt) y la radioterapia (Rt).
La selección del régimen depende de la severidad del reto emetogénico.
ONDANSETRÓN para Qt y Rt
emetogénicas en adultos
emetogénicas en adultos
ONDANSETRÓN para quimioterapia altamente emetogénica en adultos: (ejemplo, dosis elevadas de cisplatino)
Se recomienda ONDANSETRÓN Tabletas para la prevención y tratamiento de la emesis tardía, después de las primeras 24 horas.
ONDANSETRÓN en pediatría:
Radio y quimioterapia: Administrar una dosis de 5 mg/m², I.V. inmediatamente antes de la Qt, puede repetirse la dosis de 4 mg cada 12 h por vía parenteral, hasta por 5 días.
Dosis en ancianos para Rt y Qt: ONDANSETRÓN es bien tolerado por pacientes mayores de 65 años y no se requiere modificar la posología ni la vía de administración.
Insuficiencia renal: No se requiere modificación de la dosis diaria, intervalos de dosis ni vía de administración.
Insuficiencia hepática: El metabolismo y la eliminación de ONDANSETRÓN se reducen significativamente y la vida media plasmática se prolonga de manera importante en sujetos con insuficiencia moderada a severa. En tales casos, la dosis total diaria no debe exceder 8 mg.
Pacientes con alteraciones del metabolismo de la asparteína/debrisoquina: La vida media de eliminación del ONDANSETRÓN no se altera en sujetos conocidos como metabolizadores deficientes de la asparteína y debrisoquina, no requiriendo modificar la dosis o frecuencia de la administración.
ONDANSETRÓN en adultos para NAVPO
Para la prevención en niños sometidos a anestesia general, se recomiendan 0.1 mg/kg hasta un máximo de 4 mg antes, durante o después de la inducción anestésica.
Para el tratamiento de la NAVPO ya establecida, la dosis debe ser también de 0.1 mg/kg hasta un máximo de 4 mg.
Dosis en ancianos con NAVPO: La experiencia clínica para esta indicación y en este grupo etario es limitada, sin embargo, se ha utilizado en pacientes seniles en tratamientos con Qt y Rt y ha sido bien tolerado.
Insuficiencia renal: No se requieren modificaciones en la dosis, los intervalos o las vías de administración.
Insuficiencia hepática: El aclaramiento del ONDANSETRÓN se reduce y se prolonga significativamente su vida media en sujetos con insuficiencias leve a moderada. En estos casos, la dosis total no debe exceder 8 mg, por vías oral o parenteral.
Pacientes con alteraciones del metabolismo de la asparteína/debrisoquina: La vida media de eliminación del ONDANSETRÓN no se altera en sujetos conocidos como metabolizadores deficientes de la asparteína y debrisoquina, no requiriendo modificar la dosis o frecuencia de la administración.
Compatibilidad con soluciones para uso I.V.: Las ampolletas no contienen conservador y por lo tanto deben emplearse inmediatamente después de abrirse.
ONDANSETRÓN Inyectable no debe administrarse mezclado en la misma jeringa de cualquier otro medicamento.
Las ampolletas de ONDANSETRÓN no deben someterse al autoclave.
Se han efectuado estudios de compatibilidad en bolsas de infusión y equipos intravenosos de polivinilo. Se considera que también proporcionan estabilidad adecuada las bolsas de infusión de polietileno o botellas de cristal Tipo I.
Las diluciones del ONDANSETRÓN en solución salina al 0.9% p/v o glucosa al 5% p/v también han mostrado estabilidad en jeringas de polipropileno.
Se considera que la solución inyectable del ONDANSETRÓN diluido con las soluciones compatibles, anteriormente señaladas, sería estable en jeringas de polipropileno.
La preparación de las inyecciones debe ser con las apropiadas condiciones asépticas si se requieren periodos prolongados de almacenamiento.
Compatibilidad con soluciones I.V: Las soluciones deben prepararse inmediatamente antes de la infusión, como indica la buena práctica farmacéutica.
Se ha observado, sin embargo, que ONDANSETRÓN es estable a temperatura ambiente hasta por siete días, bajo luz fluorescente o en refrigeración, con las siguientes soluciones intravenosas:
Solución salina al 0.9% p/v.
Glucosada al 5% p/v.
Manitol al 10% p/v.
Solución Ringer-lactato o solución de Hartmann.
Solución Ringer.
Solución de NaCl al 0.9% + KCl al 0.3% p/v.
Solución de glucosa 5% + KCl al 0.3% p/v.
Compatibilidad con otras drogas: El ONDANSETRÓN puede ser administrado I.V. por infusión a la dosis de 1 mg/hora, con bomba o jeringa de infusión.
Los siguientes medicamentos pueden ser administrados en y administrando ONDANSETRÓN a concentraciones de 16 a 160 mcg/ml (ejemplo, 8 mg/500 ml u 8 mg/50 ml respectivamente).
Cisplatino: Concentraciones superiores a 0.48 mg/ml (ejemplo, 240 mg en 500 ml), administrados en un periodo de una a ocho horas.
5-fluorouracilo: Concentraciones superiores a 0.8 mg/ml (ejemplo, 2.4 mg en 3 l-400 mg en 500 ml) administrados en por lo menos 20 ml por hora (500 ml
en 24 horas).
Concentraciones más elevadas de 5-fluorouracilo pueden causar la precipitación de ONDANSETRÓN.
La infusión de 5-fluorouracilo puede contener hasta 0.045% p/v de clorhidrato de magnesio con otros excipientes, para ser compatible.
Carboplatino: Concentraciones en el rango de 0.18 a 9.9 mg/ml (ejemplo, desde 90 mg en 500 ml hasta 990 mg/100 ml) administrados en 10 a 60 minutos.
Etopósido: Concentraciones en el rango de 0.144 a 0.25 mg/ml (ejemplo, 72 mg en 500 ml a 250 mg en 1 l) administrados en 30 a 60 minutos.
Ceftazidima: Dosis en el rango de 250 a 2,000 mg reconstituidos con agua inyectable como se recomienda por el fabricante (ejemplo, 2.5 ml para 250 mg y 10 ml para 2 g de ceftazidima) administrados en bolo aproximadamente en 5 minutos.
Ciclofosfamida: Dosis en el rango de 100 mg a 1 g, reconstituido con agua inyectable a 5 ml por 100 mg, administrar en bolo en aproximadamente 5 minutos.
Doxorubicina: Dosis en el rango de 10 a 100 mg, reconstituida con agua inyectable a 5 ml por 10 mg, debe administrarse en bolo en cinco minutos.
Dexametasona: Puede ser administrada como fosfato de dexametasona sódica de 20 mg, en inyección lenta en 2 a 5 minutos en “Y”, o una infusión con 8 a 32 mg, de ONDANSETRÓN diluido en 50 a 100 ml de una solución compatible, en 15 minutos. La compatibilidad entre el fosfato sódico de la dexametasona, ha mostrado soportar la administración de estas drogas en el mismo equipo I.V., resultan-
do concentraciones en la línea I.V. de 32 mcg-2.5 mg/ml para el fosfato de sódico de dexametasona y de 8 mcg-1 mg/ml para el ONDANSETRÓN.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Actualmente, se conoce poco acerca de la sobredosificación con ONDANSETRÓN; sin embargo, se ha reportado un número pequeño de casos que recibieron sobredosis. No existe un antídoto específico para el ONDANSETRÓN, por lo que, en los casos de sospecha de sobredosis, se deberá instaurar tratamiento sintomático de apoyo. Evitar el uso de ipecacuana debido a que ONDANSETRÓN bloqueará el efecto emético.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Solución inyectable: Consérvese a temperatura ambiente a no más de 30°C y protéjase de la luz.
LEYENDAS DE PROTECCIÓN:
No se deje al alcance de los niños. Literatura exclusiva para médicos.
Su venta requiere receta médica. No se use durante el embarazo y la lactancia.
NOMBRE Y DOMICILIO DEL LABORATORIO:Su venta requiere receta médica. No se use durante el embarazo y la lactancia.
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:
La talidomida, que fue desarrollada por la compañía farmacéutica alemana Grünenthal GmbH, es un fármaco que fue comercializado entre los años 1957 y 1963 como sedante y como calmante de las náuseas durante los tres primeros meses de embarazo (hiperémesis gravídica).
Como sedante tuvo un gran éxito popular ya que, en un principio, se creyó que no causaba casi ningún efecto secundario y, en caso de ingestión masiva, no resultaba letal. Este medicamento, producido por Grünenthal GmbH en Alemania, provocó miles de nacimientos de bebés afectados de focomelia, anomalía congénita que se caracterizaba por la carencia o excesiva cortedad de las extremidades.
La talidomida afectaba a los fetos de dos maneras: bien que la madre tomara el medicamento directamente como sedante o calmante de náuseas o bien que fuera el padre quien lo tomase, ya que la talidomida afectaba al espermatransmitiendo los efectos nocivos desde el momento de la concepción. Una vez comprobados los efectosteratogénicos nocivos del medicamento (que provocaban malformaciones congénitas) descubiertos inicialmente por el doctor Widukind Lenz1 y su compañero de la Clínica Universitaria de Hamburgo, el español Claus Knapp,2este fue retirado con más o menos prisa en los países donde había sido comercializado bajo diferentes nombres.España fue de los últimos, pues lo retiró en 1963.3
Investigando se descubrió que había dos talidomidas distintas, aunque de igual fórmula molecular, en las cuales cambiaba la disposición de los grupos en un carbono, cosa que hasta entonces no se tenía en cuenta. Se trataba, por tanto, de una sola molécula con dos enantiómeros. Están pues (según la nomenclatura actual) la forma R (que producía el efecto sedante que se buscaba) y la S (que producía efectos teratogénicos y la que causaba focomelia). Este descubrimiento produjo que a partir de ese momento se tuviese en cuenta la estereoisomería en moléculas, utilizando el sistema R/S actual.
La talidomida fue comercializada bajo estos nombres (entre otros): Imidan, Varian, Contergan, Gluto Naftil, Softenon, Noctosediv, Entero-sediv, Entero-Sediv-Suspenso…
El impacto social de la talidomida
El fármaco provocó la denominada "catástrofe de la talidomida", ya que miles de bebés nacieron en todo el mundo con severas malformaciones irreversibles. Muchos de estos individuos tuvieron (y tienen) dificultades en integrarse en la sociedad a causa de su limitación física. De hecho, nunca se hubiera sabido su teratogenicidad si la malformación que hubiese provocado fuera más común, como por ejemplo problemas cardíacos, ya que las dismelias que provoca son bastante raras.
Además, la alarma social que provocaron los severos efectos secundarios hizo que los responsables de Sanidad de muchos países empezaran a hacer un control estricto de los medicamentos antes de su comercialización. Por ejemplo, en Alemania, uno de los países más afectados por la talidomida (bajo el nombre de Contergan), antes de la catástrofe no existía ninguna ley ni comisión de control de medicamentos. En efecto, después de la catástrofe, muchos países paulatinamente empezaron a promulgar leyes de control de los medicamentos y también la exigencia que éstos sean sometidos a ensayos farmacológicos y probados enanimales, además de ensayos clínicos en personas antes de su comercialización.
En Estados Unidos, la doctora Frances Oldham Kelsey, revisora de la FDA, se negó a autorizar el medicamento y pidió más estudios.,4 aun cuando había sido aprobado en más de 20 países europeos y africanos.5 Su insistencia en que el medicamento debía ser completamente analizado antes de su aprobación fue dramáticamente justificada cuando sobrevino la catástrofe.6 Como resultado, las reformas a las pruebas clínicas de medicamentos fueron aprobadas por unanimidad por el Congreso en 1962.6 Estas reformas requerían "límites más estrictos para las pruebas y la distribución de nuevos medicamentos",7 para evitar problemas similares. La enmienda reconoció también, por vez primera, que "la eficacia debería ser establecida antes de su comercialización".6
Otros efectos secundarios diferentes a los teratogénicos
Después de la reaparición de este medicamento es necesario saber que son comunes la cefalea, náuseas, somnolencia, mareo, xerostomía y onicolisis; todos desaparecen al suspender su consumo. [cita requerida]
La talidomida hoy en día
En la actualidad, la talidomida se vuelve a utilizar, con el apoyo de la OMS, en algunos países, porque se ha comprobado su eficacia en enfermedades como la lepra. Se conocen casos de nacimientos de niños con dismelia en Etiopía y Brasil, hijos de padres tratados con talidomida.
Se puede encontrar en venta en Internet, pero este tipo de venta es totalmente fraudulenta.
También se están realizando ensayos con talidomida y algunos de sus derivados en enfermos que padecen ciertos tipos de cáncer. Se ha comprobado su eficacia en casos de mieloma múltiple, aplicándose especialmente en casos en los que los tratamientos convencionales (quimio y radioterapia) no han tenido éxito o no son viables. En algunos casos la talidomida ha superado en eficiencia a la terapia convencional.8
Mecanismos de acción
El uso de la talidomida se hace bajo estricta supervisión médica. Su efecto inmunomodulador y antiinflamatorio se explica mediante la inducción en el incremento de la relación linfocitos T CD8/CD4 por disminución de los linfocitos T colaboradores circulantes, además inhibe la producción de Interleucina 1 y 12, los factores de necrosis tumoral alfa.9
Usos médicos actuales
Se ha usado con éxito y como terapia alternativa o de segunda elección para enfermedades como: lupus eritematoso discoide, enfermedad de Behcet, eritema nodoso,lepra, enfermedad injerto contra huésped, úlceras aftosas en pacientes con VIH, estomatitis aftosa recurrente, prúrigo nodular, prúrigo actínico y mieloma múltiple. Actualmente se están desarrollando estudios con la droga en casos de prostatitis crónica. [cita requerida]
Dosis y presentación
Viene en tabletas de 50 mg y se administran entre 100 y 400 mg diarios. También se administraban en jarabes, había que tomar de 10 a 20 mg según el grado de náuseas.
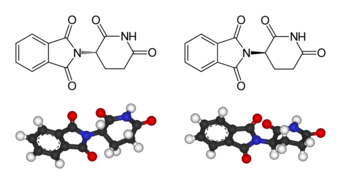
Los dos enantiómeros de la talidomida:
Izq.: (S)-talidomida
Der.: (R)-talidomida
Izq.: (S)-talidomida
Der.: (R)-talidomida
Tipo de fármaco: La talidomida se clasifica como un "agente inmunomodulador" y un "agente antiangiogénico". (Para obtener más detalles, vea más abajo la sección "Cómo actúa este fármaco").
Para qué se utiliza este fármaco:
- Este medicamento fue aprobado por la Administración de Fármacos y Alimentos de los Estados Unidos (FDA, por su sigla en inglés) para el tratamiento de lesiones de la piel relacionadas con la lepra.
- Se ha investigado su uso en diversas enfermedades cancerosas, tales como: mieloma múltiple, carcinoma de células renales, glioblastoma multiforme y macroglobulinemia de Waldenström. También como tratamiento de la enfermedad de injerto contra huésped (GVHD, por su sigla en inglés) luego de un trasplante de médula ósea.
Nota: si se ha aprobado un fármaco para un uso, los médicos pueden decidir utilizar este mismo fármaco para tratar otros problemas, si creen que podría ser útil.
Cómo se administra este fármaco:
- En cápsulas por vía oral. Cada cápsula contiene 50 mg. Las cápsulas deben guardarse en un lugar fresco y seco y protegido de la luz.
- Generalmente se toman por la noche, aproximadamente una hora antes de acostarse, para reducir la somnolencia durante el día.
- Para recibir este fármaco, se deben seguir unas pautas estrictas. Deberá participar en un programa especial llamado "Sistema para la educación sobre talidomida y seguridad de prescripción" (STEPS, por su sigla en inglés). Deberá llenar un cuestionario antes de recibir el medicamento y deberá repetirlo todos los meses mientras tome el fármaco. Sólo ciertos farmacéuticos y médicos pueden recetar o administrar este medicamento.
La cantidad de talidomida que recibirá depende de muchos factores, incluso su estado general de su salud y otros problemas de su salud, y el tipo de cáncer o enfermedad que padece. Su médico determinará la dosis exacta para usted y el calendario de administración del fármaco.
Efectos secundarios: Aspectos importantes que debe recordar acerca de los efectos secundarios de la talidomida:
Efectos secundarios: Aspectos importantes que debe recordar acerca de los efectos secundarios de la talidomida:
- La mayoría de las personas no experimenta todos los efectos secundarios mencionados.
- Los efectos secundarios suelen ser predecibles en cuanto a su aparición y duración.
- Casi siempre son reversibles y desaparecerán cuando finalice el tratamiento.
- Existen muchas opciones para ayudar a minimizar o prevenir los efectos secundarios.
No existe ninguna relación entre la manifestación o la gravedad de los efectos secundarios y la eficacia del medicamento.
Los siguientes efectos secundarios son comunes (es decir, tienen una incidencia mayor del 30%) en los pacientes que reciben talidomida:
Los siguientes efectos secundarios son comunes (es decir, tienen una incidencia mayor del 30%) en los pacientes que reciben talidomida:
- Anomalías congénitas graves que constituyen un riesgo para la vida, si se lo toma durante el embarazo. (vea "Precauciones").
- Efecto sedante: fatiga, somnolencia, debilidad, confusión, cambio de humor. Luego de varias semanas de terapia, puede llegar a desarrollar una tolerancia a los efectos sedantes de la talidomida.
- Las erupciones cutáneas, picazón y enrojecimiento generalmente se producen en el tronco, la espalda, los brazos y las piernas. Es importante informar de inmediato a su profesional de atención médica sobre cualquier erupción nueva. Si se produce una erupción, se debe interrumpir la administración de talidomida y sólo se podrá reanudar el tratamiento luego de la evaluación de un profesional de atención médica. Aunque no es frecuente, la talidomida puede causar una grave reacción cutánea llamada "síndrome de Stevens-Johnson".
- Neuropatía periférica se presenta como entumecimiento, hormigueo y dolor en los pies o las manos. Este efecto secundario no parece estar relacionado con las dosis o el tiempo de administración de la talidomida. Si se desarrollan los síntomas, se evaluará si se debe interrumpir la administración del fármaco. Los síntomas suelen mejorar luego de la interrupción pero es posible que no desaparezcan por completo.
- Estreñimiento
Los siguientes efectos secundarios son menos frecuentes en los pacientes que reciben talidomida (incidencia de entre 10% y 29%):
- Recuento bajo de glóbulos blancos (leucocitos) (lo cual puede hacer que corra un riesgo mayor de padecer una infección).
- Mareo al cambiar de posición (de sentarse a pararse). Puede estar acompañado por baja frecuencia cardíaca, debilidad, sensación de desmayo. (vea "Cambios en la presión arterial, hipotensión ortostática").
- Inflamación en los pies o los tobillos.
No se han incluido todos los efectos secundarios. Algunos efectos secundarios que son infrecuentes (cuya incidencia es menor de 10% de los pacientes) no figuran aquí. Sin embargo, no deje de informar a su proveedor de atención médica si experimenta algún síntoma inusual.
Cuándo llamar a su médico o proveedor de atención médica:
Comuníquese con su proveedor de atención médica inmediatamente, durante el día o la noche, si experimenta cualquiera de los siguientes síntomas:
- Si tiene fiebre de 100.5 ºF (38 ºC) o más, o escalofríos (posibles signos de infección).
- Disnea, sibilancias, dificultad para respirar, obstrucción de la garganta, hinchazón en la cara, ronchas (posible reacción alérgica).
Los síntomas a continuación requieren atención médica, pero no son situaciones de emergencia. Comuníquese con su proveedor de atención médica en un plazo de 24 horas si observa alguno de los siguientes síntomas:
- Fatiga extrema (imposibilidad de realizar las actividades de cuidado personal).
- Estreñimiento que no se alivia con el uso de laxantes.
- Nuevas erupciones cutáneas
- Entumecimiento y hormigueo en las manos o los pies
- Inflamación de los pies o tobillos. Pérdida repentina de peso.
- Signos de infección tales como enrojecimiento o inflamación, dolor al tragar, tos con expectoración o micción dolorosa.
- Si no puede comer o beber durante 24 horas o muestra signos de deshidratación: cansancio, sed, sequedad bucal, orina oscura y en menor cantidad o mareos.
No deje de informar a su proveedor de atención médica si experimenta algún síntoma inusual.
Precauciones:
- Antes de comenzar el tratamiento con talidomida, asegúrese de informar a su médico acerca de los demás medicamentos que toma (incluso los medicamentos recetados, los medicamentos de venta sin receta médica, las vitaminas, los remedios a base de hierbas, etc.). No tome aspirinas ni productos que contengan aspirina a menos que su médico se lo permita específicamente.
- No tome otros medicamentos que puedan causar somnolencia sin consultar previamente a su proveedor de atención médica. También evite el consumo de alcohol.
- Tanto para hombres como para mujeres: Use anticonceptivos y evite la concepción mientras recibe talidomida. Incluso una dosis de 50 mg puede causar anomalías congénitas graves que constituyan un riesgo para la vida. Se deben utilizar dos métodos de anticoncepción, como por ejemplo el uso de condones de látex y espermicidas.
- Las mujeres en edad reproductiva deben usar anticonceptivos 4 semanas antes de comenzar a recibir talidomida. El fabricante exige que las pacientes se realicen una prueba de embarazo cada mes antes de que le receten talidomida nuevamente. Esto se hace para asegurarse de que usted o su pareja no esté embarazada. Consulte a su médico cuándo podrá concebir sin riesgos para el bebé después del tratamiento.
- La talidomida es un fármaco clasificado en la categoría X (puede ocasionar daños al feto si se administra a una mujer embarazada. Este fármaco no debe administrarse a una mujer embarazada o que desee quedar embarazada. Si una mujer se embaraza durante el tratamiento con talidomida, el medicamento debe interrumpirse de inmediato y la mujer debe recibir asesoramiento adecuado).
- No amamante mientras recibe este medicamento.
Consejos prácticos sobre el cuidado personal:
- Tome este medicamento por la noche, antes de acostarse, para ayudar a reducir la somnolencia durante el día.
- Puede experimentar somnolencia o mareos; evite conducir o realizar tareas que requieran estar alerta hasta que conozca cuál es su respuesta al fármaco.
- Prevenga el estreñimiento. Su proveedor de atención médica puede recetarle un ablandador fecal para ayudarlo a prevenir el estreñimiento que pueda causarle este medicamento.
- Beba diariamente de 2 a 3 cuartos de galón (8 a 12 vasos) de líquido, a menos que se le haya indicado limitar el consumo de líquido, y mantenga una buena dieta. Esto disminuirá sus probabilidades de sufrir estreñimiento y evitará la deshidratación.
- Puede correr riesgo de sufrir una infección, de manera que debe informar a su proveedor de atención médica de inmediato si experimenta fiebre u otros signos de infección.
- Lávese las manos con frecuencia.
- Evite la exposición al sol. Use protector solar con factor de protección (SPF) 15 o superior y ropa protectora.
- Por lo general, se debe reducir al mínimo o evitar por completo el consumo de bebidas alcohólicas. Debe hablar sobre este tema con su médico.
- No done sangre mientras recibe este medicamento.
- No comparta sus pastillas.
- Descanse mucho.
- Mantenga una buena nutrición.
- Si experimenta síntomas o efectos secundarios, asegúrese de hablar de ellos con los miembros de su equipo de atención médica. Ellos pueden recetarle medicamentos y/u ofrecerle otros consejos que sean eficaces para controlar este tipo de problemas.
Control y pruebas:
Su profesional de atención médica le realizará pruebas con regularidad durante el tratamiento con talidomida, para vigilar los efectos secundarios y comprobar su respuesta al tratamiento. Su médico le ordenará periódicamente recuentos sanguíneos completos (CBC, por su sigla en inglés), así como también otros análisis de sangre a fin de vigilar el funcionamiento de otros órganos (como los riñones y el hígado). A las mujeres en edad reproductiva (útero intacto, período menstrual dentro de los 24 meses) se les solicitará una prueba de embarazo negativa cada mes antes de recibir la receta del mes siguiente para el tratamiento con talidomida.
Su profesional de atención médica le realizará pruebas con regularidad durante el tratamiento con talidomida, para vigilar los efectos secundarios y comprobar su respuesta al tratamiento. Su médico le ordenará periódicamente recuentos sanguíneos completos (CBC, por su sigla en inglés), así como también otros análisis de sangre a fin de vigilar el funcionamiento de otros órganos (como los riñones y el hígado). A las mujeres en edad reproductiva (útero intacto, período menstrual dentro de los 24 meses) se les solicitará una prueba de embarazo negativa cada mes antes de recibir la receta del mes siguiente para el tratamiento con talidomida.
Cómo actúa este fármaco:
No está claro cómo funciona exactamente el mecanismo de acción de la talidomida sobre las células cancerosas. Puede actuar inhibiendo el crecimiento de los vasos sanguíneos nuevos (angiogénesis) en los tumores, mejorando el estado del sistema inmunológico o disminuyendo la citocina y la producción del factor de crecimiento.
En el tejido normal, se forman nuevos vasos sanguíneos durante el crecimiento y la reparación tisular (es decir, la cicatrización de una herida), así como durante el desarrollo de un bebé durante el embarazo. Los vasos sanguíneos transportan al tejido el oxígeno y los nutrientes necesarios para el crecimiento y la supervivencia. En el cáncer, los tumores necesitan los vasos sanguíneos para poder crecer y propagarse. Por medio de un proceso complejo, las células endoteliales (que recubren los vasos sanguíneos) pueden dividirse y crecer, y crear nuevos vasos sanguíneos. Este proceso se llama angiogénesis y tiene lugar tanto en el tejido sano como en el canceroso.
En el tejido normal, se forman nuevos vasos sanguíneos durante el crecimiento y la reparación tisular (es decir, la cicatrización de una herida), así como durante el desarrollo de un bebé durante el embarazo. Los vasos sanguíneos transportan al tejido el oxígeno y los nutrientes necesarios para el crecimiento y la supervivencia. En el cáncer, los tumores necesitan los vasos sanguíneos para poder crecer y propagarse. Por medio de un proceso complejo, las células endoteliales (que recubren los vasos sanguíneos) pueden dividirse y crecer, y crear nuevos vasos sanguíneos. Este proceso se llama angiogénesis y tiene lugar tanto en el tejido sano como en el canceroso.
Además, la talidomida es conocida por sus diversos efectos sobre el sistema inmunitario (agente inmunomodulador), que puede contribuir a su efecto terapéutico. La talidomida también puede alterar la producción y la actividad de citocinas (factores de crecimiento) involucradas en el crecimiento y la supervivencia de ciertas células cancerosas. Puede haber un efecto sobre los genes que dirigen el crecimiento y la actividad de la célula, especialmente en aquellas relacionadas con las citocinas (factores de crecimiento), la apoptosis (muerte celular) y el metabolismo.
No hay comentarios:
Publicar un comentario