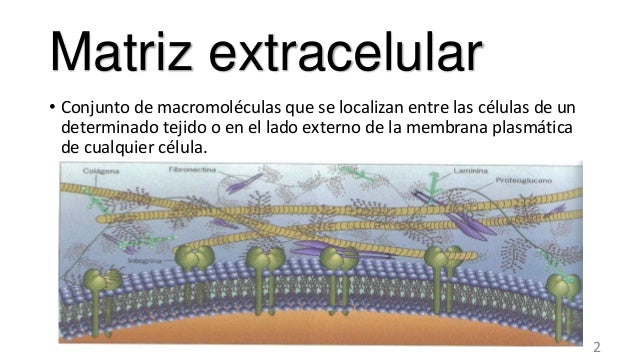
La matriz extracelular constituye el medio ambiente de las células.
Funciones Cohesión y resistencia de los tejidos. Modulan la fisiología y diferenciación celular. Composición Proteínas estructurales: colágeno, elastina, otras. Glúcidos: glicosaminoglucanos, celulosa. Glicoproteínas y proteoglicanos.
En el viaje por la célula que propuso C. de Duve (A guide tour of the living cell. Scientific American books, vol. 2, 1984) un citonauta de tamaño molecular, al dirigirse a una célula de un tejido animal, antes de toparse con la membrana plasmática, tendría la sensación de estar avanzando por una jungla de troncos, ramas y lianas. A esta maraña la denominamos matriz extracelular. La matriz extracelular es un entramado de moléculas, sobre todo proteínas y carbohidratos, que se disponen en el espacio intercelular y que son sintetizadas y secretadaas por las propias células. Algunos autores añaden que es la parte insoluble a lo que debería llamarse matriz extracelular.
La matriz extracelular es un invento de los organismos pluricelulares. Es esencial para estos organismos puesto que permite la adhesión de las células para formar tejidos. Pero con el tiempo ha adquirido muchas más funciones: aporta propiedades mecánicas a los tejidos (tanto en animales como en vegetales), mantiene la forma celular, permite la comunicación intercelular, forma sendas por las que se mueven las células, modula la diferenciación y la fisiología celular, secuestra factores de crecimiento, etcétera. Las propiedades que tienen algunos tejidos como resistencia, dureza, elasticidad, hidratación o propiedades ópitcas, dependen de su matriz extracelular. La cantidad, la composición y la disposición de la matriz extracelular depende del tipo de tejido considerado. Hay algunos como el epitelial y el nervioso que tienen muy poca matriz extracelular, mientras que en otros, como el tejido conectivo propiamente dicho, el cartílago o el hueso, constituye la mayor parte del tejido. La composición molecular de la matriz extracelular es típica de cada tejido y sus componentes son renovados continuamente por las células que la producen. Esto supone que la matriz extracelular está en constante renovación.
Las células interaccionan con la matriz celular mediante proteínas transmembrana, principalmente las integrinas, las cuales se adhieren o reconocen a moléculas de la matriz extracelular.
En los tejidos vegetales la pared celular se puede considerar, aunque no siempre hay acuerdo, como una matriz extracelular especializada con unas características muy diferentes a la de los tejidos animales. Su papel es crucial para dar rigidez a las células y por extensión a la planta, es una barrera a la permeabilidad y protege frente a las agresiones de patógenos o mecánicas, entre otras funciones.

En esta imagen se presentan ejemplos de distintos tipos de matrices extracelulares teñidas con diferentes colorantes. Los asteriscos señalan la matriz extracelular. A) Cartílago hialino, B) Matriz ósea compacta. C) Conectivo denso regular (tendón). D) Conectivo gelatinoso del cordón umbilical. E) Paredes celulares del sistema vascular de un tallo de una planta. F) Células epiteliales. Obsérvese que prácticamente no hay sustancia intercelular. G) Imagen de microscopía electrónica del tejido nervioso donde prácticamente no existe matriz extracelular.
Las principales macromoléculas que componen la matriz extracelular de los animales son: proteínas estructurales, fundamentalmente fibrosasas, como el colágeno y la elastina, glicosaminoglucanos, proteoglicanos y glicoproteínas. En las plantas destacan al celulosa, hemicelulosa y lignina. Todas ellas se encuentran en un medio acuoso junto con otras moléculas de menor tamaño, además de iones. Es la cantidad, la proporción y el tipo de cada una de estas macromoléculas lo que distingue a unas matrices extracelulares de otras.

Imagen de microscopía electrónica de barrido de la matriz extracelular de la submucosa del digestivo Las cintas largas son fibras de colágeno.
matriz extracelular (MEC) es el conjunto de materiales extracelulares que forman parte de un tejido. La MEC es un medio de integración fisiológico, de naturaleza bioquímicacompleja, en el que están "inmersas" las células. Así la MEC es la sustancia del medio intersticial (intercelular).
La MEC es un componente de vida importante. Los animales con células se distinguen por su capacidad de interconectarse una morfogénesis compleja que implica asociaciones celulares cooperativas para formar tejidos. Ahí es donde es importante y distintiva la MEC como componente cohesivo y medio logístico de integración de las diferentes unidades funcionales celulares.
Composición[editar]
La matriz extracelular está formada por:
Una sustancia fundamental:
Funciones[editar]
Las funciones de la MEC son una experimentación de las características física de los componentes de la misma. Las más importantes son:

La matriz extracelular (MEC) representa una red tridimensional que engloba todos los órganos, tejidos y células del organismo. Constituye un filtro biofísico de protección, nutrición e inervación celular y el terreno para la respuesta inmune, angiogénesis, fibrosis y regeneración tisular. Y representa el medio de transmisión de fuerzas mecánicas a la membrana basal, que a través de las integrinas soporta el sistema de tensegridad y activa los mecanismos epigenéticos celulares. La alteración de la MEC supone la pérdida de su función de filtro eficaz, nutrición, eliminación, denervación celular, pérdida de la capacidad de regeneración y cicatrización y alteración de la transmisión mecánica o mecanotransducción. También la pérdida del sustrato para una correcta respuesta inmune ante agentes infecciosos, tumorales y tóxicos.
Los tumores son tejidos funcionales conectados y dependientes del microambiente. El microambiente tumoral, constituido por la MEC, células del estroma y la propia respuesta inmune, son determinantes de la morfología y clasificación tumoral, agresividad clínica, pronóstico y respuesta al tratamiento del tumor. Tanto en condiciones fisiológicas como patológicas, la comunicación recíproca entre células del estroma y el parénquima dirige la expresión génica. La capacidad oncogénica del estroma procede tanto de los fibroblastos asociados al tumor como de la celularidad de la respuesta inmune y la alteración de la tensegridad por la MEC. La transición epitelio-mesenquimal es el cambio que transforma una célula normal o «benigna» en «maligna». El citoesqueleto pseudomesenquimal otorga las propiedades de migración, invasión y diseminación. Y viceversa, el fenotipo maligno es reversible a través de la corrección de las claves que facilita el microambiente tumoral.
Palabras clave: Matriz extracelular, sistema básico de Pischinger, tensegridad, mecanotransducción, moléculas de adhesión celular, integrinas, bioelectromagnetismo.
Extracellular matrix: morphology, function and biotensegrity (part I)
SUMMARY
Extracellular matrix (ECM) is a three-dimensional network that envelopes all the organs, tissues and cells of the body. A biophysical filter that provides protection, nutrition and cell innervation, it is the site for immune response, angiogenesis, fibrosis and tissue regeneration. It is also the transport medium for mechanical forces to the basal membrane through integrins that support the tensegrity system, activating cellular epigenetic mechanisms. The disruption of the ECM leads to a functional loss of nutrition, elimination, cell innervation, regenerative capacity and wound healing as well as alterations in mechanical transduction. This loss also disrupts the immune response to pathogens, tumour cells and toxins.
Tumours are functionally connected tissues which depend on the microenvironment. This tumour microenvironment, made up of ECM, stromal cells and the immune response, determines the morphology and tumour histopathological classification, clinical behaviour, prognosis and immune response to the tumour. Both in physiological and pathological conditions, reciprocity in the communication between stromal and parenchymal cells determine gene expression. The oncogenic capacity of the stroma depends on tumour associated fibroblasts, immune system cellularity and disruption of tensegrity by ECM. Epithelial-mesenchymal transition is the change that transforms a normal or benign cell into a malignant cell. The «pseudo-mensenchymal» cytoskeleton is responsible for migration, invasion and dissemination, and vice-versa, the malignant phenotype is reversible through the correction of the microenvironmental factors that favour tumour growth.
Keywords: Extracelular matrix, Pischinger basic system, tensegrity, mechanotransduction, cellular adhesion molecules, integrins, bioelectromagnetism.
INTRODUCCIÓN AL TERCER SISTEMA
El nombre de tejido conectivo sugiere una función de comunicación entre órganos, tejidos y células. Efectivamente, todos los tejidos del organismo humano se comunican entre sí y a una velocidad superior a la del sistema nervioso. A nivel histológico, estas funciones de soporte y comunicación residen en la matriz extracelular (MEC), encargada además del aporte de oxígeno y nutrientes a la célula y eliminación de CO2, toxinas y productos de desecho. Por eso constituye también un espacio idóneo para el almacenamiento de material tóxico, especialmente debido a la presencia de proteoglicanos que pueden ligarse fácilmente a una gran variedad de sustancias tóxicas. En condiciones normales, el acúmulo de toxinas en la MEC es drenado a través del sistema linfático hacia la cadena ganglionar linfática más próxima, y si dicho drenaje no se da o es insuficiente se produce una respuesta que se traduce en inflamación, acidosis y dolor. La MEC recibe inervación de las fibras nerviosas vegetativas, cuyas terminaciones libres constituyen auténticas sinapsis a distancia tanto de las propias células de la matriz como de las células parenquimatosas más próximas. Del hecho de que esa inervación esté intacta depende la predisposición de la matriz a responder con un proceso inflamatorio ante cualquier estímulo no fisiológico. Otra de las funciones de la MEC consiste en actuar como reservorio de otras moléculas, incluyendo factores de crecimiento, citocinas y proteasas.
En comparación con los invertebrados, los vertebrados tienen una gran diversidad de tipos de MEC, incluyendo el esqueleto. La MEC basada en colágeno constituye el principal elemento de soporte estructural de los animales multicelulares, así como desempeña un papel principal en los procesos de organización y orientación tisular, adhesión celular, migración, diferenciación, proliferación y apoptosis. Así mismo son los genes de la MEC los que están asociados a diversas alteraciones, a veces de una manera absolutamente directa como ocurre en el síndrome de Ehlers-Danlos o en la epidermolisis bullosa. La gran cantidad de genes relacionados con la MEC así como sus enzimas han sido invocados como evidencia del papel fundamental de la MEC en la evolución de los vertebrados (1,2).
La MEC está compuesta por una compleja mezcla de proteínas, proteoglicanos y glucoproteínas que confieren las propiedades estructurales de células y tejidos. Dichas proteínas ejercen a su vez un papel regulador de una extensa variedad de procesos celulares. Cada tipo celular muestra un perfil propio de receptores que constituyen la interfaz de comunicación con el microambiente que le rodea. De esta interacción se deriva la morfología celular, su comportamiento y la respuesta a moléculas solubles para los que la MEC sirve de reservorio, como citocinas y factores de crecimiento. De esta manera la MEC activa o deja de hacerlo los procesos celulares de crecimiento, muerte celular, adhesión, invasión, expresión génica y diferenciación. Todos estos eventos celulares se traducen en los procesos fisiológicos del desarrollo embrionario, la morfogénesis tisular o la angiogénesis, pero también es motivo de inicio de procesos patológicos cuando la correcta información se pierde, dando lugar a procesos inflamatorios, autoinmunes, degenerativos y tumorales.
En la interpretación de este diálogo una estructura de la MEC de elevada complejidad y alta especialización desempeña un papel primordial: la membrana basal. A ella se adhieren las células epiteliales y de ella reciben las señales de control procedentes de la MEC. Entre otras muchas otras implicaciones, su estructura y función resultan claves en el proceso oncogénico. Las membranas basales son estructuras complejas compuestas por una lámina lúcida y una lámina densa y por cuatro tipos principales de familias de glucoproteínas que varían según el tipo de tejido: lamininas, colágeno tipo IV, nidógenos y proteoglicanos de tipo heparánsulfato. Entre sus funciones principales destacan las referidas a la adhesión celular, la regulación de la proliferación y su papel como filtro selectivo a la difusión.
Los estudios de desarrollo embriológico muestran como el mesénquima esculpe la forma de los tejidos a través de la membrana basal. El equilibrio entre la degradación de la MEC principalmente por las metaloproteínasas, producidas en abundantes cantidades por los leucocitos y por el propio epitelio, determina la formación de glándulas, papilas, conductos o cualquier otra estructura epitelial (3). Esto es así hasta el punto de que si el epitelio de la mama se mezcla con el mesénquima de la glándula salival, la morfología resultante es la de la glándula salival, aunque las células sigan produciendo las proteínas de la leche (4). En el tejido embrionario las membranas basales crecen rápidamente conduciendo el patrón de desarrollo normal de cada órgano, mientras que en los tejidos adultos, ni la expansión ni la degradación de la membrana basal es significativa en condiciones de normalidad.
La matriz intersticial estromal actúa para interconectar, no solo para sostener y naturalmente no para separar capas celulares, y está compuesta por moléculas fibrilares extracelulares. En esta red fibrilar se encuentran fibrillas de colágeno tipos I, III y V, glucoproteínas tales como fibronectina, vitronectina y tenascinas, y proteoglicanos del tipo condroitín sulfato y dermatán sulfato. Pero sobre todo, el líquido intersticial incluye agua que contiene hormonas, neurotransmisores, citocinas, sales minerales y muchas otras sustancias prestas para ser utilizadas. Naturalmente es también el lugar de nutrición desde donde se aportan oxígeno y nutrientes, y también donde se eliminan los elementos de desecho celular y CO2. La vitalidad de la MEC y su correcto funcionamiento dependen de su limpieza y adecuado drenaje.
La MEC está sujeta a un ritmo dinámico funcional que se activa durante el día y encuentra su fase de reposo en las horas de la noche, dependiente del flujo hormonal que marca el biorritmo de todo el organismo, en especial la hormona tiroidea y el cortisol, aparte del sistema nervioso vegetativo.
EVOLUCIÓN HISTÓRICA DEL TERCER SISTEMA
El modelo de patología celular de Virchow propone que la unidad mínima de vida en el organismo es la célula. Sin embargo esto es una abstracción, ya que en realidad la célula aislada de su entorno no puede sobrevivir. Alfred Pischinger expandió este modelo y propuso como unidad mínima de vida en los vertebrados la tríada de capilar-MEC-célula (5). Ello supone la consideración de la MEC no como un material inerte o un tejido pasivo de sostén, sino como un componente vivo, dinámico y con múltiples funciones, una matriz viviente en palabras de Oschman (6).
Varios son los científicos que han sentado las bases del conocimiento de la MEC, y han aportado aspectos esenciales a los conceptos de tercer sistema y matriz viviente (7,8). A mitad del siglo XIX, Carl Rokitansky describió el crecimiento del tejido conectivo, afirmando que los elementos celulares y las enfermedades se producían a partir de los líquidos corporales. Así mismo, Claude Bernard definió el entorno extracelular o el «medio interno del organismo» proponiendo que «su estado saludable era esencial para la salud y que la impureza de este terreno produciría enfermedades». Ya en el siglo XX, Alfred Pischinger, el padre de la sustancia básica de la MEC, la describe como un gel amorfo que ocupa el entorno extracelular. Posteriormente llamó tercer sistema, sistema básico o de regulación basal, a toda la estructura que rodea a la célula, definiéndolo como un sistema de homeostasis. Describió la estructura anatómica de este sistema de intercambio, el concepto del espacio extravascular y extracelular con la matriz extracelular, las células de soporte, las terminaciones nerviosas libre, los capilares y los inmunocitos. Actualmente, Hartmut Heine, sigue aportando un amplio conocimiento de la estructura de la MEC y de su autorregulación. La investigación moderna sobre matriz viviente está siendo llevada a cabo por James L Oschman, que realiza una investigación en profundidad sobre los aspectos energéticos de la matriz, a través de los cuales todas las células saben lo que hacen las otras.
TÉCNICAS DE ESTUDIO DE LA MEC
Las técnicas habituales para el estudio morfológico específico o selectivo de la MEC, como la inmunohistoquímica, la inmunofluorescencia o la microscopía electrónica, además de las técnicas convencionales cotidianas con las que es posible estudiar la MEC, requieren la fijación, el procesamiento y el corte del tejido, lo cual limita la capacidad de estudio de estas estructuras y hace imposible su observación dinámica in vivo. Los fijadores histológicos conservan mal la estructura fina de la MEC, y en las preparaciones rutinarias generalmente, dicha matriz aparece como material granuloso localizado entre las células y las fibras. En cortes por congelación se colorea por ácido periódico de Schiff (PAS) y se tiñe metacromáticamente. A nivel ultraestructural presenta una estructura reticular fina con pequeños grumos densos de 10-20 nm. Está formada principalmente por macromoléculas de proteoglicanos y glucoproteínas fibrilares.
Sin embargo nuevas técnicas como la microscopía confocal in vivo o la microscopía multifotónica (MMF) permiten un estudio dinámico de estas estructuras. Esta última consiste en la excitación de un fluorocromo por dos o más fotones de baja energía casi simultáneos (9); la energía de ambos fotones se suma y juntos son capaces de estimular del mismo modo que lo haría un solo fotón con el doble de energía, obteniéndose así una alta capacidad de penetración de los fotones, que permite estudiar muestras dinámicas vivas como la MEC y sus funciones . Pero en particular la MMF tiene la capacidad de aprovechar las propiedades de las fibras de colágena generando una señal armónica llamada segundo armónico o doblaje de frecuencia que permite observar la organización de las fibras de colágeno sin necesidad de procesar el tejido (10). En tejidos malignos este segundo armónico permite identificar patrones alterados de colágena antes incluso de poder palpar el tumor, detectando el cambio del patrón normal de alineación perpendicular a un patrón radial propio del tumor (11), lo que, por ejemplo, permite la detección temprana y el estadiaje de tumores en la mama. También las fibras elásticas pueden ser estudiadas por este método (12).
HISTOLOGÍA DE LA MATRIZ EXTRACELULAR
La riqueza en material extracelular es variable en la organización y estructura de los diferentes tejidos. Es el marco estructural en el que están incluidos las células de soporte, las terminaciones nerviosas libres, los capilares y las células defensivas (fig. 1). Ese material extracelular está representado frecuentemente por una parte con estructura microscópica definida tradicionalmente, las fibras, y por la sustancia fundamental, un gel viscoso de macromoléculas muy hidratadas. El concepto clásico de sustancia fundamental amorfa ha quedado anticuado a medida que hemos aprendido detalles acerca de la configuración e interacciones de los constituyentes macromoleculares (13,14).
Las fibras ofrecen resistencia tensil, elasticidad y forman un andamiaje sobre el cual están desplegadas las células. El resto de elementos crean un filtro biofísico de adhesión y son responsables de las características de hidratación ejerciendo una importante influencia sobre el intercambio vital. En general, entre una estructura gruesa de fibras de colágeno y elastina está la estructura fina de los proteoglicanos y glucoproteínas bañadas por el liquido intersticial o tisular.
Las proteínas estructurales que constituyen las tradicionales fibras extracelulares son de tres tipos: fibras colágenas, fibras reticulares y fibras elásticas. Fibras colágenas y reticulares no son sino dos formas morfológicamente diferentes de colágena. De acuerdo con la estructura y funciones, el sistema colágeno puede ser considerado en: A) Colágenos que forman fibrillas: I, II, III, V y XI. Las fibras reticulares (III) son los haces compuestos de fibrillas de colágena de 50nm o menos de diámetro. B) Colágenos asociados a fibrillas. Unen a los anteriores entre sí y a otros componentes de la MEC. Son los tipos IX y XII. C) Colágeno que forma red, es el tipo IV. Uno de los principales componentes de las láminas basales. D) Colágeno de anclaje. Es el tipo VII, presente en las fibrillas de anclaje, une las fibras de colágeno tipo I a las láminas basales.
En el sistema elástico hay fibras más delgadas y no presentan estriaciones longitudinales. Se ramifican y se unen unas a otras formando una red de mallas muy irregulares. Además de las fibras elásticas típicas, en las que hay gran abundancia de elastina y una cantidad mucho menor de microfibrillas de fibrillina, se describen fibras elaunínicas y oxitalánicas, que se encuentran con menor frecuencia en el organismo humano.
Los monómeros de proteoglicanos (PG) son compuestos formados por glucosominoglucanos (GAG) sulfatados, antiguamente denominados mucopolisacáridos, unidos por covalencia a proteínas centrales. Parecen una escobilla de limpiar frascos, con una parte central proteica y con los GAG asemejando a las cerdas de la escobilla. Los GAG son polímeros repetitivos largos no ramificados de disacáridos (hasta 200 sacáridos repetidos), constituidos por un ácido urónico (casi siempre el ácido glucorónico) y una hexosamina (glucosamina o galactosamina). Los principales GAG son el ácido hialurónico, el dermatánsulfato, el queratánsulfato, el condroitínsulfato y el heparánsulfato. Los agregados de PG son estructuras con forma de árbol con una molécula de ácido hialurónico a la que se unen proteínas transportadoras unidas a las proteínas centrales de los monómeros de PG, dispuestas transversalmente. La principal característica hidrófila de la MEC se debe a una elevada presencia global de GAG en su estructura. A causa de los numerosos grupos carboxilo y sulfato en sus moléculas, los GAG son polianiones, con carga muy negativa, uniéndose por electrovalencia a elevado número de cationes, principalmente el sodio. Los cationes a su vez, atraen y conservan gran cantidad de moléculas de agua. El potencial eléctrico de la MEC es de aproximadamente 240 microV. La modificación de las cargas eléctricas modificará las propiedades hidrófilas de la MEC. Las macromoléculas de PG ocupan un gran volumen de la MEC configurando dominios o también llamados poros del gel de la matriz. No pueden plegarse en estructuras compactas por lo que presentan una configuración helicoidal abierta de grandes dimensiones. Como la distancia entre dos proteínas centrales situadas en la estructura de los agregados de PG es de solo 15-20 nm, las moléculas grandes quedan atrapadas fácilmente. La organización espacial y la carga negativa de los PG junto con la turgencia intrínseca, facilita la difusión selectiva de las diversas moléculas y crean una red tridimensional estrecha que actúa como filtro biofísico que se opone a la deformación por fuerzas de compresión. Los agregados de PG reciben diferentes nombres (en el cartílago se denomina agregan) y no solo se encuentran en la MEC sino también en la membrana basal (perlecan) o en superficies celulares (sindecan, betaglican). La síntesis de PG y GAG es sorprendentemente rápida. Los fibroblastos por ejemplo, son capaces de producir estas estructuras en solo 1 a 2 minutos. En condiciones normales se sustituyen después de un máximo de 4 meses. La vida media está entre 2 y 120 días.
Las moléculas de glucoproteínas fibrilares o estructurales (GP) son junto con el líquido intersticial el resto de los componentes de la matriz extracelular. Las GP contienen una parte proteica que predomina que se asocia a la parte glucídica que es ramificada. Las moléculas de las GP poseen regiones que se unen a receptores celulares y regiones que se unen a fibras. La fibronectina y la laminina son GP estructurales del tejido conectivo, biológicamente importantes. La fibronectina representa una familia de GP, con puntos de unión para las células, colágeno y GAG. Se une a los receptores celulares integrinas y conecta o une la célula a su entorno extracelular. La laminina se encuentra en las láminas basales, donde participa de la unión de esas estructuras a las células e influye en la filtración de moléculas a través de las láminas basales. El nidogen, la tenascina y la vitronectina son GP estructurales que nombraremos más adelante.
El líquido intersticial es el medio indispensable que hace que sea posible mantener la homeostasis entre las zonas intracelulares y extracelulares. Está formado por un vehículo de agua que contiene principalmente ácidos grasos, aminoácidos, azúcares, coenzimas, sustancias mensajeras como citocinas, hormonas, neurotransmisores y otras sustancias como sales minerales y productos de desecho.
ASPECTOS BIOLÓGICOS Y FUNCIONALES DEL TERCER SISTEMA
La actividad biológica del ser humano resulta de interacciones entre el organismo, su medio interno y su ambiente exterior (15,16). Para ello hay que pensar en la célula no como una entidad aislada, sino en permanente interacción con el medio que la rodea. La construcción de tejidos y órganos o sociedades celulares, se basa en el reconocimiento del entorno, la distribución de componentes citoplásmicos, los cambios de forma, la movilización y el desplazamiento orientado, el establecimiento de contactos y asociaciones con otras células y/o con materiales extracelulares.
La membrana plasmática según el modelo de Singer-Nicolson o modelo del «mosaico fluido», con la doble capa de lípidos y las proteínas integrales que atraviesan total o parcialmente la membrana, se concibe como un mosaico de zonas más viscosas de la membrana que se mueven entre áreas más fluidas a la temperatura corporal de cada especie. Los diferentes componentes de la membrana celular tienen capacidad para movilizarse y realizar diferentes tipos de movimientos moleculares, como girar, bascular entre las superficies externa e interna y desplazarse tangencialmente a lo largo y ancho de la membrana. Esto explica muchas de las funciones celulares como el flujo de membrana, el funcionamiento de los receptores, el reconocimiento celular, la actividad enzimática superficial, la adhesión célula-célula y la adhesión célula-sustrato, la motilidad celular en un líquido o sobre sustratos, los fenómenos de endocitosis y exocitosis, los cambios de forma celular, la interacción y reclutamiento de ligandos, fenómenos inmunes y de histocompatibilidad. Paralelamente, determina la heterogeneidad fisicoquímica entre membranas de diferentes células y entre diferentes dominios de una misma membrana, así como la asimetría entre los componentes superficiales y citosólicos de una membrana.
El citoesqueleto es una estructura dinámica que ocupa el citoplasma. Los principales tipos de polímeros que forman el citoesqueleto son microfilamentos, microtúbulos y filamentos intermedios (fig. 2). La más mínima modificación extracelular del potencial eléctrico podría ser un desencadenante de cambios del citoesqueleto. La matriz nuclear está conectada con la matriz intracelular y por tanto puede reaccionar gracias a estas interconexiones a impulsos externos.
Se estima que la MEC supone un 20% de nuestra masa corporal total, el mayor órgano del cuerpo. La célula viva siempre está rodeada por MEC, escasa en el tejido epitelial y muy abundante en el tejido conectivo. Además, en el sistema de sustancia básica hay células de soporte y otras células que forman parte de la misma. Las principales células de soporte son los fibroblastos/fibrocitos, condroblastos/condrocitos, osteoblastos/osteocitos, miofibroblastos y adipocitos. Las células de soporte son esenciales para la síntesis de la estructura de las fibras extracelulares y de los PG y GP. La calidad del filtro biofísico de los PG y de los GAG de la MEC depende de estas células.
Las células de soporte sanas (fundamentalmente los fibroblastos) hacen posible una restauración rápida de la MEC después de una lesión. Entre las células locales de la MEC destacan los macrófagos, los neutrófilos y otros fagocitos que eliminarán la mayor parte de las sustancias indeseadas así como los mastocitos. Son todos ellos responsables de los mecanismos de defensa inespecíficos. También hay células citotóxicas (linfocitos Tc) y linfocitos citolíticos naturales (linfocitos NK) para eliminar las células aberrantes o las células intoxicadas o lesionadas. La MEC es por tanto una zona de transición cuya principal función es la transmisión de materia, energía e información mediante sustancias mensajeras, potencial eléctrico e impulsos eléctricos, que sirve de base a la mayor parte de las interacciones entre los diferentes sistemas de regulación del organismo.
Existen interacciones coordinadas competitivas entre factores solubles, otras células y la MEC que definen los nichos o microambientes bioquímicos y mecánicos locales. Los nichos no son estáticos en función ni en número, y pueden ser creados o cambiados en condiciones específicas, con una regulación compleja y dinámica que influye en el tránsito, la supervivencia, autorrenovación, proliferación y diferenciación de las células madre (17,18).
DINÁMICA LINFOCITARIA SOBRE LA MEC
Los principales usuarios de las autopistas de la comunicación de la MEC son las células linfoides. La MEC puede mostrar diversas formas estructurales así como diferente composición bioquímica; una de sus formas corresponde a las membranas basales, que constituyen auténticas barreras que los linfocitos en su movimiento migratorio han de atravesar (fig. 3). La matriz intersticial constituye una especie de guías o caminos por los que los linfocitos discurren con toda facilidad y a gran velocidad (19). La migración de los timocitos, crucial para su correcta diferenciación, también depende en gran medida de la MEC (20). Los linfocitos se relacionan con la MEC a través de receptores específicos, citocinas y factores quimiotácticos, y los diferentes tipos de leucocitos emplean diferentes mecanismos para migrar a través de la MEC, lo cual está determinado tanto por su composición como por su estructura.
En su continuo discurrir a través de los vasos, los linfocitos permanecen en la luz de los mismos, delimitados por la capa de células endoteliales, su propia membrana basal y la MEC. Cuando han de acudir a un territorio a ejercer sus funciones, por ejemplo atraídos por un foco de inflamación, entonces la extravasación leucocitaria incluye una cascada de eventos que van desde la penetración de la capa de células endoteliales hasta la transmigración a través de la MEC. Dicha cascada comienza con la adhesión de los leucocitos a las células endoteliales, proceso dirigido por las selectinas. A continuación se produce una activación dependiente de quimioquinas, la detención de la circulación leucocitaria que depende de las integrinas y la subsiguiente migración celular que depende del antígeno asociado a la función linfocitaria LFA-1. La transmigración celular de los leucocitos a través de las uniones de las células endoteliales está regulada por moléculas de adhesión intercelular como CD99 e intra- o transcelular como ICAM-1. Tras atravesar en dos o tres minutos la monocapa de células endoteliales, los leucocitos topan contra la membrana basal endotelial, dependiente de las propias células endoteliales así como de las células perivasculares y mucho más lenta de atravesar. Finalmente migran a través de la matriz intersticial estromal, otra vez a gran velocidad, hasta alcanzar el foco inflamatorio que les llama. Naturalmente los mecanismos utilizados por los leucocitos para atravesar la membrana basal o avanzar a través de la matriz intersticial son diferentes, como también son diferentes de los mecanismos empleados por fibroblastos activados o células tumorales (21), que migran a través de un proceso de proteolisis pericelular mucho más lento.
En su migración a través de la MEC intersticial, los leucocitos exhiben movimientos ameboides que permiten que su cuerpo celular se alinee con las fibras de colágeno que utilizan como andamio o superficie de avance a través de un flujo mediado por los filamentos de actina que resultan en un cambio de la forma celular. En zonas estrechas el tamaño del núcleo puede generar resistencia interna, mientras que las estrecheces causadas por la resistencia externa de la densidad fibrilar intersticial es superada por la contracción de sus filamentos de miosina (22). En matrices bidimensionales las integrinas desempeñan un papel fundamental en el movimiento migratorio de los leucocitos. Es decir, que dependiendo de la organización del medio extracelular, los leucocitos utilizan diferentes métodos de locomoción.
BIOTENSEGRIDAD, O EL PODER DE LA MEC
Los profesionales que trabajan en terapias físicas conocen perfectamente como a través del contacto, del masaje, del movimiento o del estiramiento se producen importantes cambios en la salud. ¿Qué ocurre a nivel celular o molecular para que se produzcan estos cambios? La clave parece estar en la MEC y en las especializaciones que las células tienen para convertir los cambios mecánicos en cambios químicos o genéticos, lo que se conoce como mecanotransducción (23), proceso bien estudiado en la célula muscular cardiaca, el fibroblasto, el osteocito, el endotelio o las neuronas (24,25). El sistema de tensión integrada del que la célula dispone para mantener su morfología y su función recibe el nombre de tensegridad. Este mecanismo se basa en movimientos de compresión o de tensión de las células, que reciben el impacto mecánico a través de los elementos específicos diseñados para ello.
Un arquitecto, Buckminster Fuller, y un escultor, Kenneth Snelson, son famosos por idear las construcciones y esculturas más ligeras y resistentes que se conocen, como la cúpula geodésica, consistentes en estructuras que incluyen un componente de compresión, como varillas, unidas entre ellas sin tocarse a través de un componente de tensión, como cables. La geometría energética que constituyen, basada en el triángulo y en el tetraedro, ha sido encontrada en la naturaleza desde el nivel atómico o molecular, los fullerenos (en honor a Fuller) o el ion de potasio, hasta en virus como el adenovirus, en granos de polen, en complejos enzimáticos proteicos, en el citoesqueleto celular o en microorganismos enteros, como los volvox, un tipo de algas.
Los huesos constituyen la estructura fundamental de compresión de tensegridad en el organismo. Pero ellos solo forman parte de un marco mucho más complejo, en donde todo el sistema muscular, cartílaginoso, ligamentario y tendinoso conforman la estructuras de tensión que los unen. Gracias a una fina estabilización entre las fuerzas que unen este marco a través de puntos críticos como son las articulaciones, el organismo entero se sostiene, y se mueve, y gracias al balance de los músculos en oposición, el sistema músculo esquelético entero está sometido a una fuerza de tensión isométrica constituyendo una red estructural del tipo que los arquitectos conocen como de «pre-estrés». Esto es, una fuerza mecánica balanceada compuesta de elementos de compresión (huesos) y de tensión (músculos) que constituyen una estructura de tensión integrada o tensegridad. Otros órganos, como el corazón o el pulmón, también son órganos «preestresados», cuyas fuerzas de distensión ahora son la fuerza hemodinámica o la presión del aire.
Los organismos vivos no son otra cosa que estructuras holográficas, sistemas dentro de sistemas que repiten sus propiedades a diferentes escalas. Así, cuando bajamos al nivel tisular, cada órgano está compuesto de elementos celulares que están unidos entre ellos a través de un andamiaje que no es otra cosa que la matriz extracelular (MEC). Las células han desarrollado un mecanismo especial que les permite anclarse a las fibras de colágena, glicoproteínas y proteoglicanos que constituyen dicha matriz. Esas especializaciones son las integrinas, auténticos puentes moleculares de unión entre la MEC y el citoesqueleto. La red molecular del citoesqueleto está constituida por microfilamentos (de actina), microtúbulos (de tubulina) y filamentos intermedios, específicos de cada tipo celular (fig. 2). En el interior de la célula, los microtúbulos constituyen las estructuras de compresión, mientras que los filamentos de actina, estrechamente asociados a los de miosina, constituyen las estructuras de tensión (26). De manera que la tensión mecánica generada por el movimiento músculo-esquelético se transmite por presión a los órganos internos, que recogen el estímulo en la MEC, que confiere a través de las integrinas el movimiento al interior de la célula, que distribuye la fuerza tensional a través de su sistema de tensegridad, el citoesqueleto. Este traduce en señales químicas y en estímulos mecánicos dichas fuerzas, que son conducidas hasta el núcleo, que igualmente dispone de su propio sistema de tensegridad, poniendo en marcha ahora la respuesta al estímulo recibido en forma de activación de genes y secreción de proteínas. El circuito descrito pone en marcha, a través de estímulos mecánicos o mecanotransducción, la proliferación, el metabolismo celular, la diferenciación o la apoptosis.
La evolución ha diseñado un sistema en el que simplemente modificando la forma de la célula es posible activar diferentes programas genéticos celulares (27), como ha sido probado en células musculares, epiteliales, nerviosas, inmunes, óseas y fibroblastos. La tensegridad abre la puerta a una explicación científica del poder curativo de un masaje o la práctica de qigong (28) o la modificación genética celular a través de la respuesta de relajación (29). Cuando la morfología de una célula se aplana, la tensión generada informa que hacen falta más células y se pone en marcha el proceso de división. Si la forma se redondea, entonces ocurre lo contrario y se dispara el programa de apoptosis o anoikis. En caso de equilibrio, ni aplanamiento ni redondez de la forma, la célula encuentra las condiciones óptimas de diferenciación y funcionamiento para el microambiente donde habita. Todas las células del organismo están sujetas a este mecanismo de tensegridad basado en la estructura interna de la matriz nuclear y el citoesqueleto. Gracias a los filamentos intermedios alcanzan la matriz nuclear y gracias a los miofilamentos de actomiosina se enlazan con las fibras de la MEC, a las que dan la mano a través de las integrinas. Es así como cada célula siente su entorno y responde a él según sus propias necesidades (30). Una revisión del modelo mecánico de estructura celular basado en la tensegridad puede encontrarse en Ingber DE (31) mientras que una revisión de la mecanotransducción (ver más adelante), la integración de señales físicas y mecánicas y su acción sobre el comportamiento celular y activación de señales proteícas y génicas, en Ingber DE (32).
La rigidez variable in vitro de la MEC es capaz de producir una diferenciación fenotípica absolutamente dispar en las mismas células madre mesenquimales. Una MEC blandita, parecida al cerebro, con una presión de 1kPa (kilopascal) producirá diferenciación neurogénica; una MEC más firme de 10 kPa, parecida al músculo, inducirá diferenciación muscular, mientras que una matriz rígida, como el cartílago o el hueso, de 100 kPa, inducirá diferenciación osteogénica. Todo ello a partir de las mismas células madre mesenquimales (33). Las propiedades de conducción eléctrica de las células miocárdicas o las redes neurales también son moduladas a través de las interacciones entre la MEC y los mecanismos de tensegridad celular. Dicha tensión isométrica es clave para la vida y explica desde la forma de las células, los órganos y los tejidos hasta porqué el cirujano tiene que suturar una incisión sobre la piel o porqué un órgano hueco se colapsa al abrirlo. Y ello ocurre a nivel macroscópico, en el organismo entero o en una estructura tisular, a nivel de células y organelas, y también a nivel molecular, incluyendo la propia estructura del ADN (34). Es posible intuir así que la vida no está basada en una serie de procesos químicos desestructurados, y que la biología, la fisiología y la patología tienen que considerar que la fuerza mecánica aplicada sobre un órgano vivo atraviesa diferentes escalas de tamaño hasta convertirse en un estímulo bioquímico celular a través de un proceso específico de transducción molecular (35). En todo el camino, el elemento central de nexo y comunicación será la MEC.
Visto así, desde el punto de vista evolutivo, si bien es cierto que los cambios en el ADN generan la biodiversidad, los genes aparecen como un producto de la evolución y no como la fuerza original que la conduce. Cobran sentido así no solo la aproximación al código genético en la funcionalidad celular, sino también el código epigenético y un tercer código de tensegridad.
MECANOTRANSDUCCIÓN: la vida en/es movimiento
El proceso de mecanotransducción convierte el estímulo mecánico en señal química y permite la adaptación celular a su microambiente. Sus alteraciones se han mostrado clave en un amplio espectro de enfermedades, que van desde la sordera, la arteriosclerosis o las cardiomiopatías, hasta la osteoporosis, el glaucoma o el riñón poliquístico, pasando por el cáncer y enfermedades del sistema inmune (36). Como su mecanismo incluye pasos que van desde la MEC hasta la membrana citoplásmica, el citoesqueleto y la propia membrana nuclear, la cantidad de proteínas y moléculas que pueden verse implicadas es enorme. Por eso se han clasificado en tres grandes grupos que incluyen aquellas alteraciones que corresponden al microambiente extracelular, las que afectan la estructura y organización celular y finalmente las de señalización celular. Todas ellas acaban afectando a nivel genético y epigenético la cromatina nuclear (37) de manera diferente y específica en cada enfermedad.
La velocidad a la que se transmiten los estímulos mecánicos es mucho más alta que la de las señales químicas. Constituyen un mecanismo físico de integración de la parte con el todo, ya que cada vez que movemos un músculo o recibimos un masaje, la piel se arruga, un hueso recibe la compresión, y un tejido vivo recibe el estímulo y responde con su función. Si el estímulo es excesivo o se mantiene en el tiempo, el efecto mecanoquímico remodela el sistema de tensegridad que informará del cambio mecánico y lo transformará en nuevas condiciones moleculares. La importancia de los genes se supedita así al movimiento, el masaje o las terapias físicas, que afectan realmente los programas de crecimiento celular, diferenciación, respuesta inmune y tantos otros, críticos para la salud (38). La tensegridad explica porqué los genes, las moléculas y sus interacciones no pueden considerarse de forma independiente e individual. Todo el comportamiento y función biológicos cobran sentido a partir de ensamblajes supramoleculares, a partir de relaciones complejas de orden superior y patrones fractales presentes por doquier en la biología. Estos procesos se explican de forma matemática por las leyes del caos, a través de la formación de atractores, bifurcaciones y nuevos niveles emergentes que suponen siempre la implicación de todo el organismo de forma global, desde lo macro hasta lo micro, en una jerarquía de superorganización biológica.
CAMs: moléculas de adhesión celular
Las distintas moléculas que forman la matriz extracelular están unidas entre sí para formar un entramado cohesionado y de igual modo, las células están adheridas a las moléculas de la matriz extracelular. La mayoría de estas uniones son entre proteínas, pero también entre proteínas y azúcares (glucoproteínas). Dentro de este grupo de proteínas destacan las llamadas CAM (Cell Adhesión Molecules) o proteínas de adhesión celular. Con este término se designa a un grupo diverso de proteínas de membrana involucradas en procesos biológicos, que implican el contacto célula-célula o célula-matriz, como la proliferación, la migración, la diferenciación y la muerte celular. Las CAMs participan en estos procesos reconociendo receptores específicos que suelen ser otras moléculas CAMs situadas en otras células o en la matriz celular, originando una serie de señales que se transducen al interior celular (39).
Las conexiones entre moléculas de la matriz extracelular y los elementos celulares se producen a través de complejas interacciones con las CAMs, ya sea entre las propias proteínas de la MEC (como las fibronectinas), proteínas de unión célula-MEC (las integrinas) o bien proteínas de unión célula-célula. Las CAMs se clasifican en familias entre las que se encuentran integrinas, selectinas, cadherinas, inmunoglobulinas y proteínas de la matriz extracelular, unirse a otras moléculas del mismo tipo (interacción homofílica) o bien de tipo diferente (interacción heterofílica).
Proteínas presentes en la matriz extracelular son las Fibronectinas, glucoproteínas formadas por dos cadenas de polipéptidos con uniones disulfuro. Poseen dominios en su estructura que permiten unirse al colágeno, a ciertos proteoglicanos, a algunos glucosaminoglicanos, a la fibrina, a la heparina y a proteínas de la superficie celular como las integrinas. Establecen uniones entre moléculas de la matriz extracelular y de las células con la matriz extracelular. Las moléculas de fibronectina pueden aparecer formando fibras insolubles en los tejidos conectivos o solubles en el plasma de los fluidos corporales, como la sangre. Tienen un papel muy importante durante el desarrollo embrionario creando sendas por las que pueden migrar las células de un lugar a otro del embrión (40). Las tenascinas son una familia de proteínas de gran tamaño que aparecen en tejidos embrionarios y en tumores. Son capaces de unirse a las integrinas, a los proteoglicanos y a los receptores de inmunoglobulinas. Otras glucoproteínas de adhesión de la matriz extracelular son el fibrinógeno, que une receptores de superficie de las plaquetas y permite la coagulación sanguínea, la laminina en la formación de las láminas basales y la osteopondina, presente en el hueso o el riñón. Hay cuatro tipos de moléculas de unión célula-célula: cadherinas, inmunoglobulinas, selectinas y algunos tipos de integrinas. Las cadherinas se encuentran en la superficie de la mayoría de las células animales y forman uniones homotípicas, es decir, reconocen a otras cadherinas en la célula adyacente (fig. 4). Son una gran superfamilia de proteínas cuyos miembros suelen aparecer característicamente en ciertos tejidos, siendo especialmente importantes durante el desarrollo embrionario o formando parte estructural de los desmosomas (zónula adherens). Las moléculas de adhesión del tipo inmunoglobulina, forman uniones homofílicas con inmunoglobulinas presentes en la célula adyacente. Las selectinas son también proteínas de adhesión entre células, pero forman uniones heterofílicas, es decir, se unen a glúcidos presentes en la célula vecina y son importantes en la unión de los leucocitos a las paredes del endotelio cuando abandonan el torrente sanguíneo para adentrarse en los tejidos. Finalmente las integrinas, además de mediar la adhesión célula-matriz extracelular, también pueden mediar adhesiones célula-célula. En concreto, algunas integrinas pueden formar uniones con algunas moléculas transmembrana del tipo de las inmunoglobulinas.
INTEGRINAS: el lazo entre el colágeno y el citoesqueleto
Las moléculas de la MEC transmiten sus señales hasta las células de su entorno a través de las integrinas. El esquema de componentes y moléculas implicadas en el proceso de mecanotransducción incluye canales iónicos mecanosensibles, cadherinas, caveolas, integrinas, adhesiones focales, cilios, filamentos del citoesqueleto, estructuras nucleares y proteínas de la MEC. Las integrinas constituyen mecanoreceptores especializados, capaces de traducir una señal mecánica y transmitirla desde la superficie celular a través de una vía molecular específica para convertirla en cambios bioquímicos intracelulares, el estímulo de multitud de otros receptores o la inducción de la expresión génica. A ese nivel existen grandes complejos macromoleculares que constituyen puntos de adhesión entre la matriz intersticial y la célula que se conocen como adhesiones focales (AF), auténticas organelas mecanosensitivas. Las células solo crecen y se diferencian en un contexto tisular apropiado, y esta información se obtiene a través de la interacción específica entre la célula y la MEC. Las integrinas promueven la supervivencia celular a través de las AF, pero también el proceso fisiológico de anoikis –la apoptosis en respuesta a una inadecuada relación célula/MEC (41)– y el correcto recambio de los tejidos epiteliales.
Las integrinas son las moléculas más importantes que anclan la célula a la matriz extracelular, aunque algunos proteoglicanos también pueden realizar esta función. Constituyen una gran familia transmembrana de proteínas cuyos miembros son expresados según los tipos y necesidades fisiológicas de tejidos y células, con un dominio intracelular que contacta con el citoesqueleto y otro extracelular globular que es capaz de unir colágeno, integrinas y lamininas, constituyendo un enlace capaz de modificar el comportamiento celular (42). La célula puede modificar su capacidad de adhesión, y por tanto su movilidad, cambiando el juego de proteínas receptoras en su superficie.
Existen tres importantes subfamilias de integrinas (43). Las proteínas de la subfamilia beta-1 se caracterizan por presentar la cadena beta-1 de tipo CD29. Su cadena alfa puede ser de varios tipos. En este grupo se incluyen las proteínas VLA (Very Late Activation) con 6 tipos diferentes de cadena alfa (CD49a-f) que generan las proteínas VLA1, VLA2, VLA3, VLA4, VLA5 y VLA6. Las proteínas VLA se expresan en la mayor parte de las células del organismo, excepto en los granulocitos. En basófilos y neutrófilos no existen este tipo de integrinas y solo en eosinófilos se expresa la integrina VLA4 (alfa-4/beta-1). Los linfocitos expresan diversas integrinas beta-1 especialmente si están activados ya que se ha comprobado un incremento significativo días después de la activación. Las integrinas de la subfamilia beta-2, conocida también como CD18, se denominan integrinas linfoides y se asocian a tres isoformas de cadena alfa que recibe el nombre de CD11 formando las integrinas LFA-1 (Lymphocyte Function-associated Antigen-1) o CD11a/CD18 , MAC-1 (CR3 o CD11b/CD18) y p150,95 o CD11c/CD18 . Estas integrinas se localizan en los leucocitos y participan en la adhesión a las células endoteliales activadas. Son necesarias para la extravasación de los linfocitos a través del endotelio hacia el foco inflamatorio y en la quimiotaxis de los leucocitos hacia los sitios de inflamación. Los miembros de la subfamilia beta-7 se expresan principalmente en linfocitos localizados en placas de Peyer, lámina propia y epitelio intestinal.
Los factores que producen la activación celular de linfocitos, como antígenos o citocinas, inducen indirectamente el cambio en la conformación de las integrinas aumentando su afinidad por el ligando. Los cambios en la distribución de integrinas en la membrana celular parecen estar causados por modificaciones del citoesqueleto que ocurren como consecuencia de las señales intracelulares generadas durante la activación celular. Las integrinas median una gran variedad de interacciones célula-célula y célula-matriz extracelular. Se unen a proteínas de la matriz extracelular como la fibronectina y laminina, a otras moléculas de adhesión como las ICAM-1 de la superfamilia de las inmunoglobulinas o a moléculas solubles como fibrinógeno y Factor de von Willebrand relacionadas con la coagulación. Las plaquetas activadas usan la proteína VLA-2 para su adhesión al colágeno, y la VLA-6 para interaccionar con la laminina. Las células endoteliales también se pueden unir al colágeno y a la laminina mediante VLA-2. La VLA-4, ligando para las moléculas de adhesión vascular de tipo I (VCAM-I: Vascular Cell Adhesion Molecules-I), se expresa de forma diferencial de modo que está presente en monocitos, linfocitos T y B y eosinófilos, pero no en neutrófilos y basófilos. Este patrón de expresión puede que sea un mecanismo de reclutamiento selectivo de leucocitos ante diferentes condiciones.
FLUJO ENERGÉTICO EN LA MATRIZ EXTRACELULAR
La electrobiología es el estudio de los sistemas eléctricos de los seres vivos. Los tejidos y los órganos generan campos eléctricos y magnéticos que poseen una importante función biológica, hasta el punto de que todo proceso fisiológico del organismo posee una contrapartida electromagnética característica. Esta función es alterada con los procesos patológicos de la inflamación, la degeneración o la aparición de un nuevo tejido en el seno de un órgano. La actividad electromagnética de un órgano no queda restringida dentro de la cápsula del órgano, sino que se extiende hasta afectar el campo de los órganos vecinos, interrelacionando y comunicando estructuras adyacentes y a veces lejanas, como hace el corazón enviando su onda electromagnética a través del torrente circulatorio a todo el organismo.
Pero, ¿cuáles son los circuitos de estas corrientes eléctricas sobre el tejido?, ¿dónde están cuando miramos por el microscopio? Sabemos que la electricidad biológica es un fenómeno iónico ligado a la polaridad de la membrana celular. Esto ocurre en la transmisión nerviosa, en la contractilidad muscular y en cualquier célula viva del organismo, y estos potenciales son fácilmente medibles a través del electrocardiograma o del electroencefalograma. Por otra parte, además de los eléctricos, existen flujos mucho menores que los iónicos, producidos por electrones y protones, flujos electrónicos y protónicos. Tenemos así un sistema de interacción energético que junto al químico constituye el lenguaje del cuerpo y del que depende su integridad.
Un vistazo al sustrato material del cuerpo desde el punto de vista energético supone eliminar la vieja concepción de la célula como un globo o una bolsa llena de organelas y separada del exterior a través de la membrana celular. Lejos de eso la célula presenta una estructura interna constituida por microfilamentos, microtúbulos y filamentos intermedios, que constituyen su citoesqueleto, un auténtico microcableado que sirve para conectar los genes y la matriz nuclear a la MEC y sus fibras de colágena a través de las integrinas y las adhesiones focales, tal y como ya hemos visto. El alcance de esta fina instalación eléctrica incorpora a la fisiología la posibilidad de transmitir la caricia de un dedo en la piel hasta las mismas entrañas nucleares, la cromatina y los genes. Y la evidencia de su estructura aporta a la histología la chispa de la función, que permite ver ahora en el tejido los circuitos energéticos que soportan la vida y sus relaciones, integradas a través de los mecanismos de tensegridad y mecanotransducción.
La matriz nuclear, la matriz citoplásmica y la matriz extracelular están interconectadas formando una red que pone en comunicación todas las moléculas del cuerpo. Las vías de energía y los circuitos de información encuentran sus grandes autopistas precisamente en la MEC, cuya composición y estructura no solamente sirven de elemento de soporte, sino que constituyen precisos circuitos de transmisión mecánica, vibratoria, energética, electrónica y química, conformando la pieza clave que mantiene conectados a los órganos y que garantiza su correcto funcionamiento.
Los campos eléctricos producidos a través del movimiento suministran la información que dirige la actividad celular y el patrón de remodelación tisular (44). Osteoblastos, mioblastos, células perivasculares y fibroblastos se encargan de reabsorber y producir el colágeno que sirve para reformar, adaptar y regular cada órgano a su función actual. El sistema circulatorio, el sistema nervioso, el musculoesquelético o el tubo digestivo, todos ellos están conectados a través de una compleja red de tejido conectivo con funciones nutritivas, de desecho, sensitivas y de comunicación, la MEC. Dicho tejido ofrece una continuidad a todos los órganos de la economía, determina la forma general de todo el organismo, recibe el impacto del movimiento y transmite sus correspondientes señales bioeléctricas.
La MEC ofrece su función de autopista de comunicación gracias a su hidrofilia, que depende de las intensas cargas negativas de sus componentes. Dichas cargas aportan movimiento, contracción y giro a la matriz, que le dan funcionalidad y vida. La alteración de las cargas eléctricas de la matriz conllevará un potente impacto sobre su función, modificando sus propiedades hidrófilas y por tanto la difusión de sustancias y la transmisión de estímulos a su través. La aparición de enfermedades de cualquier tipo, infecciones de tipo viral, bacteriano o micótico, tumores, etc., producen cambios en el contenido de iones, agua y pH de los fluidos extracelulares, afectando consecuentemente las membranas celulares y sus micropotenciales eléctricos. La conductancia tisular alterada del tejido inflamado o tumoral brinda la oportunidad de usar esta información con fines diagnósticos, midiéndola desde la superficie cutánea, como en el cáncer de mama (45) o en el de colon (46).
Los fibroblastos están inmersos en una red constituida por proteoglicanos unidos a una especie de raspa de ácido hialurónico a través de su núcleo proteico. El matrisoma, la unidad de proteoglicanos que se repite, aloja entre sus cadenas de condroitín sulfato numerosos electrones que conforman la carga eléctrica negativa del campo de la MEC. Los componentes de la MEC son semiconductores con capacidad de transferir los electrones que alojan por gradiente hasta el lugar donde se necesiten. Y no solo la electricidad de los electrones, sino la proticidad de los protones, campo de estudio de la química cuántica, y otra de las funciones de la MEC (6). La morfología de esta dinámica sutil e invisible queda reflejada al mirar por el microscopio en el estallido oxidativo que supone la acción de polinucleares neutrófilos, histiocitos y otras células del sistema inmune en el foco inflamatorio. Allí se produce la liberación de su carga de oxígeno reactivo y de nitrógeno, carga mortífera para microorganismos patógenos y fuerza de descomposición de células y tejidos lesionados.
La MEC constituye un reservorio de cargas negativas con capacidad de donar o absorber electrones según las necesidades, de una manera tan rápida que las reacciones bioquímicas no pueden alcanzar, empleados en la neutralización de radicales libres que liberan los procesos oxidativos, como en el caso de la inflamación. La unidad fundamental de la MEC, el matrisoma, acoge la función de mantener la homeostasis osmótica, iónica, electromagnética, electrónica y protónica, tanto a nivel local como sistémico.
http://www.patologia.es/volumen42/vol42-num4/42-4n02.htm
   |
viernes, 1 de septiembre de 2017
Histología vegetal y animal
MATRIZ EXTRACELULAR
Suscribirse a:
Enviar comentarios (Atom)
No hay comentarios:
Publicar un comentario