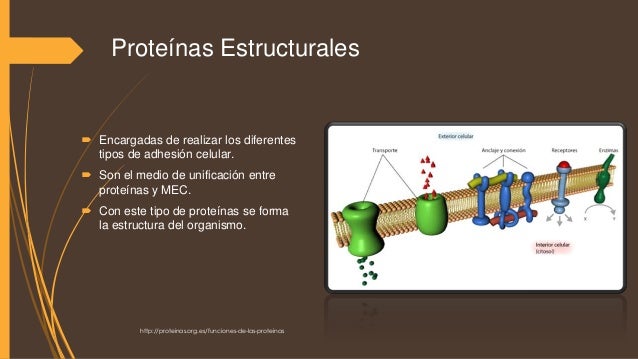
El colágeno y la elastina son proteínas estructurales de la matriz extracelular.
Colágeno Es la proteína más abundante de la matriz extracelular. Formado por 3 cadenas α. Se organiza para formar sobre todo fibras. Resiste tensiones mecánicas sin deformarse. Elastina Forma parte de las fibras elásticas. Las fibras elásticas permiten que los tejidos recuperen su forma orginal tras una distensión mecánica.
La matriz extracelular está formada principalmente por proteínas, glicosaminoglicanos, proteoglicanos y glicoproteínas, organizados en entramados diversos que constituyen las diferentes matrices extracelulares de los distintos tejidos, siendo el colágeno, los proteoglicanos y el ácido hialurónico los principales componentes estructurales de la matriz extracelular. Las proteínas estructurales más abundantes son el colágeno y la elastina.
Colágeno
Se denomina colágeno a una familia de proteínas muy abundante en los animales, pudiendo representar del 25 al 30 % de todas las proteínas corporales. Tradicionalmente se ha usado el colágeno para fabricar pegamentos y colas, de ahí su nombre. En los vertebrados hay más de 40 genes que sintetizan unas cadenas de aminoácidos denominadas cadenas alfa, las cuales se asocian de tres en tres para formar hasta 28 tipos de moléculas de colágeno diferentes. Su principal misión es crear un armazón que hace de sostén a los tejidos y que resiste las fuerzas de tensión mecánica. Actúa como las barras de acero que refuerzan el hormigón en los edificios. La organización de las moléculas de colágeno en estructuras macromoleculares tridimensionales es variada, pudiendo formar haces, matrices, etcétera. Las células se "agarran" a las moléculas de colágeno mediante diversas proteínas de adhesión como las integrinas, inmunoglobulinas, anexinas, etcétera. Otras moléculas interaccionan también con las moléculas de colágeno como proteoglicanos y glicoproteínas.
Las moléculas de colágeno se caracterizan por:
a) Una composición poco frecuente de aminoácidos. En las moléculas de colágeno abunda el aminoácido glicina, que es muy común, y otros menos comunes como la prolina e hidroxiprolina. La glicina se repite cada 3 aminoácidos (...-Gly - x - y - Gly - x - y -...), donde x e y suelen ser prolina e hidroxiprolina, respectivamente. Esta secuencia repetida de glicina es la que permite la disposición en hélice levógira de las cadenas α, debido al pequeño tamaño de este aminoácido.
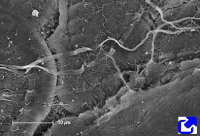
Fibras de colágeno en la matriz extracelular del tubo digestivo. Microscopía electrónica de barrido.
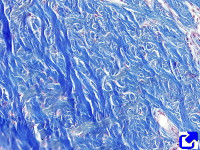
Fibras de colágeno de la dermis.
Tinción: tricrómico de Masson. 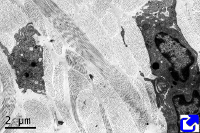
Fibras de colágeno en la matriz extracelular del tubo digestivo. Microscopía electrónica de trasnmisión.
b) Pueden organizarse formando fibras, mallas o especializarse en formar uniones entre moléculas. Todo ello depende de la composición química de sus subunidades α y de los tipos de subunidades que lo formen (ver tabla). La combinación de cadenas alfa puede ser homotípica (todas las cadenas iguales) o heterotípica (cadenas diferentes).
Forman fibras . Son las más abundantes de todas las formas de colágeno y están formadas por repeticiones de moléculas de colágeno, tres cadenas α arrolladas en forma de triple hélice dextrógira que forman las unidades repetidas. De los colágenos que forman fibras el más frecuente es el tipo I, que abunda en huesos, cartílago y piel, y que representa el 90 % de todo el colágeno del organismo. Otros tipos abundantes son el II, presente en el cartílago hialino, y el III, que abunda en la piel y en los vasos sanguíneos.
Forman mallas . Estos tipos de colágeno suelen organizarse en entramados moleculares que forman láminas. Se encuentran rodeando los órganos o formando la base de los epitelios. Entre éstos se encuentra el colágenotipo IV que abunda en la lámina basal, localizada entre el epitelio y el tejido conectivo.
Establecen conexiones . Forman puentes de unión entre moléculas de la matriz extracelular y el colágeno fibrilar o el colágeno que forma mallas. Por ejemplo, el colágeno tipo IX forma uniones entre los glicosaminoglicanos y las fibras de colágeno tipo II.
También existen moléculas de colágeno que poseen secuencias de aminoácidos hidrofóbicos y que se encuentran como moléculas transmembrana. Es el caso del colágeno tipo XIII y el tipo XVII. El colágeno tipo XVII forma parte de la estructura de los hemidesmosomas.
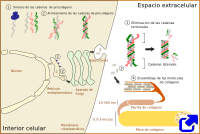
Independientemente del tipo, la síntesis de la moléculas de colágeno ocurre en forma de precursor. El colágeno se sintetiza en el interior celular en forma de procolágeno. En primer lugar se sintetizan las cadenas α inmaduras en el retículo, donde son modificadas. Las prolinas y lisinas son hidroxiladas para dar hidroxiprolinas e hidroxilisinas, pudiendo representar hasta el 20 % de la molécula de colágeno. También se lleva a cabo glicosidación (O-glicosidación). En este momento se asocian las cadenas α de 3 en 3 gracias a puentes de hidrógeno y a puentes disulfuro, para formar las moléculas de procolágeno. Éstas son reconocidas por receptores transmembrana y empaquetado en vesículas recubiertas por COPII. Estas vesículas, de unos 500 nm de diámetro, han de ser diferetnes puesto que las moléculas de procolágeno son como varillas rígidas de unos 300 nm (las vesículas típicas COPII miden entre 60 y 90 nm). El procolágeno pasa por el aparato de Golgi, no se sabe muy bien cómo, desde donde es exocitado al exterior celular. Es destacable que algunas células pueden seleccionar el dominio celular donde se liberará un determinado tipo de colágeno. Independientemente de esto, durante, o tras la liberación, sufre una acción enzimática que elimina una secuencias terminales de cada cadena α, transformando el procolágeno en colágeno. Estas secuencias terminales impedían que el procolágeno se ensamble espontáneamente en el interior celular.
Las moléculas de colágeno, sin cadenas terminales, se ensamblan automáticamente para formar las fibrillas de colágeno, que a su vez se unen para formar las fibras de colágeno (ver figura). La formación de las microfibrillas de colágeno, sin embargo, parece estar controlada por la participación de los colágenos tipo V y XI. En concreto el colágeno tipo V parece imprescindible para la formación de las fibras de colágeno. La forma y el crecimiento de las fibras de colágeno se ven afectados por otras moléculas como los proteglicanos. En la fase final de ensamblaje, y para dar estabilidad a la fibra, se forman enlaces covalentes por enzimas como la lisil oxidasa.

Imagen obtenida con un microscopio electrónico de transmisión a partir de tejido conectivo de un invertebrado marino, la oreja de mar. Con los asteriscos negros se indica el colágeno ya ensamblado en el exterior celular, mientras que con los asteriscos blancos las grandes vesículas intracelulares llenas de moléculas de procolágeno. La flecha blanca indica un posible punto de liberación de las moléculas de procolágeno al espacio extracelular.
El colágeno se sintetiza principalmente por fibroblastos, miofibroblastos, osteoblastos y condrocitos. Algunas moléculas de colágeno son también sintetizadas por otros tipos celulares tales como las epiteliales.
Elastina
Es una proteína abundante en muchas matrices extracelulares y aparece como un componente de las denominadas fibras elásticas, las cuales son agregados insolubles de proteínas. Al contrario que las fibras de colágeno, las fibras elásticas tienen la capacidad de estirarseen respuesta a las tensiones mecánicas y de contraerse para recuperar su longitud inicial en reposo. La elasticidad de nuestros tejidos depende de las fibras elásticas. Se encuentran sobre todo en la dermis, en las paredes de las arterias, en el cartílago elástico y en el tejido conectivo de los pulmones. Además de la elastina, que representa el 90 %, las fibras elásticas están formadas por las denominadas microfibrillas de fibrilina y por otras glicoproteínas y proteoglicanos en menor proporción. Otras funciones de las fibras elásticas son aportar sostén a los tejidos o regular la actividad de los factores de crecimiento TGF-β mediado por la fibrilina.

Esquema de una porción de una fibra de elastina. Las moléculas de elastina están unidas entre sí mediante enlaces entre las regiones ricas en el aminoácido lisina (Modificado de Kielty 2007).
La elastina posee una larga cadena de aminoácidos en la que hay numerosas secuencias con aminoácidos hidrófobos, separadas por otras secuencias que contienen parejas de glicinas y otros aminoácidos pequeños como la lisina. Esta composición de aminoácidos es la que confiere las propiedades elásticas, puesto que los aminoácidos hidrófobos permiten la disposición en estructuras arrolladas y la lisina la formación de α-hélices. Los aminoácidos no hidrófobos son los puntos donde se enlanzan dos moléculas de elastina próximas. La elastina parece ser una invención de los vertebrados, puesto que no se ha encontrado en invertebrados.
https://mmegias.webs.uvigo.es/5-celulas/2-componentes_proteinas.php
¿Qué son las proteínas estructurales?
Las proteínas estructurales son el tipo más abundante de entre todos los tipos de proteínas de nuestro organismo si tenemos en cuenta el porcentaje de proteínas que representan respecto al total.
Haz click en el siguiente enlace para ver productos relacionados con proteínas estructurales.
Las proteínas estructurales son proteínas fibrosas. Entre estas proteínas fibrosas, la keratina es probablemente la proteína estructural más conocida.
Esta proteína constituye la cubierta protectora de todos los vertebrados terrestres, formando el pelo, piel y las uñas en los seres humanos y también el cuero, lana, garras, pezuñas, cuernos, escamas, picos y plumas de muchos animales.
Aunque menos visibles, la proteína actina y la proteína miosina son dos proteínas estructurales que forman el tejido muscular. Otro grupo de proteínas fibrosas estructurales son la sedas y las fibras que generan de insectos. El colágeno es otra proteína estrucutral, la cual forma los tendones y nervios, que forman los ligamentos del cuerpo y proporciona una sujección adicional a la piel si es necesario.
Tipos de proteínas estructurales: Keratina
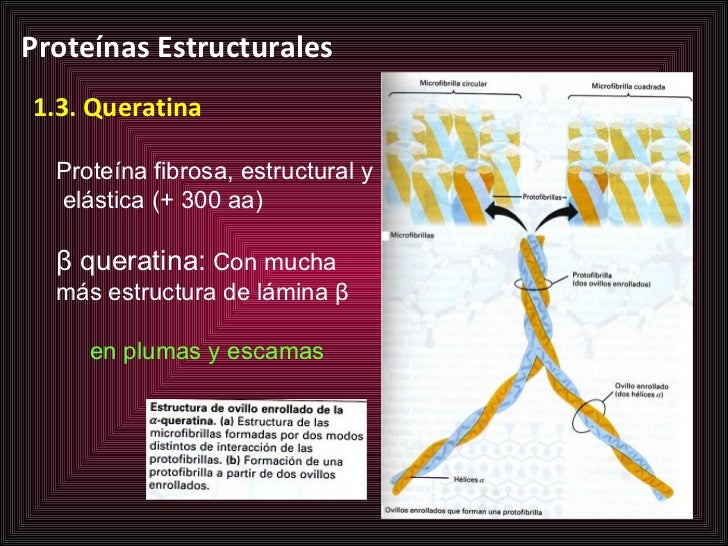
Hay una gran variedad de estructuras entre las distintas proteínas fibrosas, una de ella es la keratina del pelo. La unidad básica de cabello es un largo filamento de cadenas de proteínas que forma una estructura secundaria helicoidal alfa. Tres de estas estructuras helicoidales de proteína se entrelazan para formar una estructura llamada protofibril. A su vez, una microfibrilla se ensambla a partir protofibrillas dispuestas de manera que se envuelven nueve protofibrillas en torno a dos protofibrillas. Cientos de microfibrillas se unen para formar una macrofibrilla de proteínas. Estas macrofibrillas son, a su vez, empaquetadas con el cuerpo de una célula de pelo muerta. Una típica fibra capilar tiene el mismo tamaño que el diámetro de diez células de capilares.
El crecimiento del cabello humano es de aproximadamente la mitad de dos centímetros y medio al mes. Para este crecimiento, es necesario qu el folículo del pelo produzca aproximadamente dies vueltas de proteína alfa helicoidales cada segundo, lo cual supone usar unos treinta y seis aminoácidos.
Las fibras de proteína del pelo y otras alfa keratinas se unen por enlaces covalentes entre los residuos de cisteína para formar enlaces disulfuro. Cuanto más enlaces disulfuro hay entre las fibras, más rígida es la estructura de proteínas.
La keratinas alfa se pueden clasificar como blandas o duras según su contenido de azufre, es decir, el número relativo de cisternas en las cadenas de polipéptidos. La keratina de bajo contenido de azufre que se encuentra en la piel y en los callos es mucho más flexible que las que tienen un alto contenido de azufre como las keratinas duras de los cuernos, garras y pezuñas.
Transformación cisteína - cistina
El principio básico del proceso de permanente para el cabello consiste en romper los enlaces disulfuro que existen entre las hélices de proteína y luego reconstruirlos con nuevos enlaces disulfuro después de que las fibras del pelo se han formado y se han reorganizado por el estilista. Lo primero es aplicar al pelo un agente reductor para romper los enlaces disulfuro.
El pelo se moldea entonces según la forma deseada y un entonces se aplica un agente oxidante de forma que se reconstruyen los enlaces disulfuro. Una permanente sólo es realmente permanente para la parte del pelo que se trata y dura hasta la keratina nueva, sin tratamiento, sustituye a la keratina tratada.
  |
viernes, 1 de septiembre de 2017
Histología vegetal y animal
PROTEÍNAS ESTRUCTURALES
Suscribirse a:
Enviar comentarios (Atom)
No hay comentarios:
Publicar un comentario