Las glicoproteínas participan en la cohesión de los tejidos.
Fibronectinas. Forman enlaces con el colágeno, proteoglicanos, fibrina y receptores de superficie celular.
Tenascinas. Forman enlaces con integrinas, proteoglicanos y receptores de superficie.
Lamininas. Importantes en la lámina basal.
Las metaloproteasas y serín proteasas son enzimas que permiten la remodelación de la matriz extracelular.
Fibronectinas. Forman enlaces con el colágeno, proteoglicanos, fibrina y receptores de superficie celular.
Tenascinas. Forman enlaces con integrinas, proteoglicanos y receptores de superficie.
Lamininas. Importantes en la lámina basal.
Las metaloproteasas y serín proteasas son enzimas que permiten la remodelación de la matriz extracelular.
Las células están adheridas a la matriz extracelular, las cual, a su vez, forma un entramado cohesionado gracias a la interacción entre las moléculas que la forman. La mayoría de estas uniones en la matriz extracelular son entre proteínas, pero también entre proteínas y azúcares. Hay tres tipos de uniones que dan cohesión a los tejidos: uniones entre moléculas de la matriz extracelular, uniones entre las células y la matriz extracelular y uniones entre células contiguas. Los dos últimos tipos se verán en el apartado de membranas puesto que participan moléculas transmembrana.
Las moléculas que favorecen que la matriz extracelular sea un entramado cohesionado son principlamente glicoproteínas, aunque no es esa sola su función. Las glicoproteínas establecen puentes entre las moléculas estructurales, y entre ellas y las células. Tienen dominios de unión para éstas y otras moléculas, lo que les permite formar dichos entramados. Entre estas glicoproteínas destacan las fibronectinas, las lamininas y las tenascinas.

Esquema de una molécula de fibronectina. Está formada por dos cadenas de aminoácidos unidas por la zona próxima al extrremo carboxilo por puentes disulfuro. Se indican los dominios de la proteína que interaccionan con otras moléculas produciendo adhesión. (Modificado de Pankov 2002)
Las fibronectinas son glicoproteínas formadas por dos cadenas de polipéptidos unidos por uniones disulfuro. Poseen dominios en su estructura que permiten unirse al colágeno, a ciertos proteoglicanos, a glicosaminoglicanos, a la fibrina, a la heparina y a proteínas de la membrana plasmática celular como las integrinas. Por tanto establecen uniones entre moléculas de la matriz extracelular y entre moléculas de las células con la matriz extracelular. Las moléculas de fibronectina pueden aparecer formando fibras insolubles en los tejidos conectivos o solubles en el plasma de los fluidos corporales, como la sangre. Tienen un papel muy importante durante el desarrollo embrionario creando sendas por las que pueden migrar las células de un lugar a otro del embrión.

Esquema de una molécula de laminina. Está formada por tres cadenas de aminoácidos unidas. Se indican los dominios de la proteína que interaccionan con otras moléculas produciendo adhesión. (Modificado de Mouw et al., 2014)
Las lamininas son uno de los principales componentes de la lámina basal. Su estructura proteica está formada por tres cadenas de aminoácidos unidas por puentes disulfuro. Estas cadenas son alfa, beta y gamma. Existen 5 tipos de cadenas alfa, 3 betas y 3 gamma, las cuales se combinan entre sí para formar diferentes tipos de lamininas, aunque no todas las combinaciones son posibles ya que se han aislado sólo 16 formas de laminina. La laminina es sintetizada por células epiteliales, musculares, neuronas y células de la médula ósea. La mayoría de estas células depositan la laminina principalmente en las láminas basales que las separan del tejido conectivo. Aparte de su función estructural las lamininas afectan a la diferenciación y comportamiento celular gracias a que son reconocidas por las integrinas. Por ello, defectos en las lamininas suelen conllevar procesos patológicos
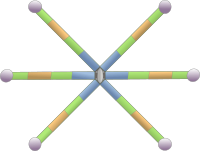
Esquema de la molécula de tenascina. Es una estructura modular donde se repite un polipéptido 6 veces, todos conectados entre sí. Cada color representa un dominio molecular.
Las tenascinas forman una familia de glicoproteínas de gran tamaño presentes en la matrix extracelular con una estructura molecular haxamérica modular. Se producen diferentes tipos de tenascina por maduración alternativa de su ARN mensajero. Hay varios tipos. La tenascina-C fue el primer tipo descubierto y se libera a la matrix extracelular de tendones, huesos y cartílago durante el desarrollo embrionario, pero también en otros tejidos del embrión, mientras que en adultos se expresa en muy pocos sitios. La tenascina-R es abundante en el sistema nervioso, tanto durante el desarrollo como en el adulto. La tenascina-X es abundante en el tejido conectivo. También se han descrito las tenascinas Y y W. Como otras glicoproteínas, la tenascina aumenta la cohesión de la matriz extracelular puesto que puede establecer enlaces con integrinas, fibronectinas, colágeno y proteoglicanos. En condiciones normales, cada tipo de tenascina se expresa en lugares concretos del organismos, que pueden cambiar según el estado de desarrollo, pero también pueden inducirse cuando hay reparación de tejidos, durante procesos tumorales o patológicos.
Otras glicoproteínas de adhesión presentes en la matriz extracelular son el fibrinógeno, que une receptores de superficie de las plaquetas y permite la coagulación sanguínea, la osteopontina presente en el hueso y el riñón, la denominada proteína de unión, que aparece en el cartílago donde reconoce a proteoglicanos, etcétera.
Remodelación de la matriz extraceular: metaloproteinasas
La matriz extracelular de los animales está en constante remodelación mediante la degradación de componentes y la producción de otros nuevos por parte de las células. La degradación de la matriz extracelular la llevan a cabo enzimas como las metaloproteinasas. Son enzimas que se asocian a la cara externa de la membrana plasmática (son secretadas) o forman parte integral de ella, siempre con su centro activo localizado extracelularmente. Inicialmente se producen en forma inactiva o prometaloproteinasas y para su activación es necesaria una proteolisis en su estructura, llevada a cabo por otras enzimas asociadas a la membrana plasmática. Existen más de 20 metaloproteinasas diferentes en mamíferos, cada una de las cuales tiene apetencia por distintos componentes de la matriz extracelular. Así, aunque no son totalmente específicas, se denominan colagenasas, gelatinasas, etcétera, según el sustrato sobre el que más apetencia tengan.
Las metaloproteasas no sólo intervienen en el mantenimiento de la matriz extracelular sino que son cruciales en procesos como el desarrollo, remodelación de la matriz extracelular inducida por estímulos, por ejemplo, hormonas, o en procesos patológicos tales como la inflamación, reparación de tejidos o metástasis tumoral. Otro papel importante de la metaloproteasas es liberar moléculas que se encuentran ancladas en la matriz extracelular, las cuales actúan como señal sobre las celulas, y que se vuelven solubles tras la degradación de la matriz extracelular. Estas enzimas no sólo son producidas por los fibroblastos sino que también las sintetizan las células epiteliales, condrocitos, osteoclastos y leucocitos, además de células malignas como las tumorales.
https://mmegias.webs.uvigo.es/5-celulas/2-componentes_glucoproteinas.php
glucoproteínas o glicoproteínas son moléculas compuestas por una proteína unida a uno o varios glúcidos, simples o compuestos. Destacan entre otras funciones la estructural y el reconocimiento celular cuando están presentes en la superficie de las membranas plasmáticas (glucocálix).
El término se usa en general para referirse a una molécula de dimensiones específicas, integrada normalmente por uno o más oligosacaridos unidos de modo covalente a cadenas laterales específicas de polipéptidos. Suelen tener un mayor porcentaje de proteínas que de glúcidos. Los términos proteoglicano y peptidoglicanodesignan agregados masivos formados por glúcidos y proteínas o séptimos péptidos, para los cuales la palabra molécula no tiene significado preciso. Las partículas de proteoglicanos tienen un mayor porcentaje de glúcidos que de proteínas.

Fórmulas estructurales de azúcares en las glicoproteínas.
Características generales[editar]
Existen en todo tipo de organismos, aunque prevalecen sobre todo en los líquidos y en las células de los animales, en las que tienen muchas funciones. Se encuentran muy difundidas en las membranas de las células o en asociación como componentes de la cubierta superficial.
Son glucoproteínas varias hormonas, los anticuerpos, diversas enzimas, proteínas receptoras, proteínas de adhesión celular, factores de crecimiento, proteínas de identificación celular, proteínas que confieren las características de los grupos sanguíneos, proteínas que dan estabilidad estructural a conjuntos plurimoleculares, etc.
Es lógico preguntarse cual sería la razón de la presencia del glúcido. Una propuesta es que la fijación de azúcares a una proteína es la etiqueta química con la que se identifican las proteínas destinadas a utilizarse fuera de la célula o en la trama membranosa de ésta. Así, las proteínas que se conservarán y usarán en el citoplasma de la célula no están glucosiladas.
Como grupo, las glucoproteínas manifiestan grandes diferencias en su contenido de glúcidos, el cual fluctúa de menos del 1 % hasta el 80 % del peso total. Las que tienen más de 4 % de glúcidos se llaman en ocasiones mucoproteínas porque poseen una gran viscosidad. La unión covalente con el péptido se realiza mediante un enlace glucosídico con la cadena lateral de residuos de serina, treonina o asparagina. Los grupos oligosacáridos unidos al grupo -OH de la serina y la treonina se llaman 'O-ligados', mientras que los fijos al grupo amida -NH2 de la asparagina se llaman 'N-ligados'. El número de grupos oligosacáridos por molécula de proteína es variable, pero todos los grupos de la molécula suelen ser idénticos. Los azúcares más comunes en tales oligosacáridos son la D-galactosa, la D-glucosa, la D-manosa, la L-fucosa, la N-acetil-D-glucosamina, etc.
Reconocimiento celular[editar]
Los grupos sanguíneos dependen del tipo de glicoproteína que contienen la membrana de los eritrocitos; el grupo A tiene como oligosacárido una cadena de N-acetilgalactosamina, mientras que el grupo B tiene una cadena de galactosa, y por tanto, el grupo AB presenta los dos tipos de glicoproteínas y el grupo 0 carece de ambos. Para determinar el grupo sanguíneo se usan antisueros, que contienen anticuerpos que reconocen determinado tipo de glucoproteína (el antisuero A reconoce la glucoproteína A). El conocimiento del grupo sanguíneo es importante para hacer transfusiones y evitar la formación de coágulos que provocan infartos y trombosiscerebrales mortales.
Terminología2[editar]
La raíz griega glykys- (dulce) utilizada a partir del siglo XIX por los químicos franceses para denominar a múltiples sustancias químicas de origen glucídico ha pasado tradicionalmente en español a la forma "gluco-", a diferencia del inglés en que se usan tanto "gluco-" (que expresa relación con la glucosa) como "glyco-" (que expresa relación con los glúcidos). Por lo tanto en español se aconseja evitar el anglicismo "glicoproteína" y usar siempre "glucoproteína" para referirse a moléculas que contienen proteínas y glúcidos.
Glicoproteínas
Como su nombre indica, las glicoproteínas son proteínas (principalmente las proteínas intrínsecas de membrana y de secrección) que son modificadas después de la traducción para unir covalentemente una parte oligosacárida. Puesto que hay una gran cantidad de azúcares, los cuales contienen una gran cantidad de grupos funcionales dispuestos en conformaciones diversas que pueden servir como potenciales sitios de unión, la estructura de los oligosacáridos unidos a las proteínas es enormemente variado y complejo y por tanto, muy rico en información, sobre todo, si se compara con polímeros lineales o plegados tales como el ADN o las proteínas. En contraste a la secuencia proteica, que está determinada por la plantilla del ADN, los azúcares se unen a las proteínas mediante la catálisis de enzimas altamente específicas que reconocen el sitio adecuado para unir el azúcar.
Así pues, resulta evidente que los carbohidratos son moléculas muy ricas en información que guían muchos procesos biológicos. La modificación de las proteínas mediante la inserción de un carbohidrato está normalmente asociada con:
- Procesos de reconocimiento para la unión de otras moléculas. Existen proteínas, llamadas lectinas, que tienen dos o más sitios específicos de reconocimiento de azúcares, lo que explica su capacidad para aglutinar ( es decir, establecer enlaces entrecruzados) a los eritrocitos con otras células. En este sentido, también los hidratos de carbono también son claves en la interacción entre el espermatozoide y el óvulo, en los procesos de retorno de los linfocitos circulantes en la sangre a los centros linfáticos de los que derivaron originalmente, en los procesos de formación de los circuitos cerebrales, etc.
- Protección frente a la proteólisis e incremento del tiempo de vida media de la proteína. Por ejemplo, los residuos terminales de carbohidrato de una glicoproteína pueden servir como señas para que las células hepáticas eliminen esta proteína de la sangre. El receptor de superficie celular mejor conocido que cumple esta función es el receptor de asialoglicoproteínas. Muchas proteínas recién sintetizadas, como inmunoglobulinasy hormonas peptídicas, tienen azúcares con residuos de ácido siálicos terminales. A lo largo de horas o de días, dependiendo de la proteína concreta, los resíduos terminales de ácido siálico son eliminados por las sialasas, las cuales sobresalen de la superficie de los vasos sanguíneos. Los residuos de galactosa que estas proteínas recortadas dejan expuestos, son detectados por los receptores de asiaglicoloproteínas de la membrana plasmática de las células hepáticas y forman un complejo con ellas. El complejo formado se introduce en la célula hepática (endocitosis) y así se elimina la proteína recortada del fluido sanguíneo. Así pues, estas unidades de oligosacáridos señalan el paso del tiempo para indicar que las proteínas que las transportan deben ser retiradas del torrente sanguíneo.
- Prevención de la agregación durante el proceso de plegamiento proteico
Los azúcares predominantes en las glicoproteínas son la glucosa, galactosa, manosa, fucosa, N-acetilgalactosamina y N-acetilglucosamina. La unión del azúcara a la parte proteica es, bien a través de un enlace N-glucosídico a través del grupo amida de una asparragina, o bien a través de un enlace O-glucosídico a través de un grupo hidroxilo de una serina, una treonina o una hidroxilisina.
La unión N-glicosídica se hace, bien a una GlcNAc o a una GalNAc, a través de una Asn en una secuencia X-Asn-X-Thr. Aunque hay tres tipos de glicoproteínas N-unidas (tipo alto contenido en manosa, tipo complejo y tipo híbrido) todas ellas contienen el mismo núcleo de oligosacárido el Man-(a-1,6)[Man-(a-1,3)]Man-(b-1,4)-(GlcNAc)-(b-1,4)-(GlcNAc) que se une en conformación b a la Asn. A partir de este núcleo uniforme de oligosacáridos, se ramifican diferentes tipos de oligosacáridos con una gran variedad de composición y de estructura.
No hay comentarios:
Publicar un comentario