TIPOS
| Membrana celular » | |||||||||||||||||||||||||||||||||||||||||||||||||
Los diferentes tipos de membrana se diferencian en la proporción y tipo de moléculas que la componen.
La pared celular contiene muchos azúcares, sobre todo glucosa formando celulosa. La lámina basal contiene colágeno y laminina formando una malla. El cartílago contiene una gran cantidad de glicosaminoglucanos para resistir presiones y fuerzas mecánicas. El hueso posee colágeno tipo I que aporta elasticidad y precipitados de calcio que aporta dureza.
Como se ha mencionado, algunos tejidos pueden llevar a cabo las funciones que tienen encomendadas en el organismo gracias a las propiedades de sus matrices extracelulares, que varían en el tipo y en la cantidad de las moléculas que las componen. Esto es cierto para los tejidos animales y para los tejidos vegetales. A la matriz extracelular de las plantas se le denomina pared celular. Nosotros vamos a considerar a la pared celular como una matriz extracelular muy especializada, aunque no todos los autores la consideran como tal puesto que es radicalmente diferente a la que nos encontramos en los tejidos animales.
Pared celular
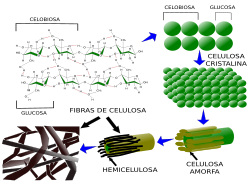
Las células vegetales no se entienden sin la pared celular y es una característica distintiva respecto a las célula animales, considerándola algunos autores como un orgánulo celular más. Es la estructura de protección y el sostén de la célula vegetal y determina la forma y el tamaño celular, así como las características de los tejidos. Aporta a los tejidos vegetales resistencia a tensiones mecánicas, tanto de estiramiento como de compresión, y es la que permite el soporte de las partes aéreas de la planta. La existencia de la pared celular en las células de las plantas hace que el citoesqueleto no pueda participar en los movimientos celulares o morfogénesis celular mediante fuerzas generadas hacia el exterior celular, y por tanto está menos desarrollado que en las células animales. Una característica importante es que la pared celular sigue realizando su función incluso cuando las células que la sintetizaron han muerto, como ocurre en la madera de los árboles. La molécula más importante de la pared celular es la celulosa, la molécula orgánica más abundante de la Tierra. No todas las paredes celulares son iguales y sus características varían según los tejidos en los que se encuentren.

Organización de las diferentes capas de la pared celular de las células con crecimiento secundario
Capas. La pared celular varía en grosor según el tipo y la edad de la célula que la produce. Nos podemos encontrar hasta 3 capas en las paredes celulares: la lámina media, la pared primaria y la pared secundaria. Las células sintetizan estas capas en el orden descrito y siempre la capa más reciente es la que está más próxima a la célula. Todas las células tienen lámina media, que comparten con la célula contigua, y pared celular primaria, más o menos gruesa, pero sólo algunas desarrollan pared secundaria. La pared primaria permite a la célula crecer en tamaño puesto que es extensible gracias a presiones hídricas, lo que se denomina turgencia celular. La pared celular secundaria se deposita en las células que tienen que resistir fuertes presiones o que forman los vasos conductores, y puede subdividirse en subcapas. La síntesis de pared secundaria implica que la célula ya no crecerá más puesto que no es extensible como la primaria. Posee normalmente aberturas por donde puede circular el agua entre células vecinas ya que es impermeable al agua. Hay una gran diversidad en la composición de las paredes celulares de diferentes especies, pero también entre células de una misma planta. La pared secundaria se puede depositar de manera homogénea o sólo en determinadas regiones de la periferia de la célula formando estructuras helicoidales, reticulares, etcétera.
La pared celular contiene numerosas especializaciones como los plasmodesmos, que son interrupciones de la pared que permiten la comunicación directa citoplasma-citoplasma entre células vecinas, y la continuidad de sus membranas plasmáticas. Las paredes de las células de la epidermis contienen suberina o cutina que impide la desecación y la entrada de patógenos.
Componentes. La pared celular está formada fundamentalmente por 3 tipos de polisacáridos: celulosa, hemicelulosa y pectinas, además de proteínas y otras sustancias químicas. El principal componente de la pared celular es la celulosa, un polisacárido de glucosas conectadas con enlaces del tipo β1-4. Las largas cadenas de glucosa se asocian paralelamente entre sí para formar microbrillas, las cuales pueden tener un diámetro variable, que a su vez se asocian para formar las fibras de celulosa. Estas fibras son visibles al microscopio y tienen una resistencia enorme a la tensión, parecida a la del acero. Las fibras de celulosa están formadas, además de por las microfibrillas, por hemicelulosa, pectinas, que también son glúcidos, y glicoproteínas.
La hemicelulosa está formada por cadenas de glúcidos que contienen xilosa, glucosa y manosa, los cuales establecen puentes entre las microfibrillas de celulosa y afectan a su grado de cristalización y a la fortaleza su entramado. Las pectinas son el tipo de polisacárido más variado de las paredes celulares primarias, mientras que están ausentes de las secundarias. Son polisacáridos heterogéneos, poseen ácido galacturónico y favorecen la interconexión de microfibrillas de celulosa. Son moléculas altamente hidrofílicas. Las enzimas de la pared celular actúan en su remodelación. Algunas paredes especializadas contienen otros glúcidos como la calosa, que es un polisacárido que se sitúa entre la membrana de la célula y la porción celulosítica. Su síntesis, al igual que la celulosa, se produce en la membrana celular, aumenta en respuesta a heridas o patógenos y cierra la comunicación entre células cuando se deposita en las perforaciones de la pared celular. La lignina es un polímero complejo de polifenoles que se deposita en las paredes secundarias y restringe la difusión de agua y aporta una gran resistencia mecánica. En las paredes celulares de los tejidos de protección como la epidermis se depositan sustancias como la cutina y la suberina, que son depósitos lipídicos que impiden la pérdida de agua de los tejidos y la entrada de patógenos.
La pared celular es un elemento clave en la forma y crecimiento de las células vegetales, y por extensión del resto de la planta. EL crecimiento de una célula vegetal está determinado por las propiedades mecáncias de su pared celular, lo que a su vez dedende de su grosor y composición química. Cualquier cambio celular en forma o tamaño requiere un cambio de forma, degradación o síntesis de la pare celular. La célula puede modificar la rigidez mediante la modificación de esas moléculas. La rigidez de la pared celular se debe principalmente a las fibras de celulosa, su orientación y su interacción con otras moléculas como la hemicelulosa, princalmente el xiloglucano (el tipo de hemicelulosa más abundante). Las pectinas (otros polisacáridos complejos) son también importantes en la resistencia y la deformación de la pared celular.
Lámina basal.
La lámina basal es una delgada capa de matriz extracelular que se encuentra en la base de todos los epitelios, también envolviendo a las células musculares y a las células nerviosas que se encuentran fuera del sistema nervioso central. Sus principales funciones son dar soporte físico y actuar como barrera con una permeabilidad selectiva. En los glomérulos del riñón es importante en la filtración de la sangre. La lámina basal está formada por varios tipos de moléculas que forman un entramado en forma de malla. Están presentes el colágeno tipo IV, la laminina, el proteoglicano perlecano y la proteína nidogen. La lámina basal se une a las membranas celulares por la adhesión entre las integrinas, situadas en las membrana plasmática, y las lamininas.
Tejidos conectivos propiamente dicho laxo y denso.
El tejido conectivo propiamente dicho de tipo laxo☆ está formado por una matriz extracelular poco densa formada sobre todo por hialuronato y proteglicanos, con poca proporción de moléculas de colágeno y de fibras elásticas. Su principal misión es rellenar e hidratar espacios intercelulares y ser el medio por el que viajan una gran diversidad de células que se pueden encontrar en este tejido, además de los fibroblastos. Sin embargo, en el tejido conectivo propiamente dicho de tipo denso abundan las fibras de colágeno que se disponen paralelas a la tensión mecánica que soportan estos tejidos, como ocurre en los tendones☆, o de forma más desorganizada como ocurre en la dermis o en el sistema digestivo. En este tipo de matriz extracelular pueden ser abundantes las fibras elásticas, como ocurre en la pared de las arterias.
Tendón.
El tendón es una de las estructuras de los animales donde más claramente se entiende que sus propiedades de resistencia y elasticidad dependen de las características de su matriz extracelular. En los tendones las fibras de colágeno se disponen paralelas a la dirección de la tensión mecánica, que sólo se produce en dicha dirección. Es una matriz muy rica en fibras de colágeno fibrilar entre las que se encuentran los fibroblastos. El colágeno representa del 65 al 80 % del peso seco de la matriz extracelular, mientras que la elastina es el 1 al 2 %.
Cartílago.
La resistencia y elasticidad del cartílago☆ es debida a la matriz extracelular producida por los condrocitos. Esta matriz extracelular está formada principalmente por fibras de colágeno tipo II que forman aproximadamente el 25 % de la masa seca, aunque también están presentes el colágeno tipo IX y XI en menor proporción. La segunda molécula más abundante son los glicosaminoglicanos, como el hialuronato, y proteoglicanos, los cuales se asocian para formar grandes agregados. Entre los proteoglicanos destaca el condroitín sulfato, siendo abundante el agrecano. El colágeno resiste fuertes tensiones de estiramiento y los glicosaminoglicanos resisten grandes presiones mecánicas. En el cartílago de tipo elástico abundan las fibras elásticas y aporta elasticidad a estructuras tales como la faringe, la epiglotis o al pabellón auditivo. CS son los principales componentes del cartílago. El agrecano es el más abundante en el cartílago articular.
Hueso.
En el hueso☆ existen fibras de colágeno tipo I inmersas en una matriz de cristales de fosfato cálcico (suponen dos tercios del peso seco del hueso). Ambos elementos aportan al hueso sus propiedades: el colágeno permite la elasticidad para que no sea frágil y los cristales de fosfato cálcico su dureza. La matriz extracelular del hueso contiene diversos tipos de proteoglicanos y de glicoproteínas en menores proporciones, aunque son muy importantes para la organización del colágeno, la mineralización y la reabsorción del hueso. También en la matriz extracelular del hueso hay proteoglicanos. El condroitín sulfato representan del 67 al 97 % de los glicosaminoglicanos del hueso.
Tejido nervioso.
En el sistema nervioso hay muy poca matriz extracelular. Abundan el ácido hialurónico y los proteoglicanos, y hay poco porcentaje de moléculas como colágeno, elastina y glicoproteínas. En este caso, durante el desarrollo, la matrix se secreta por las neuronas y por la glía. El ácido hialurónico funciona como molécula estructural principal sobre la que se ensamblan las demás. En torno a neuronas se forman una capa limítrofe de matriz denominada red perineural. Estas redes están formadas sobre todo por hialurónico, tenascina, y proteoglicandos con condroitín sulfato (se han encontrado hasta 16 tipos diferentes.). Estas redes aparecen cuando el tejido nervioso ha dejado de desarrollarse y parece que tienen la función adicional de inhibir la movilidad y remodelación celular. La plasticidad neuronal se activa cuando estas redes se deterioran o desaparecen. Pero la matriz también cambia con el desarrollo. Se ha visto que el condroitín sulfato tipo C es abundante en el sistema nervioso en embriones y decrece gradulamente tras el nacimiento y desaparece en adultos, para ser reemplazado por el condroitín sulfato tipp-A
Suero sanguíneo.
Algunos autores consideran que el suero sanguíneo es una matriz extraordinariamente especializada donde más del 90 % del peso corresponde al agua. Otros no lo encuadran dentro del término matriz extracelular. Sin embargo, es el elemento que rodea a las células sanguíneas. La proteína más abundante del suero es la albúmina, cuya principal misión es mantener una presión osmótica correcta entre el interior de los vasos sanguíneos y los tejidos que los rodean, por ejemplo evitando la formación de edemas. Otras proteínas abundantes son las γ-inmunoglobulinas, anticuerpos del sistema inmune, y otras sin actividad defensiva como son las α- y β-globulinas. Éstas últimas sirven para transportar determinados productos como el hierro o el cobre. En el suero también aparecen moléculas como la fibronectina que se pueden intercambiar con el tejido conectivo que rodea a los vasos sanguíneos. El fibrinógeno presente en el suero es una molécula esencial para la coagulación de la sangre. Las demás moléculas de bajo peso molecular que están en el suero también se pueden encontrar en los tejidos circundantes puesto que atraviesan libremente los capilares sanguíneos.
La matriz extracelular es una intrincada red macromolecular que se encuentra en el espacio extracelular. La matriz está compuesta por polisacáridos y proteínas muy diversas, secretadas localmente y ensambladas formando una compleja red que rodea a las células. La matriz está muy desarrollada en el tejido conjuntivo y sus derivados.
En la interfase entre el epitelio y el tejido conjuntivo, la matriz forma una lámina BASAL fina pero resistente, que juega un importante papel en el control del comportamiento celular.
1. COMPONENTES DE LA MATRIZ EXTRACELULAR.
Las macromoléculas que constituyen la matriz proceden fundamentalmente de la secreción local por los fibroblastos (conjuntivo), condroblastos (cartílago) y osteoblastos (hueso). Las dos clases principales de macromoléculas que conforman la matriz son:
a) Proteoglicanos: 95% glucosaminoglicano (GAG) + 5% proteína. Forman la sustancia fundamental, altamente hidratada, que presenta propiedades de gel y en la que están englobadas las proteínas fibrosas.
b) Proteínas fibrosas, pertenecientes a dos tipos funcionales:
– Estructurales: colágeno (resistencia mecánica) y elastina (elasticidad).
– Adhesivas: fibronectina (adhesión de fibroblastos y células relacionadas a la matriz) y, laminina y entactina (adhesión de las células epiteliales a la lámina basal).
2. PROTEOGLICANOS.
2.1. LAS CADENAS DE GLUCOSAMINOGLICANOS (GAG).
Los GAG son largas cadenas no ramificadas de polisacáridos compuestas por unidades repetidas de disacárido. El disacárido que más se repite es la N-acetilglucosamina, que en la mayoría de los casos se presenta sulfatado y el segundo residuo es un ácido urónico. El resultado es un GAG con una elevada carga negativa.
Las cadenas de GAG son poco flexibles y altamente hidrofílicas. Así los GAG tienden a adoptar una conformación extendida, con plegamiento al azar, ocupando una gran cantidad de volumen respecto a su masa, y formando geles. Su alta densidad de carga negativa es la causa de la captación de numerosos cationes como el Na+, que son osmóticamente activos. Estos cationes conducen a la acumulación de grandes volúmenes de agua que dan lugar a una presión de hinchamiento o turgencia, que se opone a las fuerzas de compresión.
2.2. SÍNTESIS DEL PROTEOGLICANO.
Exceptuando el Ac hialurónico, el resto de GAG están unidos covalentemente a una proteína, constituyendo proteoglicanos.
– La proteína central se sintetiza en los ribosomas del RER y los GAG se unen en el complejo de Golgi.
– En primer lugar se une un “trisacárido de unión especial” formado por xilosa y galactosa, que se enlaza a un resto de serina de la proteína central y sirve de cebador para el crecimiento de la cadena polisacárida. Los disacáridos se van añadiendo paso a paso por una glucosiltransferasa específica.
– De manera simultánea a la elongación del GAG, la mayoría de los residuos de azúcar que han polimerizado son modificados mediante una serie de reacciones de sulfatación, por sulfotransferasa del A. de Golgi.
– Los proteoglicanos tienen una heterogeneidad potencial ilimitada. Pueden diferir en peso, carga, residuos, etc.
3. GLICOPROTEÍNAS.
3.1. EL COLÁGENO.
Es la principal proteína de la matriz extracelular.
3.1.1. ESTRUCTURA DEL COLÁGENO.
a) Los colágenos constituyen una familia de proteínas fibrosas muy características que se encuentran en todos los animales pluricelulares. Son secretadas principalmente por las células del tejido conjuntivo (fibroblastos, condroblastos, osteoblastos).
b) Constituyen el 25% de la proteína total del cuerpo.
c) El rasgo más característico es la estructura RÍGIDA HELICOIDAL DE TRES HEBRAS (cadenas alfa) enrolladas unas alrededor de otra formando una superhélice regular. Tienen 300 nm de longitud y 1.5 nm de diámetro. Las cadenas alfa son levógira, y están formadas por tres residuos/vuelta, de los que el tercero siempre es Gli.
d) Son moléculas muy ricas en PROLINA y GLICINA:
– La prolina estabiliza la estructura helicoidal levógira en cada una de las cadenas alfa de tres residuos por vuelta.
– La glicocola es el aminoácido más pequeño y se distribuye de forma regular a lo largo de la región central de la cadena alfa (Gli-X-Y), permitiendo que las tres cadenas se empaqueten de forma apretada. Es el único aminoácido que puede ocupar el eje de la triple hélice.
3.1.2. TIPOS DE COLÁGENO.
Hasta ahora se han identificado más de 20 tipos de cadenas alfa, cada una de las cuales está codificada por un gen diferente. Estos 20 tipos de cadenas han generado unos 10 tipos de colágeno, pero los mejor conocidos son I, II, III y IV.
– Los colágenos tipo I, II y III son los colágenos fibrilares del tejido conjuntivo. El colágeno es secretado en forma de monómeros y se polimeriza en el espacio extracelular, formando fibrillas filiformes de varias micras de longitud y de 10-300 nm de diámetro. Estas fibras se vuelven a agrupar para formar las fibras de colágeno (micras de diámetro).
– El colágeno tipo IV es exclusivo de las láminas basales, no forma fibrillas y sí redes laminares.
3.1.3. SECRECIÓN DEL COLÁGENO.
a) La síntesis del colágeno se inicia en los ribosomas del RER, donde se sintetizan como grandes precursores (procadenas alfa). Estos precursores tienen el peptido señal y otros aminoácidos suplementarios, denominados propéptidos, situados en las regiones N-t y C-t.
b) En el lumen del RER se hidroxilan residuos de prolina y lisina por la hidroxiprolina y la hidroxilisina. En las demás proteínas del organismo, raramente se encuentran residuos de HyPro e HyLys. Las funciones de estos aminoácidos son:
– HyPro: forma puentes de hidrógeno entre las cadenas, estabilizando la triple hélice. En el escorbuto hay déficit de Vit C, que es necesaria para que se produzca la hidroxilación de prolina (se forma un colágeno inestable).
– HyLys: es necesaria para la glicosilación ligada a la lisina, y el extenso entrecruzamiento que se produce en las moléculas de colágeno mientras tiene su ensamblaje en el espacio extracelular. El latirismo es una enfermedad producida por la ausencia de lisil-hidroxilasa.
c) Cada cadena alfa se combina con otras dos mediante puentes de hidrógeno, formando moléculas helicoidales de triple helicoidales (PROCOLÁGENO). El procolágeno es secretado por exocitosis.
3.1.4. PROCESAMIENTO DEL COLÁGENO EN EL ESPACIO EXTRACELULAR.
a) Colágeno tipo I, II y III: Después de la secreción, los propeptidos de las moléculas de procolágeno son eliminadas por proteasas específicas del espacio extracelular, transformándose en TROPOCOLÁGENO (1.5 nm de diámetro). Las moléculas de tropocolágeno se asocian, formando las fibrillas de colágeno (10-300 nm diámetro) que está facilitada por la tendencia de las moléculas a autoensamblarse. El procesamiento es cerca de la membrana plasmática, en invaginaciones. En el síndrome de Ehlers-Danlos, el proceso de eliminación de los propeptidos está alterado, provocando una anómala formación de fibrillas.
Los propeptidos tienen dos funciones:
– Dirigen la formación intracelular de la triple hebra de colágeno.
– Previenen la formación intracelular de grandes fibrillas de colágeno que causarían la muerte de la célula.
Una vez formadas las fibrillas, se refuerzan con la formación de puentes covalentes cruzados entre residuos de lisina de las moléculas de colágeno (específico del colágeno y la elastina). La cantidad y tipo de puentes cruzados varía según los tejidos, lo mismo que la organización de las fibrillas.
b) Colágeno tipo IV:
– Se organiza en una RED LAMINAR.
– La secuencia repetida Gli-X-Y está alterada, y la estructura de la triple hélice está desorganizada en otras regiones.
– Las moléculas de procolágeno tipo IV no son escindidas después de la secreción. Las moléculas secretadas interaccionan a través de sus domínios propeptidos, formando una red laminar estratificada. Primero se forman dímeros por asociación cabeza-cabeza en el extremo C-terminal. El paso siguiente es la asociación de los dímeros por interacción entre la triple hélice que se estabiliza por PUENTES DISULFURO y otros enlaces no covalentes.
3.2. ELASTINA.
Es una proteína enrollada al azar que presenta puentes cruzados, la cual proporciona a los órganos elasticidad. Es una proteína muy hidrofóbica, no glicosilada, rica en prolina y glicocola, con bajo contenido en HyPro y ausencia de HyLys. Es menos elástica que el colágeno.
Las moléculas de elastina son secretadas al exterior, donde crean filamentos y láminas, dando lugar a una extensa red. Los enlaces cruzados son entre residuos de Lys por el mismo mecanismo que en el colágeno.
La elastina se pliega formando espirales al azar que desaparecen cuando se estira. Intercaladas entre las fibras de elastina, se encuentran largas fibras de colágeno, inelásticas, que limitan la extensión de la fibra, previniendo así que el tejido se desgarre.
La insolubilidad de la elastina se debe a enlaces transversales entre las subunidades de la elastina, que forman dos peptidos exclusivos de la elastina (desmina e isodesmina). Este enlace transversal es formado durante el proceso de formación de la elastina por la lisil-oxidasa que une cuatro residuos de lisina.
3.3. FIBRONECTINA.
3.3.1. LA FIBRONECTINA ES UNA PROTEÍNA EXTRACELULAR ADHESIVA QUE CONTRIBUYE A LA ADHESIÓN DE LA CÉLULA A LA MATRIZ.
Es una glicoproteína de gran tamaño que forma fibrillas. Es un dímero compuesto por dos unidades semejantes, unidas entre sí mediante dos enlaces disulfuro situados cerca del extremo C-terminal. La fibronectina se encuentra bajo tres formas:
– Una dimérica y soluble, denominada fibronectina plasmática, que circula por la sangre y por otros fluidos orgánicos donde se cree que facilita la coagulación, la reparación de heridas y la fagocitosis.
– Una forma oligomérica, unida transitoriamente a la superficie celular (fibronectina de la superficie celular).
– Una forma fibrilar, altamente insoluble, localizada en la matriz extracelular (fibronectina de la matriz).
La fibronectina es una molécula multifuncional en la que los diversos dominios globulares juegan distintos papeles (unión al colágeno, heparina, Rc específico de la superficie de varias células). De este modo, la fibronectina contribuye a la organización de la matriz y facilita el anclaje a ella de las células. La fibronectina también participa en la migración de las células.
3.3.2. LAS DIVERSAS FORMAS DE FIBRONECTINA SON PRODUCTO DE UNA MADURACIÓN ALTERNANTE POR CORTE/EMPALME (splicing) DEL RNA.
La fibronectina puede presentar diversas formas, pero sólo hay un gen de 70 Kb y 50 exones (uno de los más largos que se conocen). La transcripción del gen produce una única molécula de RNAhn que madura por splicing alternativo, generando alrededor de 20 RNAm diferentes, en función del tipo de célula.
3.4. TENASCINA.
Es una glucoproteína de la matriz extracelular, secretada por las células del tejido, que participa en la adhesión célula-matriz. Su distribución preferente es en tejidos embrionarios.
Es una molécula formada por 6 proteínas que se disponen como los radios de una rueda de carro, y están unidas por puentes disulfuro.
4. LAMINA BASAL.
Las láminas basales están constituidas por una matriz extracelular especializada compuesta por colágeno tipo IV, proteoglicanos (heparan-sulfato), LAMININA y ENTACTINA.
Se sintetiza por las células que se apoyan en ella. Se sitúa en la base de los epitelios, fibras musculares y células de Schwann, separando a las células del tejido conjuntivo adyacente. En el glomérulo renal y alvéolos pulmonares, separan dos capas celulares diferentes y funciona como filtro altamente selectivo.
Otras funciones de la lámina basal:
– Determinan la polaridad celular.
– Influyen en el metabolismo celular.
– Organizan las proteínas de la membrana plasmática adyacente.
– Inducen la diferenciación celular.
– Sirven de autopista específica para la migración celular.
La LAMININA es una glicoproteína que forma parte de la lámina basal asociada a otras proteínas como el colágeno, entactina, proteoglucanos y fibronectinas. Tiene una longitud de 120 nm, y atraviesa toda las capas de la lámina basal. Su función sería la de anclar las células epiteliales a la lámina densa pues tiene sitios de unión para moléculas de integrinas de la membrana plasmática de la base celular.La LAMININA tipo I es un complejo (850 Kd) formado por tres largas cadenas polipeptídicas dispuestas en forma de cruz y unidas pos puentes disulfuro. Presenta varios domínios funcionales de unión al colágeno, heparan-sulfato, Rc de laminina de la superficie celular.
La ENTACTINA, también conocida como nidogen-1, es una proteina que en humanos está codificadaa por el gene NID1 que participa en las interacciones de las células con la matriz extracelular. Es un componente de la membrana basal, junto con la colágena tipo IV, los proteoglicanos (heparan sulfato y los glucosaminoglucanos), laminina y fibronectina.
http://epidemiologiamolecular.com/matriz-extracelular/
| |||||||||||||||||||||||||||||||||||||||||||||||||















No hay comentarios:
Publicar un comentario