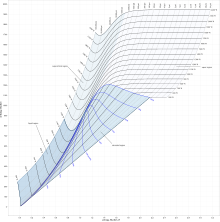
El diagrama Ph, o diagrama de Mollier para presión entalpía, es la representación gráfica en una carta semilogarítmica en el plano Presión/entalpía de los estados posibles de un compuesto químico —especialmente para los gases refrigerantes— y es en ella donde se trazan y suelen estudiar los distintos sistemas frigoríficos de refrigeración por compresión.
Historia[editar]
El diagrama fue creado en 1904, cuando Richard Mollier trazó el calor total contra la entropía.1 En la Conferencia de Termodinámica de 1923 celebrada en Los Ángeles se decidió nombrar, en su honor, como un "diagrama de Mollier" cualquier diagrama termodinámico que usase la entalpía h como uno de sus ejes.2
Descripción[editar]
Básicamente el diagrama está compuesto por dos ejes principales y tres zonas delimitadas por una curva de saturación.
- En el eje de las ordenadas se registra el valor de Presión en (bar) -para diagramas Ph en SI-, eje graduado en escala logarítmica.
- En el eje de las abcisas se registra el valor de entalpía en unidad de masa en [kJ/kg] ó [kcal/kg].
- Una curva de saturación con forma de “U” invertida la cual determina si el compuesto se encuentra en estado de: líquidosubenfriado, líquido saturado, mezcla líquido-vapor, vapor saturado o vapor sobrecalentado (color rojo).
A su vez se definen seis tipos de trazas a través de las cuales se describen los ciclos de refrigeración y los estados de agregación de la materia.
- Isobaras: Rectas paralelas que coinciden iguales valores de presión. Estas son perpendiculares al eje de las ordenadas.
- Isoentálpicas: Rectas paralelas que coinciden iguales valores de entalpía en masa. Estas son perpendiculares al eje de las abcisas.
- Isotermas: que en la zona de líquido subenfriado son paralelas a la ordenada y dentro de la campana de mezcla son paralelas a la abcisa, y en la zona de vapor sobrecalentado descienden en forma curva. Estas trazas –“paralelas” entre sí- coinciden los valores de igual temperatura del sistema, y en las tablas Ph en el SI está expresado en grados Celsius (color azul).
- Isocoras: Son las curvas que coinciden los puntos con igual volumen específico y también son paralelas entre sí para distintos valores. En el SI está expresado en [m³/kg]. Se desarrollan en la izquierda de la zona de mezcla líquido-vapor y se extiende hacia la derecha hasta la de vapor sobrecalentado hasta el final del diagrama (color verde).
- Isoentrópicas: Son las curvas que coinciden los valores de igual entropía en el sistema. En el SI se miden en [kJ/kg K] ó [kJ/kg°C]. Paralelas entre sí y de una elevada pendiente (color amarillo).
- Nueve curvas de "título de vapor" o "calidad de vapor" que indican el porcentaje en masa de vaporcontenido en la mezcla líquido-vapor. Estas curvas, existentes sólo dentro de la campana de mezcla, son coincidentes en su extremo superior mas su extremo inferior se encuentra relativamente equidistante a la adyacente y así sucesivamente. Son nominadas con los valores del 0,1 al 0,9 (color violeta).
En la parte superior de la curva de saturación se define el llamado punto crítico el cual es el límite a partir del que, por mucho que se aumente la presión, no es posible condensar el gas.
Diagrama Ph y Sistemas de refrigeración[editar]
Por su parte, cada refrigerante tiene su propio diagrama Ph con particularidades que lo hacen más o menos adecuado a cada aplicación frigorífica y propiedades exclusivas como relación temperatura/presión tanto de saturación como en mezcla, efecto refrigerante, temperatura de descarga del compresor en función de la entropía, entre otros.
Una de las grandes ventajas del diagrama Ph es la facilidad y fiabilidad con que se pueden realizar los cálculos de sistemas frigoríficos y selección de componentes como evaporadores, condensadores, compresores y dispositivos de expansión, tuberías y accesorios, así como trazar todo tipo de sistemas frigoríficos, bien sea de una etapa, compresión múltiple, sistemas en cascada, sistemas con recirculado por bomba y otros.-


efecto de Joule-Thomson o efecto Joule-Kelvin es el proceso en el cual la temperatura de un sistema disminuye o aumenta al permitir que el sistema se expanda libremente manteniendo la entalpíaconstante.
Fue descrito por James Prescott Joule y William Thomson, el primer Barón Kelvin, quienes establecieron el efecto en 1852 modificando un experimento previo de Joule en el que un gas se expandía manteniendo constante su energía interna.
Descripción[editar]
La relación entre temperatura, presión y volumen de un gas se puede describir de una forma sencilla gracias a las leyes de los gases. Cuando el volumen aumenta durante un proceso irreversible, las leyes de los gases no pueden determinar por sí solas qué ocurre con la temperatura y presión del gas. En general, cuando un gas se expande adiabáticamente, la temperatura puede aumentar o disminuir, dependiendo de la presión y temperatura inicial. Para una presión constante (fijada previamente), un gas tendrá una temperatura de inversión de Joule-Thomson (en grados Kelvin), sobre la cual al comprimirse el gas causa un aumento de temperatura, y por otro lado, la expansión del gas causa un enfriamiento. En la mayoría de los gases, a presión atmosférica esta temperatura es bastante alta, mucho mayor que la temperatura ambiental, y por ello la mayoría de los gases se enfrían al expandirse. El incremento de temperatura (ΔT) con respecto al incremento de presión (Δp) en un proceso de Joule-Thomson es el coeficiente de Joule-Thomson.
Esta expresión se puede encontrar también escrita de la siguiente forma:
El valor de depende del gas específico, tanto como la temperatura y la presión del gas antes de la expansión o compresión. Para gases reales esto será igual a cero en un mismo punto llamado punto de inversión y la temperatura de inversión Joule-Thomson es aquella donde el signo del coeficiente cambia.







No hay comentarios:
Publicar un comentario