cuarto principio o cuarta ley de la termodinámica es el postulado del economista rumano Nicholas Georgescu-Roegen, que afirma que la materia disponible se degrada de forma continua e irreprensiblemente en materia no disponible de forma práctica. Es una modificación del segundo principio de la termodinámica pero aplicándolo a la materia, en vez de a la energía1 (aunque ya Einstein dio la relación entre materia y energía). Se trata, por tanto, de un principio con implicaciones en la economía, y no tanto en la termodinámica.
Explicaciones del concepto[editar]
Otra forma de enunciar este principio es afirmar que durante el uso de materiales, siempre hay una parte que se degrada y que es imposible de recuperar, ni con los métodos más futuristas de reciclado. Es imposible conseguir un rozamiento nulo que no desgaste los materiales, ni que ese desgaste pueda ser recuperado (reutilizado o reciclado).
Así mismo, el teórico del decrecimiento, Serge Latouche, en su libro "La apuesta por el decrecimiento: ¿cómo salir del imaginario dominante?", realiza la siguiente descripción del principio:2
- Los procesos de transformación de la energía no son reversibles (segunda ley de la termodinámica) y, en la práctica, pasa lo mismo con la materia; a diferencia de la energía, ésta es reciclable, pero nunca íntegramente: «Podemos reciclar las monedas metálicas usadas, escribe Nicholas Georgescu-Roengen, pero no las moléculas de cobre disipadas por el uso». Este fenómeno que él ha bautizado como «la cuarta ley de la termodinámica», puede ser discutible en teoría, pero no desde el punto de vista de la economía concreta.
Este principio ya había sido formulado por el célebre termodinamicista Mark Zemansky que formaliza el hecho de que las máquinas se desgastan, y la materia disipada es prácticamente imposible recuperarla totalmente: el reciclaje nunca puede ser completo.[cita requerida]
Este principio se ha utilizado para justificar el decrecimiento económico como mejor forma de afrontar el futuro de la humanidad, y fue la base con la que Nicholas Georgescu-Roegen definió su Bioeconomía, rama conocida posteriormente como economía ecológica.
Kozo Mayumi también asumió estos planteamientos,1 y además afirmó que «la escasez de recursos minerales establece un límite a la supervivencia de la humanidad sobre este planeta»"[cita requerida]. Esto demostraría científicamente que el crecimiento económico sostenido es sencillamente una forma temeraria de adelantar una especie de suicidio colectivo involuntario de la humanidad.
Otras obras que sirven de referencia[editar]
- N. Georgescu-Roegen, La Ley de la Entropía y el Proceso Económico (The Entropy Law and the Economic Process). 1971.
- N. Georgescu-Roegen, Energía y Mitos Económicos (Energy and Economic Myths). 1972.
- Mayumi Kozo, Bioeconomics and Sustainability, Edward Elgar, Cheltenham, 1999.
demonio de Maxwell es el nombre de una criatura imaginaria ideada en 1867 por el físico escocés James Clerk Maxwell como parte de un experimento mental diseñado para ilustrar la segunda ley de la termodinámica. Esta ley prohíbe que entre dos cuerpos a diferente temperatura se pueda transmitir el calor del cuerpo frío al cuerpo caliente. La segunda ley también se expresa comúnmente afirmando: "En un sistema aislado la entropíanunca decrece". En la primera formulación el demonio de Maxwell sería una criatura capaz de actuar a nivel molecular seleccionando moléculas calientes y moléculas frías separándolas. El nombre "Demonio" proviene aparentemente de un juego de naipes solitario conocido en Gran Bretaña en el que se debían separar cartas rojas y negras de modo análogo a moléculas calientes y frías. El demonio de Maxwell aparece referenciado también como Paradoja de Maxwell y es uno de los pilares de la filosofía de la física térmica y estadística.
Formulación del demonio de Maxwell[editar]
Partimos inicialmente de la premisa de que el demonio es capaz de diferenciar entre moléculas de gas a diferente temperatura, y separarlas en función de dicho factor. Aprovechando este colaborador, podríamos construir una máquina térmica con un rendimiento del 100 %.
El diseño sería el siguiente: imaginemos una mezclaequimolar de dos gases "azul" y "rojo", ambos con diferente capacidad calorífica específica (con lo cual es de suponer que, a iguales condiciones, las moléculas de uno de los dos se muevan a mayor velocidad que las del otro); contenida en un recipiente ideal en el que existe una pared intermedia que separa el recipiente en dos mitades, A y B, constituyendo un émbolo cuya biela sale del recipiente, y dotada de una "puerta" controlada por el demonio.
Si, por ejemplo, el calor específico del gas "azul" es mayor que el del gas "rojo", el demonio se pondrá a trabajar, y en un lapso determinado habrá separado (por el simple método de abrir selectivamente la puerta a las moléculas más rápidas para que pasen al lado "rápido" y a las más lentas al "lento" del recipiente) los dos gases, violando la segunda ley de la termodinámica —ha habido disminución de la entropía del sistema—.
El ciclo de la máquina se completa abriendo la puerta, y dejando que el gas "azul" vuelva a mezclarse con "rojo". O, si se utiliza un pistón, el movimiento espontáneo para tender de nuevo al estado de entropía máxima del sistema originará un cambio del volumen del lado en el que se encuentra el gas "rojo", provocando así el movimiento de la pared y con ella del émbolo, produciendo así un trabajo (se supone que entre la pared central unida al émbolo y el resto del recipiente no hay fricción).
La entropía puede disminuir, por ejemplo si se enfría un gas, no existen irreversibilidades, y por tanto la producción de entropía es nula. Además, el calor sería negativo pues el sistema lo pierde; por tanto recordando la formulación matemática de la Segunda Ley (referencia requerida) obtenemos que el incremento de entropía es negativo, con lo cual la entropía decrece.
George Gamow (1904-1968) físico prominente que formó parte del equipo que formuló la teoría del origen del universo conocida como "La Gran Explosión" (Big Bang) describe en forma magistral el concepto de Entropía en el capítulo "El Demonio de Maxwell" de su libro El Breviario del Señor Tompkins.
Posible resolución de la paradoja[editar]
Según Léon Brillouin la energía invertida en "capacidad de decisión" es la que se utiliza para separar ambos gases. En otras palabras, la segunda ley de la termodinámica no puede violarse por sistemas microscópicos con información.
Léon Brillouin, inspirado en el trabajo de Szilard enunció el teorema por el cual se relaciona la información con la entropía negativa. Enunciado sencillamente este teorema dice que toda medida, o adquisición de información, requiere un gasto energético.
Sin embargo también puede observarse que el cubículo donde se encuentra el demonio representa un sistema con un potencial cinético o de movimiento que se introduce al sistema de gases mediante el "trabajo" de abrir y cerrar la puerta, siendo posible la violación de la entropía siempre y cuando el demonio tenga energía para introducir al sistema.
Lo que aparenta ser un sistema térmicamente aislado es en realidad un sistema cinéticamente abierto, donde es posible transferir movimiento entre dos sistemas.
De esta forma no necesariamente es la información, dado que el demonio de todos modos, al estar aislado no la podría adquirir, sino la inyección de energía cinética lo que hace que sea posible una aparente violación de la entropía.
Versiones "reales" del demonio de Maxwell[editar]
Pueden encontrarse versiones reales de demonios de Maxwell (con su capacidad de disminuir la entropía equilibrada por el aumento de esta en su construcción o interacción con el medio) prácticamente en la totalidad de los sistemas biológicos que son capaces de disminuir localmente la entropía pero a costa de gastar energíaextraída de sus alimentos.
Un ejemplo utilizado con frecuencia es la acción de determinadas enzimas, proteínas capaces de catalizarreacciones químicas en los organismos vivos. Su capacidad de decisión, consistente en reconocer a sus materias primas y las acciones a desempeñar están codificadas (en términos de información) en la propia secuencia de aminoácidos de la proteína.
En el emergente campo de la nanotecnología también se estudian mecanismos capaces de disminuir localmente la entropía y de comportarse en cierta forma como un demonio de Maxwell. En todos los casos la segunda ley de la termodinámica se preserva si se tiene en cuenta la energía utilizada en la adquisición y utilización de la información.
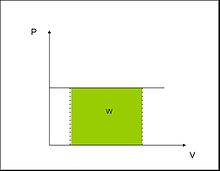
diagrama p-v12 (o simplemente diagrama PV) al diagrama que refleja la presión en el eje de ordenadas y el volumen en el eje de abscisas. En el diagrama p-v se representa el estado de un sistema termodinámico (como un punto en el mismo) o un proceso termodinámico del sistema (como una curva en él).
Utilidad del diagrama p-v[editar]
La ventaja más directa de la representación de los procesos termodinámicos en un diagrama p-v es que el trabajo realizado en el proceso (por el sistema o sobre el sistema) es el área bajo la curva. Efectivamente, de la propia definición del trabajo en termodinámica:123
Por tanto, para un proceso termodinámico concreto entre los estados y , el trabajo será el directamente el área bajo la curva si representamos como varía la presión en función del volumen .
Para ello, tenemos que tener en cuenta que al fijar el proceso termodinámico, estamos fijando también como varían el resto de variables termodinámicas que sean necesarias para definir el estado del sistema en cada punto. De esa manera, se supone que somos capaces de conocer la presión como función del volumen, .
Procesos termodinámicos habituales en el diagrama p-v[editar]
Los procesos más conocidos son aquellos en los que alguna de las variables termodinámicas permanece constante. Por ejemplo:4
- Isotérmico: proceso a temperatura constante.
- Isobárico: proceso a presión constante.
- Isocórico: proceso a volumen constante.
Ciclos termodinámicos en el diagrama p-v[editar]
Se dice que el sistema ha realizado un proceso cíclico cuando, tras una sucesión de procesos termodinámicos encandenados, termina en el mismo estado en el que se encontraba inicialmente56.
En esa situación, el trabajo total realizado en el ciclo por (o sobre) el sistema es el área total encerrada dentro del ciclo. Ello depende de como sea recorrido el ciclo:
- El sistema realiza un trabajo neto al recorrer el ciclo ,si se ha realizado en sentido horario en el diagrama p-v.
- Se ha realizado trabajo neto sobre el sistema al recorrer el ciclo , si se ha realizado en sentido antihorario en el diagrama p-v.













No hay comentarios:
Publicar un comentario