El despacho económico es la determinación a corto plazo de la producción óptima de varias instalaciones de generación de electricidad , para cumplir con la carga del sistema, al menor costo posible, sujeto a las restricciones de transmisión y operacionales. El problema de despacho económico se resuelve mediante un software informático especializado que debe satisfacer las limitaciones operativas y del sistema de los recursos disponibles y las capacidades de transmisión correspondientes. En la Ley de Política Energética de EE. UU. De 2005 , el término se define como "la operación de las instalaciones de generación para producir energía al costo más bajo para servir de manera confiable a los consumidores, reconociendo cualquier límite operacional de las instalaciones de generación y transmisión". [1]
La idea principal es que, para satisfacer la carga a un costo total mínimo, se debe usar primero el conjunto de generadores con los costos marginales más bajos, con el costo marginal del generador final necesario para cumplir con la carga que establece el costo marginal del sistema. Este es el costo de entregar un MWh adicional de energía al sistema. La metodología histórica para el despacho económico se desarrolló para administrar las centrales eléctricas que queman combustibles fósiles, basándose en cálculos que involucran las características de entrada / salida de las centrales eléctricas.
Formulación matemática básica [ editar ]
Lo siguiente se basa en Kirschen (2010). [2] Se puede considerar que el problema del despacho económico maximiza el bienestar económico W de una red eléctrica al mismo tiempo que cumple con las limitaciones del sistema. Para una red con n buses (nodos), donde I k representa la inyección de energía neta en el bus k , y C k ( I k ) es la función de costo de producir energía en el bus k , el problema no restringido se formula como:
Las restricciones impuestas al modelo son la necesidad de mantener un balance de potencia y que el flujo en cualquier línea no debe exceder su capacidad. Para el balance de potencia, la suma de las inyecciones netas en todos los buses debe ser igual a las pérdidas de potencia en las sucursales de la red:
Las pérdidas de potencia L dependen de los flujos en las ramas y, por lo tanto, de las inyecciones netas como se muestra en la ecuación anterior. Sin embargo, no puede depender de las inyecciones en todos los autobuses, ya que esto daría un sistema sobre-determinado. Así, un bus es elegido como el bus Slack y se omite de las variables de la función L . La elección del bus Slack es completamente arbitraria, aquí se elige el bus n .
La segunda restricción implica restricciones de capacidad en el flujo en las líneas de red. Para un sistema con mlíneas, esta restricción se modela como:
donde F l es el flujo en la rama l , y F l max es el valor máximo que este flujo puede tomar. Tenga en cuenta que la inyección neta en el bus flojo no se incluye en esta ecuación por las mismas razones que anteriormente.
Estas ecuaciones ahora se pueden combinar para construir el Lagrangiano del problema de optimización:
donde π y μ son los multiplicadores de Lagrangian de las restricciones. Las condiciones de optimalidad son entonces:
donde se necesita la última condición para manejar la restricción de desigualdad en la capacidad de la línea.
Resolver estas ecuaciones es computacionalmente difícil ya que no son lineales e implican implícitamente la solución de las ecuaciones de flujo de potencia . El análisis se puede simplificar utilizando un modelo linealizado denominado flujo de potencia de CC.
Despacho ambiental [ editar ]
En el envío ambiental, las consideraciones adicionales relacionadas con la reducción de la contaminación complican aún más el problema del envío de energía. Las restricciones básicas del problema de despacho económico siguen vigentes, pero el modelo está optimizado para minimizar las emisiones contaminantes además de minimizar los costos de combustible y la pérdida total de energía. [3] Debido a la complejidad agregada, se han empleado una serie de algoritmos para optimizar este problema de despacho ambiental / económico. Cabe destacar que un algoritmo de abejas modificado que implementa principios de modelado caótico se aplicó con éxito no solo en silico , sino también en un sistema modelo físico de generadores. [3] . Otros métodos utilizados para abordar el problema del envío de emisiones económicas incluyenOptimización de enjambre de partículas(PSO) [4] y redes neuronales [5]
Otra combinación de algoritmos notable se usa en una herramienta de emisiones en tiempo real llamada Metodología de Estimación de Emisiones Locales (LEEM) que vincula el consumo de energía eléctrica y las emisiones contaminantes resultantes. [6] El LEEM estima los cambios en las emisiones asociadas con los cambios incrementales en la demanda de energía derivados de la información del precio marginal de ubicación (LMP) de los operadores de sistemas independientes (ISO) y los datos de emisiones de la Agencia de Protección Ambiental de los Estados Unidos (EPA). [6] LEEM se desarrolló en la Universidad Estatal de Wayne como parte de un proyecto destinado a optimizar los sistemas de transmisión de agua en Detroit, MI, a partir de 2010, y desde entonces ha encontrado una aplicación más amplia como una herramienta de gestión del perfil de carga que puede ayudar a reducir los costos de generación y las emisiones.

Varias celdas y baterías (de arriba a la izquierda a abajo a la derecha): dos pilas AA , una D , una radio de mano para radioaficionados , dos baterías de 9 voltios(PP3), dos AAA , una C , una videocámara , una batería de teléfono inalámbrico
| |
| Tipo | Fuente de alimentación |
|---|---|
| Principio de funcionamiento | Reacciones electroquimicas, fuerza electromotriz. |
| Primera produccion | 1800s |
| Simbolo electronico | |
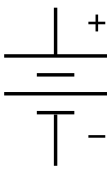 El símbolo de una batería en un diagrama de circuito . Se originó como un dibujo esquemático del primer tipo de batería, unapila voltaica . | |
Una batería es un dispositivo que consta de una o más celdas electroquímicas con conexiones externas provistas para alimentar dispositivos eléctricos como linternas , teléfonos inteligentes y automóviles eléctricos . [1] Cuando una batería está suministrando energía eléctrica , su terminal positivo es el cátodo y su terminal negativo es el ánodo . [2] El terminal marcado como negativo es la fuente de electrones que fluirá a través de un circuito eléctrico externo al terminal positivo. Cuando una batería está conectada a una carga eléctrica externa, un redoxla reacción convierte los reactivos de alta energía en productos de baja energía, y la diferencia de energía libre se entrega al circuito externo como energía eléctrica. [3] Históricamente, el término "batería" se refería específicamente a un dispositivo compuesto por varias celdas, sin embargo, el uso ha evolucionado para incluir dispositivos compuestos por una sola celda. [4]
Las baterías primarias (de un solo uso o "desechables") se usan una vez y se descartan; Los materiales del electrodo se cambian irreversiblemente durante la descarga. Ejemplos comunes son la batería alcalina utilizada para linternas y una multitud de dispositivos electrónicos portátiles. Las baterías secundarias (recargables) pueden descargarse y recargarse varias veces utilizando una corriente eléctrica aplicada; La composición original de los electrodos se puede restaurar por corriente inversa. Los ejemplos incluyen las baterías de plomo-ácido que se usan en los vehículos y las baterías de iones de litio que se usan para dispositivos electrónicos portátiles, como computadoras portátiles y teléfonos inteligentes .
Las baterías vienen en muchas formas y tamaños, desde celdas en miniatura usadas para alimentar audífonos y relojes de pulsera hasta celdas pequeñas y delgadas usadas en teléfonos inteligentes, hasta baterías grandes de plomo ácido o baterías de ión-litio en vehículos, y en el extremo más grande, enormes baterías de baterías. Tamaño de las salas que proporcionan energía de reserva o de emergencia para centrales telefónicas y centros de datos informáticos .
Según una estimación de 2005, la industria mundial de baterías genera US $ 48 mil millones en ventas cada año, [5] con un crecimiento anual del 6%.
Las baterías tienen una energía específica mucho menor (energía por unidad de masa) que los combustiblescomunes , como la gasolina. En los automóviles, esto se compensa en parte con la mayor eficiencia de los motores eléctricos para convertir la energía química en trabajo mecánico, en comparación con los motores de combustión.
Historia
El uso de "batería" para describir un grupo de dispositivos eléctricos data de Benjamin Franklin , quien en 1748 describió múltiples botes de Leyden por analogía con una batería de cañón [6] (Benjamin Franklin tomó prestado el término "batería" del ejército, que se refiere a a las armas que funcionan juntas [7] ).
El físico italiano Alessandro Volta construyó y describió la primera batería electroquímica, la pila voltaica , en 1800. [8]Esta fue una pila de placas de cobre y zinc, separadas por discos de papel empapados en salmuera, que podrían producir una corriente constante durante un tiempo considerable. de tiempo. Volta no entendió que el voltaje se debía a reacciones químicas. Pensó que sus células eran una fuente inagotable de energía, [9] y que los efectos de corrosión asociados en los electrodos eran una simple molestia, más que una consecuencia inevitable de su funcionamiento, como demostró Michael Faraday en 1834. [10]
Aunque las baterías tempranas eran de gran valor para fines experimentales, en la práctica sus voltajes fluctuaban y no podían proporcionar una gran corriente durante un período sostenido. La celda Daniell , inventada en 1836 por el químico británico John Frederic Daniell , fue la primera fuente práctica de electricidad, convirtiéndose en un estándar de la industria y viendo la adopción generalizada como una fuente de energía para las redes de telégrafos eléctricos . [11] Consistía en una olla de cobre llena con una solución de sulfato de cobre , en la que se sumergió un recipiente de barro sin esmaltar lleno de ácido sulfúrico y un electrodo de zinc. [12]
Estas células húmedas utilizaban electrolitos líquidos, que eran propensos a fugas y derrames si no se manejaban correctamente. Muchos usaban frascos de vidrio para sostener sus componentes, lo que los hacía frágiles y potencialmente peligrosos. Estas características hacen que las células húmedas no sean adecuadas para aparatos portátiles. Cerca del final del siglo XIX, la invención de las baterías de celda seca , que reemplazaron el electrolito líquido con una pasta, hizo prácticos los dispositivos eléctricos portátiles. [13]
Principio de funcionamiento
Las baterías convierten la energía química directamente en energía eléctrica . En muchos casos, la energía eléctrica liberada es la diferencia en las energías de cohesión [14] o de enlace de los metales, óxidos o moléculas que experimentan la reacción electroquímica. [3] Por ejemplo, la energía se puede almacenar en Zn o Li, que son metales de alta energía porque no están estabilizados por la unión de electrones d, a diferencia de los metales de transición . Las baterías están diseñadas de tal manera que la reacción redox energéticamente favorable solo puede ocurrir si los electrones se mueven a través de la parte externa del circuito.
Una batería consiste en un número de celdas voltaicas . Cada celda consta de dos semicélulas conectadas en serie por un electrolitoconductor que contiene cationes metálicos . Una media célula incluye el electrolito y el electrodo negativo, el electrodo al que migran los aniones (iones cargados negativamente); la otra media célula incluye el electrolito y el electrodo positivo, a los cuales migran los cationes ( iones cargados positivamente ). Los cationes se reducen (se agregan electrones) en el cátodo, mientras que los átomos de metal se oxidan (los electrones se eliminan) en el ánodo. [15]Algunas células utilizan diferentes electrolitos para cada semicélula; luego se usa un separador para evitar la mezcla de los electrolitos y permitir que los iones fluyan entre las semiceldas para completar el circuito eléctrico.
Cada media celda tiene una fuerza electromotriz ( fem , medida en voltios) con respecto a un estándar . La fem neta de la celda es la diferencia entre las fem de sus semiceldas. [16] Por lo tanto, si los electrodos tienen emfsy , entonces la emf neta es ; en otras palabras, la emf neta es la diferencia entre los potenciales de reducción de las medias reacciones . [17]
La fuerza motriz eléctrica o a través de los terminales de una celda se conoce como voltaje de terminal (diferencia) y se mide en voltios . [18] El voltaje terminal de una celda que no se está cargando ni descargando se llama voltaje de circuito abierto y es igual a la fem de la celda. Debido a la resistencia interna, [19] el voltaje del terminal de una celda que se está descargando es más pequeño que el voltaje de circuito abierto y el voltaje del terminal de una celda que se está cargando excede el voltaje del circuito abierto. [20] Una celda ideal tiene una resistencia interna despreciable, por lo que mantendría un voltaje terminal constante dehasta agotar, luego caer a cero. Si una celda de este tipo mantuviera 1.5 voltios y produjera una carga de un coulomb, luego de la descarga completa, habría realizado 1.5 julios de trabajo. [18] En las celdas reales, la resistencia interna aumenta con la descarga [19] y la tensión del circuito abierto también disminuye con la descarga. Si el voltaje y la resistencia se representan en función del tiempo, los gráficos resultantes son típicamente una curva; La forma de la curva varía según la química y la disposición interna empleada.
El voltaje desarrollado a través de los terminales de una célula depende de la liberación de energía de las reacciones químicas de sus electrodos y electrolitos. Las células alcalinas y de zinc-carbono tienen diferentes químicas, pero aproximadamente la misma fem de 1,5 voltios; igualmente, las células NiCd y NiMH tienen diferentes químicas, pero aproximadamente la misma fem de 1.2 voltios. [21] Los cambios en el potencial electroquímico alto en las reacciones de los compuestos de litio dan a las células de litio un valor de 3 voltios o más. [22]
Categorías y tipos de baterías.
Las baterías se clasifican en formas primarias y secundarias:
- Las baterías primarias están diseñadas para ser usadas hasta agotar la energía y luego desechadas. Sus reacciones químicas generalmente no son reversibles, por lo que no pueden recargarse. Cuando se agota el suministro de reactivos en la batería, la batería deja de producir corriente y es inútil. [23]
- Las baterías secundarias se pueden recargar; es decir, pueden revertir sus reacciones químicas al aplicar corriente eléctrica a la celda. Esto regenera los reactivos químicos originales, para que puedan usarse, recargarse y volver a usarse varias veces. [24]
Algunos tipos de baterías primarias utilizadas, por ejemplo, para circuitos telegráficos , se restauraron para funcionar al reemplazar los electrodos. [25] Las baterías secundarias no son recargables indefinidamente debido a la disipación de los materiales activos, la pérdida de electrolito y la corrosión interna.
Primario
Las baterías primarias, o celdas primarias , pueden producir corriente inmediatamente en el ensamblaje. Estos se usan más comúnmente en dispositivos portátiles que tienen un bajo consumo de corriente, se usan solo de manera intermitente, o se usan bien lejos de una fuente de energía alternativa, como en los circuitos de alarma y comunicación donde otra energía eléctrica solo está disponible de manera intermitente. Las células primarias desechables no pueden recargarse de manera confiable, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos pueden no volver a sus formas originales. Los fabricantes de baterías recomiendan no intentar recargar celdas primarias. [26] En general, estos tienen densidades de energía más altas que las baterías recargables, [27]pero las baterías desechables no funcionan bien en aplicaciones de alto drenaje con cargas de menos de 75 ohmios (75). Los tipos comunes de baterías desechables incluyen baterías de zinc-carbono y baterías alcalinas .
Secundario
Las baterías secundarias, también conocidas como células secundarias , o baterías recargables , deben cargarse antes del primer uso; Por lo general, se ensamblan con materiales activos en el estado de descarga. Las baterías recargables se (re) cargan aplicando corriente eléctrica, que revierte las reacciones químicas que ocurren durante la descarga / uso. Los dispositivos para suministrar la corriente apropiada se llaman cargadores.
La forma más antigua de batería recargable es la batería de plomo-ácido , que se usa ampliamente en aplicaciones automotrices y de navegación . Esta tecnología contiene electrolito líquido en un recipiente sin sellar, lo que requiere que la batería se mantenga vertical y que el área esté bien ventilada para garantizar una dispersión segura del gas de hidrógeno que produce durante la sobrecarga. La batería de plomo-ácido es relativamente pesada por la cantidad de energía eléctrica que puede suministrar. Su bajo costo de fabricación y sus altos niveles de corriente de sobretensión hacen que sea común que su capacidad (más de aproximadamente 10 Ah) sea más importante que el peso y los problemas de manejo. Una aplicación común es la moderna batería de automóvil., que puede, en general, entregar una corriente máxima de 450 amperios .
La batería de plomo-ácido regulada con válvula sellada ( batería VRLA) es popular en la industria automotriz como un reemplazo para la celda húmeda de plomo-ácido. La batería VRLA utiliza un electrolito de ácido sulfúrico inmovilizado , lo que reduce la posibilidad de fugas y prolonga la vida útil . [28] Las baterías VRLA inmovilizan el electrolito. Los dos tipos son:
- Las baterías de gel (o "célula de gel") utilizan un electrolito semisólido.
- Las baterías Absorbed Glass Mat (AGM) absorben el electrolito en una malla especial de fibra de vidrio.
Otras baterías recargables portátiles incluyen varios tipos de "celdas secas" selladas, que son útiles en aplicaciones como teléfonos móviles y computadoras portátiles . Las celdas de este tipo (en orden de aumento de la densidad de potencia y el costo) incluyen níquel-cadmio (NiCd), níquel-zinc (NiZn), hidruro de níquel-metal(NiMH) y celdas de iones de litio (Li-ion). El ion de litio tiene, con mucho, la mayor parte del mercado recargable de células secas. NiMH ha reemplazado a NiCd en la mayoría de las aplicaciones debido a su mayor capacidad, pero NiCd sigue en uso en herramientas eléctricas , radios de dos vías y equipos médicos .
En la década de 2000, los desarrollos incluyen baterías con componentes electrónicos integrados, como USBCELL , que permite cargar una batería AA a través de un conector USB , [29] baterías de nanoball que permiten una tasa de descarga aproximadamente 100x mayor que las baterías actuales, y paquetes de baterías inteligentes con estado Monitores de carga y circuitos de protección de la batería que evitan daños en la descarga excesiva. La baja autodescarga (LSD) permite que las celdas secundarias se carguen antes del envío.
Tipos de celulas
Se han producido muchos tipos de celdas electroquímicas, con procesos y diseños químicos variables, que incluyen celdas galvánicas , celdas electrolíticas , celdas de combustible , celdas de flujo y pilas voltaicas. [30]
Celda mojada
Una batería de celda húmeda tiene un electrolito líquido . Otros nombres son celda inundada , ya que el líquido cubre todas las partes internas, o celda ventilada , ya que los gases producidos durante la operación pueden escapar al aire. Las células húmedas fueron un precursor de las células secas y se usan comúnmente como una herramienta de aprendizaje para la electroquímica . Se pueden construir con suministros de laboratorio comunes, como vasos de precipitados , para demostrar cómo funcionan las células electroquímicas. Un tipo particular de celda húmeda conocida como celda de concentración es importante para comprender la corrosión . Las células húmedas pueden ser células primarias (no recargables) o células secundarias(recargable). Originalmente, todas las baterías primarias prácticas, como la celda Daniell, se construyeron como celdas húmedas de vidrio de tapa abierta. Otras células húmedas primarios son la celda Leclanché , célula Grove , célula Bunsen , célula de ácido crómico , de células Clark , y de células Weston . La química celular de Leclanche se adaptó a las primeras células secas. Las celdas húmedas todavía se usan en baterías de automóviles y en la industria para energía de reserva para equipos de conmutación , telecomunicaciones o grandes fuentes de alimentación ininterrumpida , pero en muchos lugares baterías con celdas de gelSe han utilizado en su lugar. Estas aplicaciones comúnmente utilizan células de plomo-ácido o níquel-cadmio .
Pila seca
Una celda seca utiliza un electrolito en pasta, con solo la humedad suficiente para permitir que la corriente fluya. A diferencia de una celda húmeda, una celda seca puede operar en cualquier orientación sin derramarse, ya que no contiene líquido libre, lo que la hace adecuada para equipos portátiles. En comparación, las primeras celdas húmedas eran típicamente recipientes de vidrio frágiles con varillas de plomo colgando de la parte superior abierta y necesitaban un manejo cuidadoso para evitar derrames. Las baterías de plomo-ácido no lograron la seguridad y la portabilidad de la celda seca hasta el desarrollo de la batería de gel .
Una celda seca común es la batería de zinc-carbono , a veces llamada la celdaseca de Leclanché , con un voltaje nominal de 1.5 voltios , igual que la batería alcalina (ya que ambas usan la misma combinación de zinc y dióxido de manganeso ). Una célula seca estándar comprende un ánodo de zinc , generalmente en forma de una olla cilíndrica, con un cátodo de carbono en forma de barra central. El electrolito es cloruro de amonio en forma de pasta al lado del ánodo de zinc. El espacio restante entre el electrolito y el cátodo de carbono es ocupado por una segunda pasta que consiste en cloruro de amonio y dióxido de manganeso, este último actúa como undespolarizador . En algunos diseños, el cloruro de amonio es reemplazado por cloruro de zinc .
Sal fundida
Las baterías de sal fundida son baterías primarias o secundarias que usan una sal fundida como electrolito. Funcionan a altas temperaturas y deben estar bien aisladas para retener el calor.
reserva
Una batería de reserva puede almacenarse desmontada (desactivada y sin suministro de energía) durante un período prolongado (quizás años). Cuando se necesita la batería, se ensambla (por ejemplo, agregando electrolito); Una vez ensamblada, la batería está cargada y lista para funcionar. Por ejemplo, una batería para un fusil de artillería electrónica podría activarse por el impacto de disparar un arma. La aceleración rompe una cápsula de electrolito que activa la batería y alimenta los circuitos del fusible. Las baterías de reserva generalmente están diseñadas para una vida útil corta (segundos o minutos) después de un almacenamiento prolongado (años). Una batería activada por agua para instrumentos oceanográficos o aplicaciones militares se activa al sumergirse en agua.



![{\ displaystyle {\ mathcal {L}} = \ sum _ {k = 1} ^ {n} C_ {k} (I_ {k}) + \ pi \ left [L (I_ {1}, I_ {2} , \ dots, I_ {n-1}) - \ sum _ {k = 1} ^ {n} I_ {k} \ right] + \ sum _ {l = 1} ^ {m} \ mu _ {l} \ left [F_ {l} ^ {max} -F_ {l} (I_ {1}, I_ {2}, \ dots, I_ {n-1}) \ right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a61b0798363b176fbb66560afbeedc767089654b)



![{\ displaystyle \ mu _ {l} \ cdot \ left [F_ {l} ^ {max} -F_ {l} (I_ {1}, I_ {2}, \ dots, I_ {n-1}) \ right ] = 0 \ quad \ mu _ {l} \ geq 0 \ quad k = 1, \ dots, n}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7177da319002628918a4222112b2a626b3083d0)










No hay comentarios:
Publicar un comentario