La estructura química de una sustancia química aporta información sobre el modo en que se enlazan los diferentes átomoso iones que forman una molécula, o agregado atómico. Incluye la geometría molecular, la configuración electrónica y, en su caso, la estructura cristalina .
La geometría molecular se refiere a la ordenación espacial de los átomos en una molécula (incluyendo distancias de enlacey ángulos de enlace) y los enlaces químicos que mantienen unidos a los átomos. La geometría molecular debe explicar la forma de las moléculas más simples como las de oxígeno o nitrógeno diatómicos, hasta las más complejas, como una molécula de proteína o de ADN. Con este término también podemos referirnos a estructuras donde no existen moléculas propiamente dichas. Los compuestos iónicos o covalentes no forman moléculas sino redes tridimensionales, enormes agregados de átomos o iones, con una estructura regular, simétrica y periódica.
Una vez conocida o supuesta la estructura química de una molécula es posible representarla mediante modelos como el modelo de barras y esferas o el modelo de espacio lleno.
| Molécula | Red atómica | Red iónica | Red metálica |
|---|---|---|---|
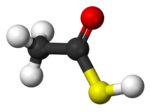 | 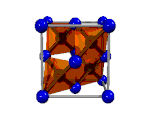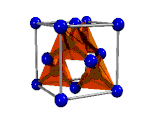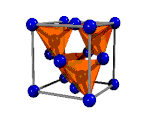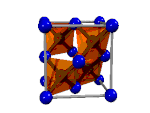 | 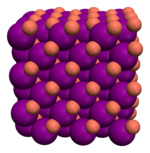 | 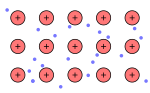 |
| Ácido tioacético, CH3-COSH | Diamante, Cn | Yoduro de cobre (I), CuI2 | Metal |
| Enlace covalente molecular | Enlace covalente reticular | Enlace iónico | Enlace metálico |

Estructura de la molécula de ácido nítrico, mostrando ángulos y enlaces.
Geometría de moléculas covalentes
La ordenación espacial de los átomos en una determinada molécula es aquella que permite la formación de los enlaces entre dichos átomos con la menor repulsión posible entre sus nubes electrónicas, que tienden a alejarse lo más posible unas de otras. La teoría de repulsión de pares de electrones de la capa de valencia (Teoría RPECV) da una predicción aproximada de la forma o estructura de muchas moléculas simples a partir de los pares de electrones (PE) compartidos y no compartidos de cada átomo central.
La geometría molecular de un compuesto químico puede representarse de modo aproximado mediante su fórmula estructural, usando modelos 2D y 3D.
La configuración electrónica describe la distribución de los electrones de un átomo entre los distintos niveles y subniveles de energía asícomo la ocupación de los orbitales moleculares de un compuesto.
Geometría y estructura de moléculas sencillas
La teoría RPECV da una buena aproximación de la forma y estructura de muchas moléculas, que se complementa con otras aportaciones como la teoría de la hibridación o teoría de orbitales híbridos (OH).
En la tabla inferior aparecen varias moléculas sencillas, con algunas de las formas más comunes.
| Molécula lineal | Molécula angular | Molécula plana | Molécula piramidal | Molécula tetraédrica |
|---|---|---|---|---|
 | 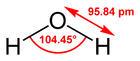 |  | 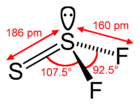 | |
| Molécula de sulfuro de carbonilo, S=C=O | Molécula de agua, H2O | Molécula de trifluoruro de boro, BF3, mostrando modos de vibración | Molécula de tiotionilo, S2F2 | Molécula de tetrafluoruro de silicio, SiF4 |
| Dos dobles enlaces | 4 PE | 3 PE | 4 PE | 4 PE |
Obviamente, cuando aumenta el número de átomos de la molécula, aumenta la complejidad de su estructura y la dificultad de su determinación. Algunas moléculas cuyas estructuras fueron difíciles de determinar son las siguientes.
| Benceno | Hélices α (proteínas) | ADN | Hemoglobina |
|---|---|---|---|
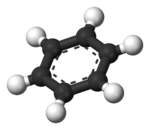 |  | 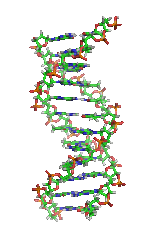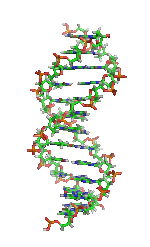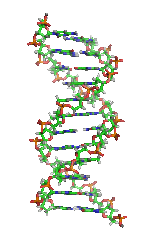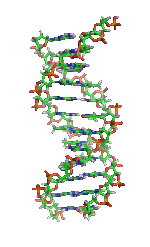 | 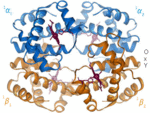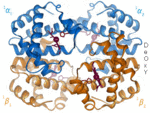 |
| Kekulé (1865) | Pauling y Corey (1951) | Watson y Crick (1953) | Max F. Perutz (1960) |
Determinación de la estructura
La determinación estructural en química es el proceso de determinar la estructura química de una sustancia química. Prácticamente, el resultado final de tal proceso es la obtención de las coordenadas de los átomos en la molécula, las distancias entre ellos y los ángulos entre sus enlaces.1 Los métodos por los que se puede determinar la estructura de una molécula son muy variados: existen diversos métodos de espectroscopia, tales como la resonancia magnética nuclear (RMN), espectroscopia infrarrojay espectroscopia Raman, microscopía electrónica, y cristalografía de rayos X (difracción de rayos X). Esta última técnica puede producir modelos 3D con resolución atómica, siempre que la sustancia está en forma de cristales, pues la difracción de rayos X necesita numerosas copias de la molécula que está siendo analizada que debe estar, por tanto, dispuesta de una manera organizada, como en el estado cristalino.1
Los métodos siguientes son habituales para determinar la estructura química:
- Difracción de rayos X
- RMN de protones
- RMN de Carbono
- Espectrometría de masas
- Espectroscopía infrarroja
Los métodos siguientes son habituales para determinar la estructura electrónica:
- Resonancia paramagnética electrónica
- Voltametría cíclica
- Espectroscopía de absorción de electrones
- Espectroscopía de fotoelectrones emitidos por rayos X
propiedades funcionales, recibe el nombre de función química. Cuando un determinado compuesto posee características como acidez o basicidad, solubilidad en agua, reactividadde acuerdo con determinada función química, se dice que este pertenece a esta función química. Las funciones químicas son divididas de acuerdo con la división clásica de la química.
Existen cuatro tipos de función inorgánica: óxido, ácido, base y sal. El criterio de clasificación de una sustancia en una de esas funciones es el tipo de iones que se forman cuando ella es disuelta en agua.
En función de la naturaleza inexistente de los compuestos químicos, las funciones pueden primariamente ser divididas entre funciones inorgánicas que son las funciones de compuestos que no poseen cadena carbonada, que es la principal característica de esos compuestos. Están divididas en ácidos, bases, sales y óxidos y funciones orgánicas que son las relativas a los compuestos orgánicos.
Óxidos
Los Óxidos son compuestos binarios en que el elemento oxígeno presenta número de oxidación igual a -2 y es el más electronegativo de la fórmula, volviéndolo al elemento más potente.
Clasificación de los óxidos
| clasificación | formadores | ejemplos |
|---|---|---|
| básicos | metales con nox +1 o +2 y del grupo 1A e 2A | CaO, FeO, K2O |
| ácidos o anídridos | metales con nox +5, +6 e +7 y ametais con cualquier nox, excepto C+2, N+1 y N+2 | SO3, Cl2O, Mn2O7 |
| neutros | C+2, N+1 e N+2 | NO, CO, N2O |
| anfóteros | Los más comunes están formados por los metales RaI, Da, BuN, Da, BrA, BReMBA | Al2O3, MnO2, ZnO, PbO, SnO |
| salinos, mixtos o dobles | metales con nox medio +8/3 | Pb3O4, Fe3O3 |
Obs: los óxidos anfóteros se comportan como óxidos básicos en presencia de ácidos y como óxidos ácidos en presencia de bases.
Obs2: los óxidos mixtos son la "suma" de los óxidos formados por un elemento, o sea, es una nube con todos los tipos de óxidos de ese elemento:
- FeO + Fe2O3 → Fe3O4
La lampara de brayan # Asi son
a) para cualquier óxido'
Ejemplo:
Ácidos
Según Arrhenius, ácido es toda la sustancia que libera un ion H+ en agua, o, más detalladamente sustancias que en medio acuoso se disocian, liberando el catión es un anión diferente de . La teoría actual de Brønsted-Lowry define como ácido una sustancia capaz de recibir un par de electrones. Además, la teoría de Arrhenius también fue actualizada:
- ácido es toda sustancia que libera un ion H3O+
Clasificación de los ácidos
a) de acuerdo con la presencia de oxígeno
b) de acuerdo con el grado de disociación iónica
Obs: el cálculo de α en los ácidos es igual al desenvuelto en las bases.
- α (en porcentaje) = 100 x número de moléculas disociadas/número total de moléculas disueltas
-
- α > 50% → fuerte
- α < 5% → débil
- Hidrácidos:
- Fuertes: HCl < HBr < HI
- Medios: HF (puede ser considerado débil)
- Débiles: los demás
- x = número de oxígeno - número de hidrógeno
Nomenclatura de los ácidos
a) Hidrácidos
- ácido + elemento + hídrico
Ejemplos:
- = ácido yodhídrico
- = ácido clorhídrico
- = ácido sulfhídrico
b) Oxácidos
Como pueden ser obtenidos a través de la hidratación de los óxidos ácidos, hay la misma sistemática de nomenclatura.
- ácido + prefijo + elemento + sufijo
| nox | prefijo | sufijo |
|---|---|---|
| +1 o +2 | hipo | oso |
| +3 o +4 | - | oso |
| +5 o +6 | - | ico |
| +7 | (hi)per | ico |
Obs: cuanto menos oxígeno, menor es el nox del elemento central y cuanto más oxígeno, mayor es el nox del mismo, como muestran los ejemplos abajo.
Ejemplos:
- = ácido hipocloroso (nox Cl = +1)
- = ácido cloroso (nox Cl = +3)
- = ácido clórico (nox Cl = +5)
- = ácido perclórico (nox Cl = +7)
Bases
Bases son, según Arrhenius, compuestos que en medio acuoso se disocian, liberando como anión y un catión diferente de . La teoría actual de Lewis define como base una sustancia capaz de donar un par de electrones.
Clasificación de las bases
a) de acuerdo con el grado de disociación
Es el mismo cálculo usado en los ácidos
- Fuertes: α = 100% → bases formadas por metales de los grupos 1A y 2A. Cuando el Grado de Ionización es prácticamente 100%. Es el caso de los hidróxidos de los metales alcalinos y de los metales alcalinos terrosos, que ya son iónicos por naturaleza.
- Débiles: α < 5% → cuyo Grado de Ionización es, en general, inferior a 5%. Es el caso del hidróxido de amonio y de los hidróxidos de los metales en general excluidos los metales alcalinos y alcalinos terrosos; que son moleculares por su propia naturaleza
Nomenclatura de las bases
a) cuando el catión posee nox fijo
- hidróxido de + catión
Ejemplo:
- = Hidróxido de Potasio
b) cuando el catión no presenta nox fijo
- hidróxido de + catión + sufijo O hidróxido + catión + nox en algarismo romano
Ejemplos:
- = hidróxido de hierro II o hidróxido ferroso
- = hidróxido de hierro III o hidróxido férrico
Sales
Las sales son compuestos que en medio acuoso se disocian, liberando por lo menos un catión diferente de y por lo menos un anión diferente de . Son definidos, muy limitadamente, como compuestos binarios resultantes de la reacción de un ácido y una base.
Obs: Cuando están disueltos en agua, sus iones disociados adquieren movilidad y se vuelven conductores de electricidad.
Clasificación de las sales
a) de acuerdo con la presencia de oxígeno
- Sales haloides: no poseen oxígeno
- Ejemplos: ,
- Oxisales: poseen oxígeno
- Ejemplos: ,
b) de acuerdo con la presencia de H+ u OH-
- Sal normal: está formado por la neutralización completa entre un ácido y una base. No posee ni H+ ni OH-
- Ejemplo:
- Hidrogenosal o hidroxisal: está formado en una reacción de neutralización cuando el ácido y la base no están en proporción estequiométrica. Siendo así, hay una neutralización parcial, sobrando H+ u OH-
- Ejemplo (hidrogenosal):
- Ejemplo (hidroxisal):
- Sal mixta: la sal presenta en su fórmula más de un catión o más de un anión diferentes. Está formado a partir de neutralización de un ácido por más de una base o de una base por más de un ácido.
- Ejemplo:
Nomenclatura de las sales
a) para sales haloides
- metal + uro de catión
Ejemplo:
b) para oxisales
Usamos una extensión de la tabla de óxidos ácidos y oxiácidos, pues la nomenclatura de los oxisales también depende del nox.
| - | - | óxidos ácidos y oxiácidos | oxisales |
|---|---|---|---|
| nox | prefijo | sufijo | sufijo |
| +1 o +2 | hipo | oso | ito |
| +3 o +4 | - | oso | ito |
| +5 o +6 | - | ico | ato |
| +7 | (hi)per | ico | ato |
Excepciones: Como los elementos B+3, C+4 y Si+4 solo poseen sufijo "ico" en la forma de ácido, cuando son sales, se usa siempre el sufijo "ato".
Ejemplos:
- (nox N = +3) = nitrito de potasio
- (nox Cl = +1) = hipoclorito de sodio
- (nox Mn = +7) = permanganato de potasio
Obs: cuando en la fórmula del sal hay un hidrógeno, agregamos el prefijo "bi" al nombre del catión.
 =
=  es un
es un  . La teoría actual de
. La teoría actual de  = ácido yodhídrico
= ácido yodhídrico = ácido clorhídrico
= ácido clorhídrico = ácido sulfhídrico
= ácido sulfhídrico = ácido hipocloroso (nox Cl = +1)
= ácido hipocloroso (nox Cl = +1) = ácido cloroso (nox Cl = +3)
= ácido cloroso (nox Cl = +3) = ácido clórico (nox Cl = +5)
= ácido clórico (nox Cl = +5) = ácido perclórico (nox Cl = +7)
= ácido perclórico (nox Cl = +7) = Hidróxido de Potasio
= Hidróxido de Potasio = hidróxido de hierro II o hidróxido ferroso
= hidróxido de hierro II o hidróxido ferroso = hidróxido de hierro III o hidróxido férrico
= hidróxido de hierro III o hidróxido férrico ,
, 
 ,
, 




 =
=  (nox N = +3) =
(nox N = +3) =  (nox Cl = +1) =
(nox Cl = +1) =  (nox Mn = +7) =
(nox Mn = +7) =  =
=
No hay comentarios:
Publicar un comentario