El " perro ladrador " es una reacción química exotérmica que resulta de la ignición de una mezcla de disulfuro de carbono y óxido nitroso . [1]Cuando se enciende en un tubo cilíndrico, la reacción produce un destello brillante y un fuerte "guau", que recuerda a un perro ladrando.
En términos simples, la reacción del 'Perro ladrador' es un proceso de combustión , en el cual un combustible (disulfuro de carbono, CS 2 ) reacciona con un agente oxidante (óxido nitroso, N 2 O), produciendo calor y azufre elemental . El frente de la llama en la reacción es una zona de gas muy caliente y luminoso , producida por la descomposición de los reactivos.
- 8 N 2 O + 4 CS 2 → S 8 + 4 CO 2 + 8 N 2
En abril de 1853, Justus von Liebig realizó la manifestación frente a la familia real bávara; sin embargo, el recipiente de vidrio se hizo añicos y fragmentos de vidrio causaron heridas leves en los rostros de la reina Teresa, su hijo, el príncipe Luitpold , y el propio Liebig.
La síntesis de péptidos de azlactona de Bergmann es un proceso clásico de síntesis orgánica para la preparación de dipéptidos .
- ( 1 )
Bailey puede ver esta reacción con más detalle. [3]
El péptido resultante se protege luego con ésteres de bencilcloroformiato para mantener intactos los grupos amino ( 2 ). [4]
- ( 2 )
Este mecanismo sirve como fuente de protección para el grupo amino en el aminoácido. El éster bloqueará la unión del grupo amino con otras moléculas.
El último paso en esta reacción es la ciclación de los N- haloacilaminoácidos con un acetanhidruro . Esto dará como resultado la azlactona esperada ( 3 ). [5]
- ( 3 )
La reacción con un segundo aminoácido permite que el anillo se abra, luego forma un dipéptido insaturado acilado.
La reacción ocurre en una función gradual que permite proteger el grupo amino y producir la azlactona.
- La eliminación de β-carbono es un tipo de reacción en la química organometálica en la que un ligando de alilounido a un centro metálico se rompe en el correspondiente ligando de alquilo (arilo) unido a metal y un alqueno . [1] Es un subgrupo de reacciones de eliminación. Aunque es menos común y menos entendido que la eliminación del hidruro β , es un paso importante involucrado en algunos procesos de polimerización de olefinas y reacciones orgánicas catalizadas por metales de transición.
Descripción general [ editar ]
Al igual que la eliminación de β-hidruro, la eliminación de β-carbono requiere que el metal tenga un sitio de coordinación abierto cis para el grupo alquilo para que ocurra esta reacción. La eliminación de β-carbono generalmente es menos favorecida que la eliminación de hidruro porque el enlace metal-hidruro es más fuerte que el enlace metal-carbono para la mayoría de los metales en reacciones catalíticas . Los principios que rigen la eliminación de β-alquilo no están bien establecidos experimentalmente. Una razón para esto es que romper los enlaces C − C en presencia de otros enlaces C − H reactivos es un evento raro, y los sistemas diseñados para interrogar la reacción son más difíciles de idear. [2]Eliminación de β-alquilo [ editar ]
La eliminación de β-alquilo es el tipo más común y útil entre todas las reacciones de eliminación de β-carbono.Clasificación / Fuerza motriz [ editar ]
Eliminación de β-alquilo con complejos de metales de transición temprana [ editar ]
En términos de termodinámica , más centros de metales con deficiencia de electrones aumentan la probabilidad de eliminación de β-alquilo. Por ejemplo, la eliminación de β-alquilo es más favorable que la eliminación de β-hidruro cuando está unida a metales de transición temprana deficientes en electrones (Hf, Ti, Zr, Nb, etc.) con configuración d 0 . Los estudios computacionales muestran una preferencia termodinámica por la eliminación de β-Me sobre la eliminación de β-H en estos complejos debido a la estabilidad adicional para las especies de metal-alquilo. [3] El origen de la interacción de unión adicional proviene de un orbital centrado en el CH 3débilmente donando π al LUMO del d 0 del centro de metal que es análogo alefecto de hiperconjugación (ver figura a la derecha), aumentando así la estabilidad de M − CH 3 sobre las especies M − H. Sus cálculos predicen que un ion metálico más electrófilo mejora la donación de −CH 3 π, lo que en consecuencia aumenta la estabilidad de M − CH 3 sobre las especies de M − H. Por el contrario, un ion metálico más rico en electrones favorecerá la formación de M-H (por ejemplo, utilizando el ligando Cp * más donador de electrones en Cp * 2 MX 2 ).En términos de cinética , los efectos estéricos de los ligandos podrían desempeñar un papel en el aumento de la barrera energética de la eliminación de β-H en relación con la eliminación de β-alquilo, específicamente cuando el ligando es Cp *. Se propuso un modelo para ilustrar este efecto: [4] Tanto en la eliminación de β-metilo (A) como en la eliminación de β-hidruro (B), el grupo de transferencia se alinea perpendicularmente a Cp * (centroide) −Zr − Cp * (centroide) , permitiendo que σ C − C o σ C − Henlace para superponerse con el metal d-orbital. Sin embargo, para lograr la geometría de prerrequisito para la eliminación de β-H (B), el grupo metilo adyacente experimenta una repulsión estérica significativa del ligando Cp *, elevando así la barrera para la transferencia de hidruro. Por el contrario, el estado de transición A para la eliminación de β-Me experimenta menos interacción estérica con el ligando Cp *.Eliminación de β-alquilo con complejos de metales de transición media y tardía [ editar ]
En los complejos de metales de transición medios y tardíos, existe una preferencia termodinámica mayor para la eliminación de β-H sobre la eliminación de β-alquilo, donde la diferencia es generalmente> 15 kcal / mol. [2] Losejemplos involucrados complejos de metales de transición media y tardía están ausentes de β-hidrógenos o usan alivio de tensión del anillo y aromaticidad como fuerzas impulsoras para favorecer la eliminación de β-alquilo sobre la eliminación de β-hidruro. [5]Aplicaciones [ editar ]
Polimerización de apertura de anillo (ROP) [ editar ]
La polimerización de apertura de anillo que implica la eliminación de β-alquilo puede ser catalizada por Ti [6] , Zr [7] [8] , catalizador basado en Pd [9] y algunos catalizadores de metaloceno basados en lantánidos [10] [11] , donde diferentes patrones de polimerización varían cuando los catalizadores son diferentes. También se informaron ejemplos de copolimerización con alqueno [10] o monóxido de carbono [12] [13] . El paso clave de este tipo de ROP es la eliminación de β-alquilo impulsado por cadenas, que proporciona un polímero lineal con insaturación en la cadena del polímero.Síntesis orgánica [ editar ]
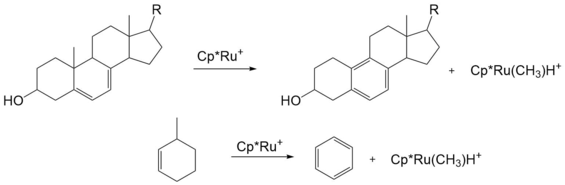
Hay una enorme cantidad de procesos catalíticos que implican la eliminación de β-alquilo que son sintéticamente útiles. Sin embargo, la eliminación de β-alquilo en este caso a menudo se considera como una forma alternativa de escisión del enlace C – C, mientras que la adición oxidativa es la forma directa. [14] Uno de los ejemplos es la eliminación-alquilo β de terc alcoholatos que pueden generar de cualquiera de adición de un reactivo o ligando de intercambio organometálico. [15] [16] [17] Las especies organometálicas consecuentes pueden experimentar varias reactividades aguas abajo (eliminación reductiva, inserción de carbonilo, etc.) para generar bloques de construcción útiles.Además de la tensión del anillo, la eliminación de β-Me impulsada por la aromaticidad puede emplearse eficazmente para desalquilar derivados de esteroides y algunos otros compuestos de ciclohexilo. [18] [19]Eliminación de β-arilo [ editar ]
La eliminación de β-arilo es mucho menos común y se entiende que la eliminación de β-alquilo. Se informa que se producen ejemplos de complejos de alcóxido de metal y amido. [20] [21] [22] Un estudio teórico demostró que estas reacciones son impulsadas por el consiguiente sistema de conjugación extensa. [23] Un ejemplo muy reciente de eliminación β-arilo catalítica que conduce a la síntesis enantioselectiva de biarilo atropisómeros es impulsada por la liberación de cadena anillo distorsionada.- química bioortogonal se refiere a cualquier reacción química que pueda ocurrir dentro de los sistemas vivos sin interferir con los procesos bioquímicos nativos. [1] [2] [3] El término fue acuñado por Carolyn R. Bertozzi en 2003. [4] Desde su introducción, el concepto de la reacción bioortogonal ha permitido el estudio de biomoléculas como glucanos , proteínas , [5] y lípidos [6]en tiempo real en sistemas vivos sin toxicidad celular. Se han desarrollado una serie de estrategias de ligadura química que cumplen los requisitos de bioortogonalidad, incluida la cicloadición 1,3-dipolar entre azidas y ciclooctinos (también denominada química de clics sin cobre ), [7] entre nitrones y ciclooctinos, [8] oxima / formación de hidrazona a partir de aldehídos y cetonas , [9] la ligadura de tetrazina , [10] la reacción de clic basada en isocianuro , [11]y más recientemente, la ligadura de cuadriciclano. [12]El uso de la química bioortogonal generalmente se realiza en dos pasos. Primero, un sustrato celular se modifica con un grupo funcional bioortogonal (indicador químico) y se introduce en la célula; los sustratos incluyen metabolitos, inhibidores enzimáticos, etc. El indicador químico no debe alterar drásticamente la estructura del sustrato para evitar afectar su bioactividad. En segundo lugar, se introduce una sonda que contiene el grupo funcional complementario para reaccionar y marcar el sustrato.Aunque se han desarrollado reacciones bioortogonales efectivas como la química de clics sin cobre, el desarrollo de nuevas reacciones continúa generando métodos ortogonales para el etiquetado para permitir que se usen múltiples métodos de etiquetado en los mismos biosistemas.
Mecanismo [ editar ]
 La reacción clásica de StaudingerLa fosfina nucleófila ataca a la azida en el nitrógeno terminal electrofílico. A través de un estado de transición de cuatro miembros, N 2 se pierde para formar un aza-ylide. El iluro inestable se hidroliza para formar óxido de fosfina y una amina primaria. Sin embargo, esta reacción no es inmediatamente bioortogonal porque la hidrólisis rompe el enlace covalente en el aza-iluro.La ligadura de StaudingerLa reacción se modificó para incluir un grupo éster orto al átomo de fósforo en uno de los anillos de arilo para dirigir el azailuro a través de una nueva ruta de reactividad para compensar la hidrólisis inmediata colocando el éster para aumentar la concentración local. El ataque nucleofílico inicial sobre la azida es el paso limitante de la velocidad. El iluro reacciona con la trampa de éster electrofílico a través de la ciclación intramolecular para formar un anillo de cinco miembros. Este anillo se somete a hidrólisis para formar un enlace amida estable .
La reacción clásica de StaudingerLa fosfina nucleófila ataca a la azida en el nitrógeno terminal electrofílico. A través de un estado de transición de cuatro miembros, N 2 se pierde para formar un aza-ylide. El iluro inestable se hidroliza para formar óxido de fosfina y una amina primaria. Sin embargo, esta reacción no es inmediatamente bioortogonal porque la hidrólisis rompe el enlace covalente en el aza-iluro.La ligadura de StaudingerLa reacción se modificó para incluir un grupo éster orto al átomo de fósforo en uno de los anillos de arilo para dirigir el azailuro a través de una nueva ruta de reactividad para compensar la hidrólisis inmediata colocando el éster para aumentar la concentración local. El ataque nucleofílico inicial sobre la azida es el paso limitante de la velocidad. El iluro reacciona con la trampa de éster electrofílico a través de la ciclación intramolecular para formar un anillo de cinco miembros. Este anillo se somete a hidrólisis para formar un enlace amida estable .Limitaciones [ editar ]
Los reactivos de fosfina se someten lentamente a la oxidación del aire en los sistemas vivos. Además, es probable que se metabolicen in vitro por las enzimas del citocromo P450 .La cinética de las reacciones es lenta con constantes de velocidad de segundo orden alrededor de 0.0020 M −1 • s −1 . Los intentos de aumentar las tasas de ataque nucleofílico al agregar grupos donadores de electrones a las fosfinas mejoraron la cinética, pero también aumentaron la tasa de oxidación del aire.La mala cinética requiere que se usen altas concentraciones de fosfina, lo que conduce a problemas con una alta señal de fondo en las aplicaciones de imágenes. Se han realizado intentos para combatir el problema de los antecedentes elevados mediante el desarrollo de reactivos de fosfina fluorogénicos basados en fluoresceína y luciferina , pero la cinética intrínseca sigue siendo una limitación.


![{\ displaystyle {\ begin {matrix} {} \\ {\ ce {{C6H5CH2OCOCl} + H2N {\ underset {| \ atop \ displaystyle R} {C}} HCOOR '-> [{\ ce {NaOH}} ^ {*}; \; 0-20 ^ {\ circ} {\ ce {C}}] [({\ ce {H2O}})] C6H5CH2OCOH {\ underset {| \ atop \ displaystyle R} {C}} HCOOR '}} \\ {} \\ * \ {\ ce {{CHCl} + (C2H5) 3N, {CH3COOC2H5} + MgO, {CHCl3} + {H2O} + Na2CO3 }} \ end {matriz}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ada9affefeba5fae8160af6094ac9f58d54701cc)


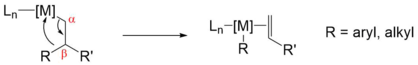


No hay comentarios:
Publicar un comentario