La cianiletilación es una reacción de adición nucleofílica . Se agrega una molécula de acrilonitrilo a un nucleófilo, por ejemplo un alcohol , tiol o una amina .
Debido a la estabilización mesomérica del acrilonitrilo y el grupo nitrilo que retira los electrones , el átomo de carbono β (el átomo de carbono más alejado del grupo nitrilo) está polarizado positivamente y, por lo tanto, actúa como un aceptor de Michael . Esto conduce a un acercamiento del nucleófilo al átomo de carbono β, que inicia la reacción. La reacción se termina mediante la absorción de un protón del disolvente por el producto intermedio . En aplicaciones industriales, la reacción normalmente es catalizada por una base que polariza o (negativamente) carga el nucleófilo y por lo tanto acelera la reacción. [1]
La cianiletilación se usa especialmente en el sector farmacéutico y colorante industrial, ya que esta reacción extiende la molécula portadora de nucleófilos en tres átomos de carbono más el enlace -C≡N que luego se puede eliminar o modificar mediante (por ejemplo) reducción. La cianetilación también se usa en la polimerización técnica. Si la cianilación se lleva a cabo en un medio que no puede liberar un protón al producto al final de la reacción, se produce una polimerización aniónica . Debido a la falta de protonación, el átomo de carbono α permanece cargado negativamente, lo que hace que los productos de cianilación individuales se polimericen.
cicloadición es una reacción química , en la que "dos o más moléculas insaturadas (o partes de la misma molécula) se combinan con la formación de un aducto cíclico en el que hay una reducción neta de la multiplicidad de enlaces". La reacción resultante es una reacción de ciclación . Muchas, pero no todas, las cicloadiciones son concertadas y, por lo tanto, pericíclicas . [1] Las cicloadiciones no concertadas no son pericíclicas. [2] Como una clase de reacción de adición , las cicloadiciones permiten la formación de enlaces carbono-carbono sin el uso de un nucleófilo o electrófilo .
Las cicloadiciones se pueden describir utilizando dos sistemas de notación. Una notación más antigua pero común se basa en el tamaño de los arreglos lineales de los átomos en los reactivos. Utiliza paréntesis : ( i + j + ...) donde las variables son los números de átomos lineales en cada reactivo. El producto es un ciclo de tamaño ( i + j + ...). En este sistema, la reacción estándar de Diels-Alder es una cicloadición (4 + 2), la cicloadición 1,3-dipolar es una cicloadición (3 + 2) y ciclopropanación de un carbeno con un alqueno a (2 + 1) -cicloadición. [1]
Una notación más reciente, preferida por IUPAC, introducida por primera vez por Woodward y Hoffmann , usa corchetes para indicar el número de electrones , en lugar de átomos de carbono, involucrados en la formación del producto. En la notación [ i + j + ...], la reacción estándar de Diels-Alder es una cicloadición [4 + 2], mientras que la cicloadición 1,3-dipolar es también una cicloadición [4 + 2].
Cicloadiciones térmicas y su estereoquímica [ editar ]
Las cicloadiciones térmicas son aquellas cicloadiciones en las que los reactivos están en el estado electrónico fundamental. Usualmente tienen (4 n + 2) electrones π que participan en el material de partida, para algún número entero n. Estas reacciones ocurren por razones de simetría orbital de una manera suprafacial - suprafacial o antarafacial -antarafacial (poco frecuente). Hay algunos ejemplos de cicloadiciones térmicas que tienen 4 n π electrones (por ejemplo, la cicloadición [2 + 2]). Estos proceden en un sentido suprafacial-antarafacial, como la dimerización del queteno , en el que el conjunto ortogonal de orbitales p permite que la reacción proceda a través de un cruceestado de transición .
Cicloadiciones fotoquímicas y su estereoquímica [ editar ]
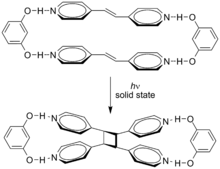
Las cicloadiciones en las que participan 4n π electrones también pueden ocurrir mediante activación fotoquímica. Aquí, un componente tiene un electrón promovido del HOMO (enlace π) al LUMO (π * antibonding ). La simetría orbital es entonces tal que la reacción puede proceder de una manera suprafacial-suprafacial. Un ejemplo es la reacción de DeMayo . A continuación se muestra otro ejemplo, la dimerización fotoquímica del ácido cinámico . [3] Los dos alquenos trans reaccionan de la cabeza a la cola, y los isómeros aislados se llaman ácidos truxílicos .
Los efectos supramoleculares pueden influir en estas cicloadiciones. La cicloadición de trans -1,2-bis (4-piridil) eteno está dirigida por resorcinolen estado sólido con un rendimiento del 100% . [4]
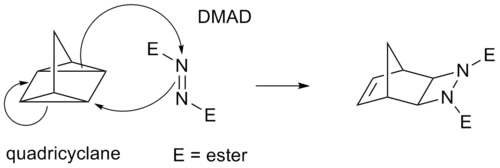
Algunas cicloadiciones en lugar de enlaces π operan a través de anillos de ciclopropano tensos , ya que tienen un carácter π significativo. Por ejemplo, un análogo para la reacción de Diels-Alder es la reacción de cuadriciclano - DMAD :
En la notación de cicloadición (i + j + ...) i y j se refieren al número de átomos involucrados en la cicloadición. En esta notación, una reacción de Diels-Alder es una cicloadición (4 + 2) y una adición 1,3-dipolar como el primer paso en la ozonólisis es una cicloadición (3 + 2). La IUPAC sin embargo notación preferido, con [i + j + ...] toma electrones en cuenta y no átomos. En esta notación, la reacción DA y la reacción dipolar se convierten en una cicloadición [4 + 2]. La reacción entre el norbornadieno y un alquino activado es una cicloadición [2 + 2 + 2].
Tipos de cicloadición [ editar ]
Reacciones de Diels-Alder [ editar ]
La reacción de Diels-Alder es quizás la reacción de cicloadición más importante y comúnmente enseñada. Formalmente es una reacción de cicloadición [4 + 2] y existe en una gran variedad de formas, incluyendo la reacción inversa de Diels-Alder de demanda electrónica , la reacción de Hexadehydro Diels-Alder y la trimerización de alquino relacionada . La reacción también se puede ejecutar a la inversa en la reacción retro-Diels-Alder .
Se conocen reacciones que involucran heteroátomos; incluyendo la reacción de aza-Diels – Alder e Imine Diels – Alder .
Cicloadiciones Huisgen [ editar ]
Cicloadición de nitrone-olefina [ editar ]
Cicloadición de olefinas 2 + 2 catalizadas con hierro [ editar ]
Los catalizadores de hierro [piridina (diimina)] contienen un ligando activo redox en el que el átomo central de hierro puede coordinarse con dos enlaces dobles de olefina simples y no funcionalizados. El catalizador se puede escribir como una resonancia entre una estructura que contiene electrones no apareados con el átomo central de hierro en el estado de oxidación II, y uno en el que el hierro está en el estado de oxidación 0. Esto le da la flexibilidad de participar en la unión de los dobles enlaces a medida que experimentan una reacción de ciclación, generando una estructura de ciclobutano a través de la eliminación reductora CC; alternativamente, se puede producir una estructura de ciclobuteno por eliminación de beta-hidrógeno. La eficiencia de la reacción varía sustancialmente dependiendo de los alquenos utilizados, pero el diseño racional del ligando puede permitir la expansión del rango de reacciones que pueden catalizarse. [5] [6]
Reacciones queletrópicas [ editar ]
Las reacciones queletrópicas son una subclase de cicloadiciones. La característica distintiva clave de las reacciones queletrópicas es que en uno de los reactivos, ambos nuevos enlaces se están formando en el mismo átomo. El ejemplo clásico es la reacción del dióxido de azufre con un dieno .
Otro [ editar ]
Existen otras reacciones de cicloadición: [4 + 3] cycloadditions , [6 + 4] cycloadditions , [2 + 2] photocycloadditions y [4 + 4] photocycloadditions
Cicloadiciones formales [ editar ]
Las cicloadiciones a menudo tienen análogos radicales escalonados y catalizados por metales , sin embargo, estas no son estrictamente reacciones pericíclicas. Cuando en una cicloadición intervienen cargados o intermedios radicales o cuando el resultado de la cicloadición se obtiene en una serie de pasos de reacción, a veces se les llama cicloadiciones formales para hacer la distinción con las verdaderas cicloadiciones pericíclicas.
Un ejemplo de una cicloadición formal [3 + 3] entre una enona cíclica y una enamina catalizada por n- butil litio es una reacción en cascada de enamina / adición de 1,2 de Stork : [7]
La descarbonilación es un tipo de reacción orgánica que implica la pérdida de CO. A menudo es una reacción indeseable ya que representa una degradación. En la química de los carbonilos metálicos , la descarbonilación describe un proceso de sustitución, mediante el cual un ligando de CO se reemplaza por otro ligando.
Química orgánica [ editar ]
En ausencia de catalizadores metálicos, la descarbonilación (frente a la descarboxilación) rara vez se observa en la química orgánica. Una excepción es la descarbonilación del ácido fórmico :
- HCO 2 H → CO + H 2 O
La reacción es inducida por ácido sulfúrico , que funciona como catalizador y como agente deshidratante. A través de esta reacción, el ácido fórmico se emplea ocasionalmente como fuente de CO en el laboratorio en lugar de cilindros de este gas tóxico. [1] Con un fuerte calentamiento, el ácido fórmico y algunos de sus derivados pueden sufrir descarbonilación, incluso sin agregar un catalizador. Por ejemplo, la dimetilformamida se descompone lentamente para dar dimetilamina y monóxido de carbono cuando se calienta hasta su punto de ebullición (154 ° C). Algunos derivados del ácido fórmico, como el cloruro de formilo , sufren descarbonilación espontánea a temperatura ambiente (o inferior).
Las reacciones que involucran cloruro de oxalilo (COCl) 2 (p. Ej., Hidrólisis, reacción con ácidos carboxílicos, oxidación de Swern , etc.) a menudo liberan dióxido de carbono y monóxido de carbono a través de un proceso de fragmentación.
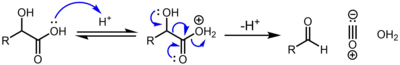
Los α-hidroxiácidos , por ejemplo ( ácido láctico y ácido glicólico ) sufren descarbonilación cuando se tratan con ácido sulfúrico concentrado catalíticamente, mediante el siguiente mecanismo: [2]
Los ácidos silacarboxílicos (R 3 SiCOOH) sufren descarbonilación tras el calentamiento o tratamiento con base y han sido investigados como moléculas generadoras de monóxido de carbono. [3] [4]
Descarbonilación de aldehído [ editar ]
Una transformación común implica la conversión de aldehídos a alcanos . [5] La reacción inversa, la carbonilación, implica la inserción de CO en un enlace, es una reacción común e industrialmente relevante.
- RCHO → RH + CO
Estas reacciones proceden por intermedio de hidruros de acilo metálicos . Un ejemplo de esto es la reacción de descarbonilación de Tsuji-Wilkinson usando el catalizador de Wilkinson . (Estrictamente hablando, la versión no catalítica de esta reacción da como resultado la formación de un complejo de carbonilo de rodio en lugar de monóxido de carbono libre). Esta reacción generalmente se lleva a cabo a pequeña escala en el curso de una síntesis total del producto natural complejo, porque aunque esta reacción es muy eficiente a temperaturas ligeramente elevadas (p. ej., 80 ° C) cuando se usa rodio estequiométrico, el recambio del catalizador por extrusión de CO requiere la disociación de un complejo de carbonilo de rodio muy estable y se requieren temperaturas superiores a 200 ° C.
Las descarbonilaciones son de interés en las conversiones de azúcares. [7] Las cetonas y otros grupos funcionales que contienen carbonilo son más resistentes a la descarbonilación que los aldehídos.
Bioquímica [ editar ]
El monóxido de carbono se libera en la degradación (catabolismo) del hemo por la acción de O2, NADPH y la enzima hemo oxigenasa : [8]
- Hem b + 3 O 2 + 3½NADPH + 3½H + → biliverdina + Fe 2+ + CO + 3½NADP + + 3H 2 O
Síntesis inorgánica y organometálica [ editar ]
Muchos carbonilos metálicos se preparan mediante reacciones de descarbonilación. El ligando de CO en el complejo de Vaska surge por la descarbonilación de DMF :
- IrCl 3 (H 2 O) 3 + 3 P (C 6 H 5 ) 3 + HCON (CH 3 ) 2 + C 6 H 5 NH 2 → IrCl (CO) [P (C 6 H 5 ) 3 ] 2 + [ (CH 3 ) 2NH 2 ] Cl + OP (C 6 H 5 ) 3 + [C 6 H 5 NH 3 ] Cl + 2 H 2 O
La conversión de Fe (CO) 5 y Mo (CO) 6 en sus muchos derivados a menudo implica la descarbonilación. Aquí la descarbonilación acompaña a la preparación del dímero de dicarbonilo ciclopentadieniliron :
- 2 Fe (CO) 5 + C 10 H 12 → ( η 5 -C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
La descarbonilación puede inducirse fotoquímicamente, así como usar reactivos como el trimetilamina-N-óxido :
- Me 3 NO + L + Fe (CO) 5 → Me 3 N + CO 2 + LFe (CO) 4





![Reacción de cicloadición formal intermolecular [3 + 3]](https://upload.wikimedia.org/wikipedia/commons/thumb/2/26/3%2B3-cycloaddition.svg/600px-3%2B3-cycloaddition.svg.png)

No hay comentarios:
Publicar un comentario