La sustitución asociativa describe una vía por la cual los compuestos intercambian ligandos . La terminología se aplica típicamente a la coordinación y complejos organometálicos , pero se asemeja al mecanismo Sn2 en química orgánica . La vía opuesta es la sustitución disociativa , que es análoga a la vía Sn1 . Existen vías intermedias entre las vías asociativas puras y disociativas puras, que se denominan mecanismos de intercambio. [1] [2]
Las vías asociativas se caracterizan por la unión del nucleófilo atacante para dar un intermedio discreto y detectable seguido de la pérdida de otro ligando. Los complejos que experimentan sustitución asociativa están insaturados de manera coordinada o contienen un ligando que puede cambiar su unión al metal, por ejemplo, cambio en la háptica o la flexión de un ligando de óxido de nitrógeno (NO). En la catálisis homogénea , la vía asociativa es deseable porque el evento de unión y, por lo tanto, la selectividad de la reacción , depende no solo de la naturaleza del catalizador metálico sino también de lasustrato .
Los ejemplos de mecanismos asociativos se encuentran comúnmente en la química de los complejos de metal plano plano 16e , por ejemplo, el complejo de Vaska y el tetracloroplatinato . Estos compuestos (MX 4 ) se unen al ligando Y entrante (sustituyente) para formar intermedios pentacoordinados MX 4 Y que en una etapa posterior disocia uno de sus ligandos. La disociación de Y no produce reacción, pero la disociación de X da como resultado una sustitución neta, dando el complejo 16e MX 3 Y. El primer paso es típicamente determinar la velocidad . Así, la entropía de activaciónes negativo, lo que indica un aumento en el orden en el sistema. Estas reacciones siguen una cinética de segundo orden : la velocidad de aparición del producto depende de la concentración de MX 4 e Y. La ley de velocidad se rige por el mecanismo Eigen-Wilkins .
Vía de intercambio asociativo [ editar ]
En muchas reacciones de sustitución, no se observan intermedios bien definidos, cuando la velocidad de dichos procesos está influenciada por la naturaleza del ligando entrante, la vía se denomina intercambio asociativo, abreviado I a . [3] Representante es el intercambio de agua a granel y coordinada en [V (H 2 O) 6 ] 2+ . En contraste, el ion un poco más compacto [Ni (H 2 O) 6 ] 2+ intercambia agua a través del I d . [4]
Efectos del emparejamiento de iones [ editar ]
Los complejos policatiónicos tienden a formar pares de iones con aniones y estos pares de iones a menudo experimentan reacciones a través de la vía I a . El nucleófilo retenido electrostáticamente puede intercambiar posiciones con un ligando en la primera esfera de coordinación, dando como resultado una sustitución neta. Un proceso ilustrativo proviene de la " anión " (reacción con un anión) del complejo hexaaquo de cromo (III):
-
- [Cr (H 2 O) 6 ] 3+ + SCN - ⇌ {[Cr (H 2 O) 6 ], NCS} 2+
- {[Cr (H 2 O) 6 ], NCS} 2+ ⇌ [Cr (H 2 O) 5 NCS] 2+ + H 2 O
Efectos especiales de ligando [ editar ]
En situaciones especiales, algunos ligandos participan en reacciones de sustitución que conducen a vías asociativas. Estos ligandos pueden adoptar múltiples motivos para unirse al metal, cada uno de los cuales involucra un número diferente de electrones "donados". Un caso clásico es el efecto de indenilo en las que un indenilo ligando reversible "se desliza de pentahapto (η 5 ) la coordinación a trihapto (η 3 ). Otros pi-ligandos se comportan de esta manera, por ejemplo, alilo (η 3 a eta 1 ) y naftaleno (η 6 a η 4) El óxido nítrico típicamente se une a metales para hacer una disposición de MNO lineal, en el que el óxido de nitrógeno se dice para donar 3e -al metal. En el curso de las reacciones de sustitución, la unidad MNO puede doblar, que convierte el 3e - lineal NO ligando a un 1e - doblado NO ligando.
S N 1cB mecanismo [ editar ]
La tasa de hidrólisis de los complejos de haluro de amina de cobalto (III) es engañosa, parece asociativa pero procede por una vía alternativa. La hidrólisis de [Co (NH 3 ) 5 Cl] 2+ sigue una cinética de segundo orden: la velocidad aumenta linealmente con la concentración de hidróxido, así como con el complejo de partida. En base a esta información, las reacciones parecerían proceder a través del ataque nucleófilo de hidróxido en cobalto. Sin embargo, los estudios muestran que el hidróxido desprotona un ligando de NH 3 para dar la base conjugada del complejo inicial, es decir, [Co (NH 3 ) 4 (NH 2 ) Cl] + . En este monocatión , el cloruro se disocia espontáneamente. Esta vía se llama mecanismo S N 1cB .
Mecanismo Eigen-Wilkins [ editar ]
El mecanismo Eigen-Wilkins, llamado así por los químicos Manfred Eigen y RG Wilkins, [5] es un mecanismo y una ley de velocidad en la química de coordinación que rige las reacciones de sustitución asociativa de complejos octaédricos. Se descubrió la sustitución por amoníaco de un complejo de cromo- (III) hexaaqua. [6] [7]La característica clave del mecanismo es un pre-equilibrio inicial determinante de la velocidad para formar un complejo de encuentro ML 6 -Y a partir del reactivo ML 6 y el ligando entrante Y. Este equilibrio está representado por la constante K E :
- ML 6 + Y ⇌ ML 6 -Y
La disociación posterior para formar el producto se rige por una constante de velocidad k:
- ML 6 -Y → ML 5 Y + L
Sigue una derivación simple de la ley de tasas de Eigen-Wilkins: [8]
- [ML 6 -Y] = K E [ML 6 ] [Y]
- [ML 6 -Y] = [M] tot - [ML 6 ]
- tasa = k [ML 6 -Y]
- tasa = kK E [Y] [ML 6 ]
Llegando a la forma final de la ley de tasas, utilizando la aproximación de estado estacionario (d [ML 6 -Y] / dt = 0),
- tasa = kK E [Y] [M] tot / (1 + K E [Y])
Ecuación de Eigen-Fuoss [ editar ]
Una nueva visión del paso de preequilibrio y su constante de equilibrio K E proviene de la ecuación de Fuoss-Eigen propuesta independientemente por Eigen y RM Fuoss:
- K E = (4π un 3 /3000) x N A exp (-V / RT)
Cuando a representa la distancia mínima de aproximación entre el complejo y el ligando en solución (en cm), N Aes la constante de Avogadro , R es la constante de gas y T es la temperatura de reacción. V es la energía potencial electrostática de los iones a esa distancia:
- V = z 1 z 2 e 2 / 4π a ε
Un valor típico para K E es 0.0202 dm 3 mol −1 para partículas neutras a una distancia de 200 pm. [9] El resultado de la ley de velocidad es que a altas concentraciones de Y, la velocidad se aproxima a k [M] tot mientras que a bajas concentraciones el resultado es kK E [M] tot [Y]. La ecuación de Eigen-Fuoss muestra que se obtienen valores más altos de K E (y, por lo tanto, un pre-equilibrio más rápido) para los iones grandes, cargados opuestamente en solución.
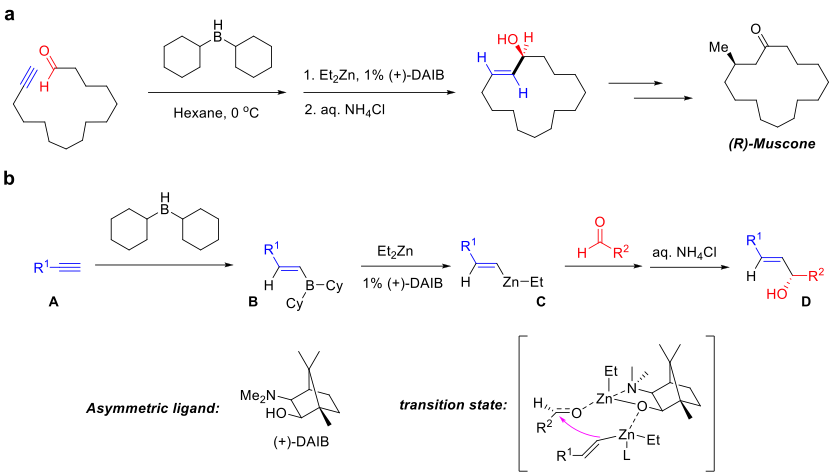
La adición asimétrica de alquenilmetales a aldehídos es una reacción química en la síntesis enantioselectiva que hace reaccionar un alquenilmetal con un aldehído para dar un alcohol alílico (Figura "Adición asimétrica de alquenilmetales a aldehídos"). La estereoselectividad en la reacción está típicamente controlada por los ligandos asimétricos utilizados, proporcionando una estrategia para introducir asimetría controlada en la molécula. [1] [2]La asimetría molecular controlada (o enantioselectividad) es crucial para controlar la bioactividad de las moléculas sintetizadas y exigida por las autoridades farmacéuticas en la síntesis de fármacos. En este caso, los ligandos quelatan al metal de transición para crear un entorno quiral que permite la formación selectiva de un enantiómero particular . Varios metales de transición como el zinc , níquel , cromo y rodio se han utilizado en esta reacción.
La adición asimétrica de alquenilmetales a los aldehídos se ha usado ampliamente en la síntesis total del producto natural. Por ejemplo, el paso clave de ciclación en la síntesis total de (R) - (-) - Muscone fue una adición asimétrica intramolecular de un derivado de vinilcinc a un aldehído usando un ligando quiral amino-iso borneol (Figura "(a) Adición asimétrica de alquenilcinc a aldehído en la síntesis total de muscone "). [3] La reacción usó un alquino terminal (A) como sustrato que generó el reactivo de alquenilborato (B) a través de la reacción de monohidroboración. Después de la transmetalación con dietilcinc, el reactivo de alquenilzinc generado (C) reaccionó aún más con el aldehído (D) mediante la adición exclusiva a la cara π bajo el control de (-) - 3-exo- (dimetilamino) isoborneol (DAIB) como ligando (Figura "( b) Pasos detallados para la reacción ").

autocatalítica si uno de los productos de reacción es también un catalizador para la misma reacción o una reacción acoplada. [1] Tal reacción se llama reacción autocatalítica .
Se puede decir que un conjunto de reacciones químicas es "colectivamente autocatalítico" si varias de esas reacciones producen, como productos de reacción, catalizadores de suficientes otras reacciones para que todo el conjunto de reacciones químicas sea autosuficiente dado un aporte de energía y moléculas alimenticias (ver conjunto autocatalítico ).
Reacciones químicas [ editar ]
Una reacción química de dos reactivos y dos productos se puede escribir como
donde las letras griegas son coeficientes estequiométricos y las letras latinas mayúsculas representan especies químicas. La reacción química procede tanto en dirección hacia adelante como hacia atrás. Esta ecuación se generaliza fácilmente a cualquier cantidad de reactivos, productos y reacciones.
Equilibrio químico [ editar ]
En el equilibrio químico, las velocidades de reacción directa e inversa son tales que cada especie química se crea al mismo ritmo que se destruye. En otras palabras, la velocidad de la reacción directa es igual a la velocidad de la reacción inversa.
Aquí, los corchetes indican la concentración de la especie química, en moles por litro, y k + y k - son constantes de velocidad .
Lejos del equilibrio [ editar ]
Lejos del equilibrio, las velocidades de reacción directa e inversa ya no se equilibran y la concentración de reactivos y productos ya no es constante. Por cada reacción hacia adelanteLas moléculas de A son destruidas. Por cada reacción inversa Se crean moléculas de A. En el caso de un paso de reacción elemental, el orden de reacción en cada dirección es igual a la molecularidad, de modo que la tasa de cambio en el número de moles de A es entonces
Este sistema de ecuaciones tiene un único punto fijo estable cuando las tasas directas y las tasas inversas son iguales (cuandopara cada especie). Esto significa que el sistema evoluciona al estado de equilibrio, y este es el único estado al que evoluciona. [2]
Reacciones autocatalíticas [ editar ]
Las reacciones autocatalíticas son aquellas en las que al menos uno de los productos es un reactivo. Quizás se pueda escribir la reacción autocatalítica más simple [1]
con las ecuaciones de velocidad (para una reacción elemental)
- .
En esta reacción, una molécula de la especie A interactúa con una molécula de la especie B. La molécula A se convierte en una molécula B. El producto final consiste en la molécula B original más la molécula B creada en la reacción.
La característica clave de estas ecuaciones de velocidad es que no son lineales ; el segundo término a la derecha varía según el cuadrado de la concentración de B. Esta característica puede conducir a múltiples puntos fijos del sistema, al igual que una ecuación cuadrática puede tener múltiples raíces. Múltiples puntos fijos permiten múltiples estados del sistema. Un sistema existente en múltiples estados macroscópicos es más ordenado (tiene una entropía más baja) que un sistema en un solo estado.
y
- .
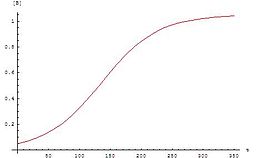
El gráfico para estas ecuaciones es una curva sigmoidea (específicamente una función logística ), que es típica para las reacciones autocatalíticas: estas reacciones químicas proceden lentamente al comienzo (el período de inducción ) porque hay poco catalizador presente, la velocidad de reacción aumenta progresivamente a medida que la reacción continúa a medida que aumenta la cantidad de catalizador y luego se ralentiza nuevamente a medida que disminuye la concentración de reactivo. Si la concentración de un reactivo o producto en un experimento sigue una curva sigmoidea, la reacción puede ser autocatalítica.
Estas ecuaciones cinéticas se aplican, por ejemplo, a la hidrólisis catalizada por ácido de algunos ésteres a ácidos carboxílicos y alcoholes . [3] Debe haber al menos algo de ácido presente inicialmente para iniciar el mecanismo catalizado; si no, la reacción debe comenzar por un camino alternativo no catalizado que generalmente es más lento. Las ecuaciones anteriores para el mecanismo catalizado implicarían que la concentración del producto ácido permanece cero para siempre. [3]
Creación de orden [ editar ]
Fondo [ editar ]
La segunda ley de la termodinámica establece que el trastorno ( entropía ) de un sistema físico o químico y sus alrededores (un sistema cerrado ) debe aumentar con el tiempo. Los sistemas que se dejan solos se vuelven cada vez más aleatorios , y la energía ordenada de un sistema como el movimiento uniforme se degrada eventualmente al movimiento aleatorio de las partículas en un baño de calor .
Sin embargo, hay muchos casos en los que los sistemas físicos se vuelven emergentes u ordenados espontáneamente . Por ejemplo, a pesar de la destrucción que causan, los huracanes tienen un movimiento de vórtice muy ordenado en comparación con el movimiento aleatorio de las moléculas de aire en una habitación cerrada. Aún más espectacular es el orden creado por los sistemas químicos; El más dramático es el orden asociado con la vida.
Esto es consistente con la Segunda Ley, que requiere que el desorden total de un sistema y sus alrededoresaumente con el tiempo. El orden se puede crear en un sistema mediante una disminución aún mayor en el orden de los alrededores del sistema. [4] En el ejemplo de huracán, los huracanes se forman a partir de un calentamiento desigual dentro de la atmósfera. La atmósfera de la Tierra está lejos del equilibrio térmico . El orden de la atmósfera de la Tierra aumenta, pero a expensas del orden del sol. El sol se está volviendo más desordenado a medida que envejece y arroja luz y material al resto del universo. El desorden total del sol y la tierra aumenta a pesar del hecho de que se generan huracanes ordenados en la tierra.
Un ejemplo similar existe para los sistemas químicos vivos. El sol proporciona energía a las plantas verdes. Las plantas verdes son alimento para otros sistemas químicos vivos. La energía absorbida por las plantas y convertida en energía química genera un sistema en la tierra que está ordenado y lejos del equilibrio químico . Aquí, la diferencia del equilibrio químico está determinada por un exceso de reactivos sobre la cantidad de equilibrio. Una vez más, el orden en la tierra se genera a expensas del aumento de entropía del sol. La entropía total de la tierra y el resto del universo aumenta, de acuerdo con la Segunda Ley.
Algunas reacciones autocatalíticas también generan orden en un sistema a expensas de su entorno. Por ejemplo, ( reacciones de reloj ) tienen intermedios cuyas concentraciones oscilan en el tiempo, correspondiente al orden temporal. Otras reacciones generan separación espacial de especies químicas correspondientes al orden espacial. Las reacciones más complejas están involucradas en las rutas metabólicas y las redes metabólicas en los sistemas biológicos .
La transición al orden a medida que aumenta la distancia desde el equilibrio no suele ser continua. El orden generalmente aparece abruptamente. El umbral entre el desorden del equilibrio químico y el orden se conoce como transición de fase . Las condiciones para una transición de fase se pueden determinar con la maquinaria matemática de la termodinámica del no equilibrio .
Orden temporal [ editar ]
Una reacción química no puede oscilar sobre una posición de equilibrio final porque la segunda ley de la termodinámica requiere que un sistema termodinámico se acerque al equilibrio y no retroceda. Para un sistema cerrado a temperatura y presión constantes, la energía libre de Gibbs debe disminuir continuamente y no oscilar. Sin embargo, es posible que las concentraciones de algunos intermedios de reacción oscilen, y también que la tasa de formación de productos oscile. [5]
Ejemplo idealizado: ecuación de Lotka-Volterra [ editar ]
Considere un conjunto acoplado de dos reacciones autocatalíticas en las que la concentración de uno de los reactivos A es mucho mayor que su valor de equilibrio. En este caso, la velocidad de reacción directa es mucho mayor que las velocidades inversas que podemos descuidar las velocidades inversas.
con las ecuaciones de velocidad
- .
Aquí, hemos descuidado el agotamiento del reactivo A, ya que su concentración es muy grande. Las constantes de velocidad para las tres reacciones son, y , respectivamente.
Este sistema de ecuaciones de velocidad se conoce como la ecuación de Lotka-Volterra y se asocia más estrechamente con la dinámica de la población en las relaciones depredador-presa. Este sistema de ecuaciones puede producir concentraciones oscilantes de los intermedios de reacción X e Y. La amplitud de las oscilaciones depende de la concentración de A (que disminuye sin oscilación). Tales oscilaciones son una forma de orden temporal emergente que no está presente en equilibrio.
Otro ejemplo idealizado: Brusselator [ editar ]
Otro ejemplo de un sistema que demuestra el orden temporal es el Brusselator (consulte la referencia de Prigogine). Se caracteriza por las reacciones.
con las ecuaciones de velocidad
donde, por conveniencia, las constantes de velocidad se han establecido en 1.
El Brusselator tiene un punto fijo en
- .
El punto fijo se vuelve inestable cuando
conduciendo a una oscilación del sistema. A diferencia de la ecuación de Lotka-Volterra, las oscilaciones del Brusselator no dependen de la cantidad de reactivo presente inicialmente. En cambio, después de un tiempo suficiente, las oscilaciones se acercan a un ciclo límite . [6]
Orden espacial [ editar ]
Un ejemplo idealizado de ruptura espacial de simetría espontánea es el caso en el que tenemos dos cajas de material separadas por una membrana permeable para que el material pueda difundirse entre las dos cajas. Se supone que hay Brusselators idénticos en cada caja con condiciones iniciales casi idénticas. (ver referencia de Prigogine)
Aquí, los subíndices numéricos indican en qué caja se encuentra el material. Existen términos adicionales proporcionales al coeficiente de difusión D que explican el intercambio de material entre cajas.
Si el sistema se inicia con las mismas condiciones en cada caja, entonces una pequeña fluctuación conducirá a la separación de materiales entre las dos cajas. Una caja tendrá un predominio de X y la otra tendrá un predominio de Y.
Ejemplos reales [ editar ]
Ejemplos reales de reacciones de reloj son la reacción de Belousov-Zhabotinsky ( reacción BZ), la reacción de Briggs-Rauscher , la reacción de Bray-Liebhafsky y la reacción de reloj de yodo . Estas son reacciones oscilatorias, y la concentración de productos y reactivos se puede aproximar en términos de oscilaciones amortiguadas .
La reacción más conocida, la reacción BZ, se puede crear con una mezcla de bromato de potasio. ácido malónico y sulfato de manganeso preparado en una solución calentada con ácido sulfúrico como solvente [7]
Ejemplo de óptica [ editar ]
Otro sistema autocatalítico es uno impulsado por luz acoplada a reacciones de fotopolimerización. En un proceso denominado autocatálisis óptica, se crea una retroalimentación positiva entre la intensidad de la luz y la tasa de fotopolimerización, a través de aumentos inducidos por la polimerización en el índice de refracción. La preferencia de la luz por ocupar regiones de mayor índice de refracción da como resultado una fuga de luz en regiones de mayor peso molecular, lo que amplifica la reacción fotoquímica. La retroalimentación positiva puede expresarse como: [8]
Observando que la tasa de fotopolimerización es proporcional a la intensidad [9] y que el índice de refracción es proporcional al peso molecular, [10] la retroalimentación positiva entre intensidad y fotopolimerización establece el comportamiento autocatalítico. Se ha demostrado que la autocatálisis óptica da como resultado la formación de patrones espontáneos en fotopolímeros. [11] [12] [13] Hosein y sus colegas descubrieron que la autocatálisis óptica también puede ocurrir en mezclas de polímeros fotorreactivos, y que el proceso puede inducir morfologías de fase binaria con el mismo patrón que el perfil de luz. [8] La luz sufre inestabilidad de modulación óptica, que se divide espontáneamente en una multitud de filamentos ópticos, y el sistema polimérico forma filamentos dentro de la estructura de mezcla. [8] El resultado es un nuevo sistema que combina el comportamiento óptico autocatalítico con la descomposición espinodal .
Ejemplo biológico [ editar ]
Se sabe que un ciclo metabólico importante, la glucólisis , muestra un orden temporal. [14] La glucólisis consiste en la degradación de una molécula de glucosa y la producción general de dos moléculas de ATP . Por lo tanto, el proceso es de gran importancia para la energía de las células vivas. La reacción de glucólisis global involucra glucosa , ADP , NAD , piruvato , ATP y NADH.
- .
Los detalles del proceso están bastante involucrados, sin embargo, una sección del proceso es autocatalizada por la fosfofructoquinasa (PFK). Esta parte del proceso es responsable de las oscilaciones en la ruta que conducen al proceso que oscila entre una forma activa y otra inactiva. Por lo tanto, la reacción autocatalítica puede modular el proceso.
Adaptación de formas de capas delgadas [ editar ]
Es posible utilizar los resultados de una reacción autocatalítica junto con la teoría del sistema de reacción-difusión para adaptar el diseño de una capa delgada. El proceso autocatalítico permite controlar el comportamiento no lineal del frente de oxidación , que se utiliza para establecer la geometría inicial necesaria para generar la geometría final arbitraria. [15] Se ha realizado con éxito en la oxidación húmeda depara obtener capas de formas arbitrarias de .
Transiciones de fase [ editar ]
Las cantidades iniciales de reactivos determinan la distancia desde un equilibrio químico del sistema. Cuanto mayores sean las concentraciones iniciales, más lejos está el sistema del equilibrio. A medida que aumenta la concentración inicial, se produce un cambio brusco en el orden . Este cambio abrupto se conoce como transición de fase . En la transición de fase, las fluctuaciones en las cantidades macroscópicas, como las concentraciones químicas, aumentan a medida que el sistema oscila entre el estado más ordenado (menor entropía, como el hielo) y el estado más desordenado (mayor entropía, como el agua líquida). Además, en la transición de fase, las ecuaciones macroscópicas, como las ecuaciones de velocidad, fallan. Las ecuaciones de velocidad pueden derivarse de consideraciones microscópicas. Las derivaciones generalmente se basan en una teoría de campo medioaproximación a ecuaciones dinámicas microscópicas. La teoría del campo medio se descompone en presencia de grandes fluctuaciones (ver el artículo sobre la teoría del campo medio para una discusión). Por lo tanto, dado que ocurren grandes fluctuaciones en la vecindad de una transición de fase, las ecuaciones macroscópicas, como las ecuaciones de velocidad, fallan. A medida que la concentración inicial aumenta aún más, el sistema se instala en un estado ordenado en el que las fluctuaciones son nuevamente pequeñas. (ver referencia de Prigogine)
Autocatálisis asimétrica [ editar ]
La autocatálisis asimétrica ocurre cuando el producto de reacción es quiral y por lo tanto actúa como un catalizador quiral para su propia producción. Las reacciones de este tipo, como la reacción de Soai , tienen la propiedad de que pueden amplificar un exceso enantiomérico muy pequeño en uno grande. Esto se ha propuesto como un paso importante en el origen de la homoquiralidad biológica .


![k _ {+} [A] ^ {\ alpha} [B] ^ {\ beta} = k _ {-} [S] ^ {\ sigma} [T] ^ {\ tau} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/e39ee9ee8897756407253f0af9c7942c4ae75f7c)

![{d \ over dt} [A] = - \ alpha k _ {+} [A] ^ {\ alpha} [B] ^ {\ beta} + \ alpha k _ {-} [S] ^ {\ sigma} [T ] ^ {\ tau} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bc3ff03bd9ea137fb863f9f1b2ff77c7744d326)
![{d \ over dt} [B] = - \ beta k _ {+} [A] ^ {\ alpha} [B] ^ {\ beta} + \ beta k _ {-} [S] ^ {\ sigma} [T ] ^ {\ tau} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/9966e3494fe6c1963b3fcc6c0f63876edc06bed1)
![{d \ over dt} [S] = \ sigma k _ {+} [A] ^ {\ alpha} [B] ^ {\ beta} - \ sigma k _ {-} [S] ^ {\ sigma} [T] ^ {\ tau} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/bdfde6f66b67e29215874f19eb6ea81b1077f3cf)
![{d \ over dt} [T] = \ tau k _ {+} [A] ^ {\ alpha} [B] ^ {\ beta} - \ tau k _ {-} [S] ^ {\ sigma} [T] ^ {\ tau} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/92033c0969f2facba06dcc8b1e51e1e9bfc13dc1)


![{d \ over dt} [A] = - k _ {+} [A] [B] + k _ {-} [B] ^ {2} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b56d2d10120edc5f81b31eb215a3c59121d2d89e)
![{d \ over dt} [B] = + k _ {+} [A] [B] -k _ {-} [B] ^ {2} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fe187f10f7df89b123d47bf155e81de07b7ec74)
![[A] = {\ frac {[A] _ {0} + [B] _ {0}} {1 + {\ frac {[B] _ {0}} {[A] _ {0}}} e ^ {([A] _ {0} + [B] _ {0}) kt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/441bd0aee36b9fc56db162b05fd2e398be4c1d4d)
![[B] = {\ frac {[A] _ {0} + [B] _ {0}} {1 + {\ frac {[A] _ {0}} {[B] _ {0}}} e ^ {- ([A] _ {0} + [B] _ {0}) kt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b5b30238c201994af2b92d366d4c3776b769a4f)




![{d \ over dt} [X] = k_ {1} [A] [X] -k_ {2} [X] [Y] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a77b3408455b678ccec148f2a29616a697a396e)
![{d \ over dt} [Y] = k_ {2} [X] [Y] -k_ {3} [Y] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c44500fc1af6f74c1efab6ab4ff34389aef68e8)







![{d \ over dt} [X] = [A] + [X] ^ {2} [Y] - [B] [X] - [X] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/a06ea7cbff840ad50908e05f352d2e88bed2fb34)
![{d \ over dt} [Y] = [B] [X] - [X] ^ {2} [Y] \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/148716087eb40a4d24d17bbba7c18ab3da5197fb)

![[X] = A \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c60d3f07657ef89c703f2cf343ff3f6e5dbb8cb)
![[Y] = {B \ sobre A} \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae4133213f54b64dded53106d2ffd1e05ebc1ad4)

![{d \ over dt} [X_ {1}] = [A] + [X_ {1}] ^ {2} [Y_ {1}] - [B] [X_ {1}] - [X_ {1}] + D_ {x} \ left (X_ {2} -X_ {1} \ right) \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/43aa7b6085abaefd859fdb893bc85591dc95580a)
![{d \ over dt} [Y_ {1}] = [B] [X_ {1}] - [X_ {1}] ^ {2} [Y_ {1}] + D_ {y} \ left (Y_ {2 } -Y_ {1} \ right) \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/307f4adeb149593fb8aa014e4402c91a620a0dcb)
![{d \ over dt} [X_ {2}] = [A] + [X_ {2}] ^ {2} [Y_ {2}] - [B] [X_ {2}] - [X_ {2}] + D_ {x} \ left (X_ {1} -X_ {2} \ right) \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/58781820d50098a583038d648e2ece437cec7def)
![{d \ over dt} [Y_ {2}] = [B] [X_ {2}] - [X_ {2}] ^ {2} [Y_ {2}] + D_ {y} \ left (Y_ {1 } -Y_ {2} \ right) \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6aa1ef766e264e2672c3577eff536bdbbfaf4b8)








No hay comentarios:
Publicar un comentario