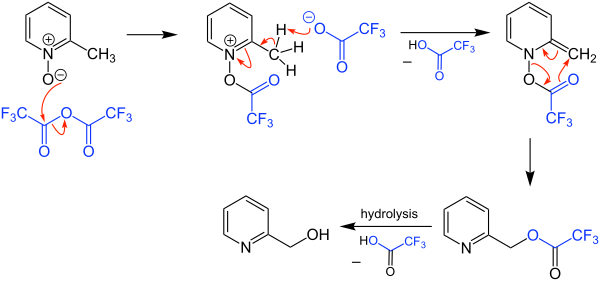
La reacción de Boekelheide es una reorganización de α-picolina- N-óxidos a hidroximetil piridinas . Lleva el nombre de Virgil Boekelheide, quien lo informó por primera vez en 1954. [1] Originalmente, la reacción se llevó a cabo utilizando anhídrido acético , que generalmente requería un período de reflujo (~ 140 ° C). La reacción se puede realizar usando anhídrido trifluoroacético (TFAA), que a menudo permite una reacción a temperatura ambiente. [2]
Mecanismo [ editar ]
El mecanismo de la reacción de Boekelheide comienza con una transferencia de acilo del anhídrido trifluoroacético al oxígeno del N- óxido . El α-metil carbono es luego desprotonado por el anión trifluoroacetato. Esto establece la molécula para un reordenamiento sigmatrópico [3.3] que proporciona la metilpiridina trifluoroacetilada. La hidrólisis del trifluoroacetato libera la hidroximetilpiridina.
La oxidación y la reducción en los vinos tintos pueden conducir a un color rojo ladrillo particularmente indeseable en los vinos tintos (o un color "anaranjado" en los vinos blancos ). Este proceso a veces se denomina dorado . [1] En términos químicos, esto se llama reacción redox porque primero el color del vino se profundiza después de la fermentación a través de la oxidación, y luego el color comienza a marrón después del embotellado por reducción. El dorado no se considera estrictamente malo en cada vino que se produce, ya que a veces el proceso de oxidación puede contribuir al estilo del vino de una manera positiva y deseable.
En términos generales, sin embargo, el dorado es una señal de que el vino se está deteriorando por la exposición excesiva al oxígeno. [2] Aunque el vino que se ha vuelto malo generalmente se asocia con el olor y el sabor del vinagre o la efervescencia no deseada , la oxidación en sí misma puede conducir a aromas de "nuez", "puré de manzana" y "malvavisco quemado". El componente de vinagre fuerte proviene del ácido acético formado a través de procesos bacterianos . Por lo general, se prefiere un nivel de pHmás bajo en los vinos porque disminuye el riesgo general de deterioro. El pH más bajo reduce el efecto del dorado y produce mejores colores, particularmente en vinos tintos.
Importancia del color [ editar ]
El color de un vino tinto tendrá muchas variables que influyen en él además de su exposición al oxígeno que pertenece a otros aspectos vitícolas , como diferentes climas de cultivo, variedades y métodos de producción. [3] Por ejemplo, los vinos elaborados con uvas híbridas pueden variar desde rosa claro a púrpura debido a su composición química. El Dr. Leo McCloskey, mejor conocido por sus contribuciones en el desarrollo del software Enologix , señala que "la ecología química dice que el sabor, el color y la fragancia de un vino son expresiones de su ecosistema". [4]
Sin embargo, cuando las personas perciben los vinos, las señales visuales recibidas del color del vino tienen un fuerte impacto en su opinión sobre el vino. En un sentido primitivo, las señales visuales generalmente tendrán un impacto más fuerte en los humanos que los componentes aromáticos, ya que los humanos han evolucionado para identificar cosas con la vista, en lugar de a través del olor en relación con otras especies evolucionadas que dependen más de las capacidades sensoriales que de la vista. Esta idea de un significado particular del color en la percepción del vino es especialmente cierta en los vinos tintos. [5]
Por lo tanto, el dorado es un tema importante tanto para los enólogos como para los consumidores de vino, y generalmente se evita. Una excepción bien conocida a esto es el jerez , que a menudo se desarrolla a propósito con oxidación como parte del proceso de producción; Sin embargo, puede considerarse un vino blanco, ya que se elabora tradicionalmente con uvas Palomino .
Efectos de olor [ editar ]
A través del envejecimiento del vino, sus compuestos aromáticos también se ven afectados. Los ésteres en el vino que se crearon inicialmente durante la fermentación se reducen a medida que se descomponen en grupos de alcohol y carboxilo, por lo que disminuyen los olores florales y afrutados que están asociados con la frescura en un vino. Mientras tanto, los olores a nuez y cocidos aumentan a través de la degradación de carbohidratos .
El efecto captodativo es la estabilización de radicalespor un efecto sinérgico de un sustituyente que retiraelectrones y un sustituyente donador de electrones. [2] [3]El nombre se origina porque el grupo de extracción de electrones (EWG) a veces se denomina grupo "captor", mientras que el grupo de donación de electrones (EDG) es el sustituyente "dativo". [3] Las olefinas con este patrón sustituyente a veces se describen como captodativas. [2] Las reacciones radicales juegan un papel integral en varias reacciones químicas y también son importantes para el campo de la ciencia de los polímeros . [4]
Cuando los EDG y los EWG están cerca del centro radical, aumenta la estabilidad del centro radical. [1] Los sustituyentes pueden estabilizar cinéticamente los centros radicales evitando que las moléculas y otros centros radicales reaccionen con el centro. [3] Los sustituyentes estabilizan termodinámicamente el centro al deslocalizar el ion radical mediante resonancia . [1] [3] Estos mecanismos de estabilización conducen a una tasa mejorada de reacciones de radicales libres. [5] En la figura de la derecha, el radical se deslocaliza entre el nitrilo captor (-CN) y la amina secundaria dativa (-N (CH 3 )2 ), estabilizando así el centro radical.
Efecto sustituyente en las velocidades de reacción [ editar ]
Ciertos sustituyentes son mejores estabilizadores de los centros radicales que otros. [6] Esto está influenciado por la capacidad del sustituyente para deslocalizar el ion radical en la estructura del estado de transición . [3] Ladeslocalización del ion radical estabiliza la estructura del estado de transición. Como resultado, la energía de activación disminuye, mejorando la velocidad de la reacción general. Según el efecto captodativo, la velocidad de una reacción es mayor cuando tanto el EDG como el EWG son capaces de deslocalizar el ion radical en la estructura del estado de transición. [7]
Ito y sus colaboradores observaron la velocidad de las reacciones de adición del radical ariltiilo a las olefinas disustituidas. [6] Las olefinas contenían un grupo de nitrilo EWG y EDG variables y se observó el efecto de los EDG variables sobre la velocidad de las reacciones de adición. El proceso estudiado fue:
La velocidad de la reacción de adición se aceleró mediante los siguientes EDG en orden creciente: H 3 2 CH 3 . Cuando R = OCH 2 CH 3 , la velocidad de la reacción es la más rápida porque la reacción tiene la menor energía de activación (ΔG ‡ ). Los grupos etoxi y ciano pueden deslocalizar el ion radical en el estado de transición, estabilizando así el centro radical. La mejora de la tasa se debe al efecto captodativo. Cuando R = H, la reacción tiene la mayor energía de activación porque el centro radical no está estabilizado por el efecto captodativo. El átomo de hidrógeno no puede deslocalizar el ion radical. Por lo tanto, la reacción es lenta en relación con R = OCH 2CH 3 caso. Cuando R = CH 3 , la velocidad de reacción es más rápida en relación con cuando R = H porque los grupos metilo tienen más capacidad de donar electrones. [6] Sin embargo, la velocidad de reacción es más lenta en relación a cuando R = OCH 2 CH 3 porque el ión radical no está deslocalizado sobre el grupo metilo. Por lo tanto, el captativo no influye en la velocidad de reacción si el ión radical no se deslocaliza en los sustituyentes EWG y EDG. Cada uno de estos casos se ilustra a continuación:
Usos en síntesis [ editar ]
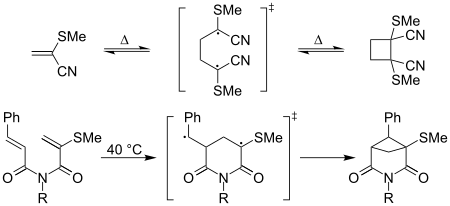
El término "etilenos captodativos" se ha utilizado en el contexto de reacciones de cicloadición que involucran intermediarios radicales captodativos, por ejemplo, la dimerización térmica [2 + 2] frente a frente de 2-metiltioacrilonitrilo ocurre fácilmente a temperatura ambiente; La formación del derivado de ciclobutano equivalente del acrilonitrilo es "lenta". [8] También se ha informado que las ciclizaciones intramoleculares [2 + 2] aumentan por los efectos captodativos, [8] como se muestra a continuación:
Se han discutido efectos similares para otras cicloadiciones tales como [3 + 2], [4 + 2] y [3 + 4] para etilenos captodativos. [9] También se han informado efectos en casos como las reacciones de Diels-Alder y Friedel-Craftsen los casos en que las olefinas nucleofílicas reaccionan de manera ineficiente, atribuidas al estado de transición cercano a un birradical y, por lo tanto, estabilizado. [8] [10] Estos estudios han revelado una dependencia directa en Δω, una diferencia en la electrofilicidad y la naturaleza polar de la reacción. Se han utilizado debido a su naturaleza altamente reactiva, estereoselectiva y regioselectiva dentro de estas reacciones. [9] [11]
Las olefinas captodativas en las reacciones también muestran efectos interferentes con el típico efecto de isótopo cinético , permitiendo que ocurran reacciones atípicas con moléculas marcadas con isótopos [12] y demostrando que los mecanismos y estados de transición de estas reacciones han sido influenciados.
Aplicación de ciencia de polímeros [ editar ]
La polimerización por radicales libres , donde los radicales son los portadores de la cadena en la propagación del proceso, representaron 40 mil millones de las 110 mil millones de libras de polímeros producidos en los Estados Unidos en 2001. [13] Las olefinas captodativas tienen la ventaja específica de responder a efectos solventes sin el efecto de desestabilizar el radical. [4] También han demostrado experimentar su transformación radical de forma espontánea, lo que les permite ser útiles en el esclarecimiento del mecanismo de polimerización y se comprende mejor a través de los estudios de RMN . Además, los etanos captodativos son iniciadores con propiedades únicas que proporcionan una mayor distribución de peso molecular y forman copolímeros de bloques.a través de los mecanismos radicales conocidos. Los polímeros obtenidos a partir de materiales de partida sustituidos por captación exhiben propiedades "deseables" tales como actividad óptica, diferencias en polaridad, afinidad por solvente , estabilidad térmica y mecánica.
- Se sabe que los polímeros con sustituyentes polares tienen aplicaciones interesantes, incluso dentro de materialeseléctricos y ópticos .
- Estos polímeros son típicamente transparentes.
- La T di (descomposición inicial) de estos polímeros es relativamente baja en comparación con sus análogos, pero tiene una T dmrelativamente más alta (temperatura máxima de cambio de peso). Es decir, aunque comenzarán a derretirse más rápido, tardarán más en cambiar completamente las fases.
- Los polímeros con grandes estabilizaciones captodativas pueden comenzar a descomprimir rápidamente a su monómero de partida al calentarlos.
- Los polímeros bifuncionales , con dos grupos funcionales diferentes en cada unidad de monómero, se forman comúnmente a partir de los monómeros captodativos.
- Los grupos dativos alteran sustancialmente la solubilidad a través del enlace de hidrógeno en polímeros bifuncionales específicos (ver figura anterior). Sin embargo, no se ha desarrollado una correlación clara en este momento, ya que no se han investigado todas las combinaciones de sustituyentes y solubilidades.
- El polímero captodativo es altamente funcional en quelatos con ciertos metales.










No hay comentarios:
Publicar un comentario