Un auxocromo (del griego antiguo αὐξάνω auxanō "aumentar" y χρῶμα chrōma "color") es un grupo de átomos unidos a un cromóforo que modifica la capacidad de ese cromóforo para absorber la luz . Ellos mismos no logran producir el color; pero cuando está presente junto con los cromóforos en un compuesto orgánico intensifica el color del cromógeno . [1] Los ejemplos incluyen el grupo hidroxilo (−OH), el grupo amino (−NH 2 ), el grupo aldehído (−CHO) y el grupo metil mercaptano (−SCH 3) [2]
Un auxocromo es un grupo funcional de átomos con uno o más pares de electrones solitarios cuando está unido a un cromóforo, altera tanto la longitud de onda como la intensidad de absorción . Si estos grupos están en conjugación directa con el sistema pi del cromóforo, pueden aumentar la longitud de onda a la que se absorbe la luz y, como resultado, intensificar la absorción. Una característica de estos auxocromos es la presencia de al menos un par solitario de electrones que puede verse como una extensión del sistema conjugado por resonancia.
Efectos sobre el cromóforo [ editar ]
Aumenta el color de cualquier compuesto orgánico . Por ejemplo, el benceno no muestra el color ya que no tiene un cromóforo; pero el nitrobenceno es de color amarillo pálido debido a la presencia de un grupo nitro (−NO 2 ) que actúa como un cromóforo. Pero el p -hidroxinitrobenceno exhibe un color amarillo intenso, en el que el grupo -OH actúa como un auxocromo. Aquí el auxocromo (−OH) se conjuga con el cromóforo -NO 2 . Se observa un comportamiento similar en azobenceno que tiene un color rojo, pero el p -hidroxiazolbenceno es de color rojo oscuro.
La presencia de un auxocromo en la molécula de cromógeno es esencial para hacer un tinte . Sin embargo, si un auxocromo está presente en la posición meta del cromóforo, no afecta el color.
Un auxocromo se conoce como un compuesto que produce un desplazamiento batocromático , también conocido como desplazamiento rojo porque aumenta la longitud de onda de absorción y, por lo tanto, se acerca a la luz infrarroja . Las reglas de Woodward-Fieser estiman el cambio en la longitud de onda de absorción máxima para varios auxocromos unidos a un sistema conjugado en una molécula orgánica.
Un auxocromo ayuda a un tinte a unirse al objeto que se va a colorear. La disociación electrolítica del grupo auxocromo ayuda a la unión y es por esta razón que una sustancia básica toma un colorante ácido .
Explicación de la modificación del color [ editar ]
Una molécula exhibe color porque absorbe colores de ciertas frecuencias y refleja o transmite otras. Son capaces de absorber y emitir luz de varias frecuencias. Las ondas de luz con una frecuencia muy cercana a su frecuencia natural se absorben fácilmente. Este fenómeno, conocido como resonancia , significa que la molécula puede absorber la radiación de una frecuencia particular que es la misma que la frecuencia del movimiento de electrones dentro de la molécula. El cromóforo es la parte de la molécula donde la diferencia de energía entre dos orbitales moleculares diferentes se encuentra dentro del rango del espectro visible.y por lo tanto absorbe algunos colores particulares de la luz visible. Por lo tanto, la molécula aparece coloreada. Cuando los auxocromos están unidos a la molécula, la frecuencia natural del cromóforo cambia y, por lo tanto, el color se modifica. Diferentes auxocromos producen diferentes efectos en el cromóforo que a su vez provoca la absorción de luz de otras partes del espectro. Normalmente, se eligen los auxocromos que intensifican el color. [3]
Clasificación [ editar ]
Existen principalmente dos tipos de auxocromos:
La reacción de Bargellini es una reacción química descubierta en 1906 por el químico italiano Guido Bargellini . [1] La reacción original fue una mezcla de los reactivos fenol , cloroformo y acetona en presencia de una solución de hidróxido de sodio . [2] Antes de la investigación de Bargellini, el producto atribuido a esta reacción multicomponente (o MCR) había sido descrito como un derivado de fenol en textos de química en ese momento. Sin embargo, Bargellini demostró que un derivado de ácido carboxílico era en realidad la estructura correcta.
Más tarde, los químicos orgánicos han usado la reacción como un método general de síntesis orgánica para morfolinonas o piperazinonas altamente impedidas o voluminosas a partir de cetonas (particularmente acetona ) y β-aminoalcoholes o diaminas.
Historia [ editar ]
Guido Bargellini fue discípulo de Hermann Emil Louis Fischer , químico alemán y premio Nobel famoso por la reacción homónima de esterificación de Fischer . Bargellini hizo su investigación de laboratorio postdoctoral en el laboratorio de Fischer. Pasó la mayor parte de su carrera como químico en la Universidad de Roma .
Su interés en las cumarinas , un compuesto recientemente aislado en ese momento, llevó a Bargellini a experimentar con reacciones de múltiples componentes (MCR) entre fenoles , cloroformo y acetona en una solución de hidróxido de sodio . Descubrió que la estructura dada al compuesto producía un ácido carboxílico enlugar de un fenol como se pensaba anteriormente. En 1894, Link, un químico alemán, publicó la reacción en Chemisches Zentralblatt y la patentó. Sin embargo, escribió que el producto era una cetona o un fenol, específicamente afirmó que era un "hidrifenilhidroxiisopropil keton" o "hidroxiisobutirilfenol". [3]Cuando Bargellini realizó el mismo experimento y comenzó a probar el producto, las propiedades químicas no podían ser de una cetona o un fenol. En cambio, estaba seguro de que era un ácido carboxílico, específicamente un "ácido α-fenoxisobutírico". El propio Link experimentó con reacciones en 1900 que demostraron que su afirmación original era errónea, pero que nunca cambió. Como Bargellini identificó correctamente el producto, su estructura y propiedades, luego publicó sus resultados en la Gazzetta Chimica Italiana , la reacción recibió su nombre.
Sin embargo, la importancia de la reacción en la síntesis orgánica y más tarde en la industria farmacéutica la ha hecho históricamente importante. Dado que la reacción es relativamente fácil de realizar, ya que los reactivos están disponibles, se nombraron muchas otras reacciones casi idénticas en las décadas posteriores. Este descubrimiento abrió el camino para una nueva reacción de transformación, las reacciones de tipo Bergallini actualmente establecidas, que ha sido de gran importancia, específicamente en la industria farmacéutica . También allanó el camino para reacciones de nombres posteriores, como las reacciones Jocic-Reeve y Corey-Link. Jocic-Reeve y Corey-Link casi siempre aparecen junto con la reacción de Bargellini en un MCR. La reacción misma se ha modificado varias veces para aumentar la eficiencia o producir un producto modificado.
La adaptabilidad de la reacción es uno de sus mayores aspectos. No ha pasado ninguna década sin una adición o giro importante de la reacción que tiene lugar. En las propias palabras del autor, "La primera fase de la reacción es probablemente la formación de acetonacloroformo (que, de hecho, puede usarse en lugar del cloroformo), y luego el hidróxido de sodio actúa en presencia de acetona, produciendo ácido α-hidroxiisobutírico , que, con el fenol, proporciona ácido α-fenoxiisobutírico. El cloroformo también puede ser reemplazado por bromoformo , bromuro , cloral o tetracloruro de carbono o tetrabromuro ". La mayoría de los libros de texto describen la reacción como una forma de hacermorfolinonas o piperazinonas , pero su uso se extiende mucho más que eso.
Cien años después, la reacción de Bargellini en sí misma se usó para la condensación de cumarinas , un giro irónico a la historia de la reacción, ya que este era el principal compuesto de interés de Bargellini y su propia reacción con nombre la produjo. [4]
Reacciones y mecanismos de reacción [ editar ]
La reacción original de Bargellini (1906):
Mecanismo de reacción para la reacción original de Bargellini (1906):
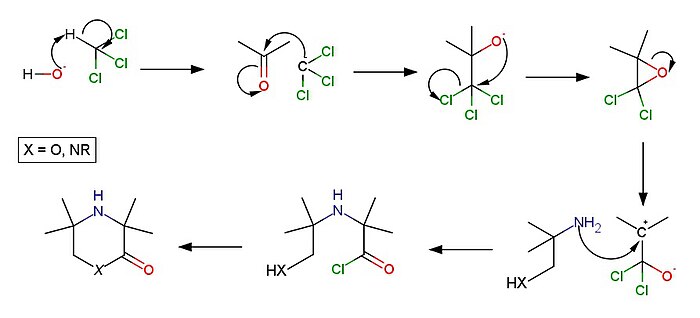
La reacción actual de Bargellini utilizada para la síntesis de morfolinonas o piperazinonas impedidas a partir de cetonas (principalmente acetona) y 2-amino-2-metilpropan-1-ol (β-aminoalcoholes) O 1,2-diaminopropanos (diaminas). El disolvente utilizado es el diclorometano (DCM), también conocido como cloruro de metileno con un catalizador de cloruro de benciltrietilamonio . El solvente y el catalizador se cambian frecuentemente cuando se usan diferentes reactivos. Las diaminas tienden a dar mayores rendimientos del producto que los β- aminoalcoholes , como se muestra en los dos escenarios posibles a continuación:
Mecanismo de reacción para la reacción de Bargellini:
El mecanismo de reacción continúa cuando se agrega una cetona estéricamente accesible, generalmente acetona, a una solución de cloroformo (triclorometano) en condiciones básicas fuertes, creando un anión triclorometuro por desprotonación . Esto forma el triclorometil carbinol o alcóxido correspondiente , de manera similar a la reacción de Grignard . [5]
Este producto trihalogenado está sujeto a adición a través de una gema de eterificación intramolecular inducida por bases, dicloro epoxi. La amina puede atacar al oxirano debido a la formación de carbocatión terciario en una sustitución nucleófila de eliminación concertada SN1 de un átomo de cloro. El intermediario nucleofílico es altamente reactivo y regioselectivo en el carbono α, lo que da como resultado la formación de un cloruro de ácido carboxílico sustituido con α.
El paso final ocurre mediante la sustitución nucleofílica de acilo y la solvolisis , donde el grupo amino o hidroxilo ataca el cloruro de ácido formando el heterociclo correspondiente . [6] El producto final es un derivado de ácido carboxílico (principalmente lactonas y amidas).





No hay comentarios:
Publicar un comentario